ST и сулфитите се използват за предотвратяване на гъбични разваляния и покафеняване на белени плодове и зеленчуци и са отговорни за причиняване на алергични реакции (Vally et al., 2009).
Свързани термини:
- Нитрит
- Натриев нитрит
- Тиоцианат
- Тиосулфат
- Хидроксокобаламин
- Токсичност
- Титруване
- Агар
- Румен
- Протозои
Изтеглете като PDF
За тази страница
Водороден сулфид в редокс биологията, част А
Рума Банерджи,. Прамод К. Ядав, в Методи в ензимологията, 2015
3.3 Анализи за роданес
3.3.1 Анализ за образуване на тиоцианат от роданес
1 М натриев тиосулфат
1 М калиев цианид
15% (w/v) разтвор на формалдехид
Разтвор на неахидрат на железен нитрат (6,6 g Fe (NO3) 3 ∙ 9H2O, разтворени в 3,4 ml азотна киселина. Крайният обем се регулира на 50 ml).
300 mM HEPES буфер, рН 7,4, съдържащ 150 mM NaCl.
Метод: В полистиролова кювета добавете 12,5 μl натриев тиосулфат, 12,5 μl калиев цианид и 225 μl HEPES буфер при 25 ° C. Реакцията се инициира чрез добавяне на 0,5 μg роданес. След 5 минути реакцията се прекратява чрез добавяне на 250 μl 15% (w/v) формалдехид и реакционната смес се центрофугира в продължение на 5 минути при 10 000 × g за отстраняване на протеина. Добавянето на 0,5 ml железен нитрат към супернатанта води до развитие на червен цвят поради образуването на железен тиоцианат, което се наблюдава при 460 nm. Контролна реакция, в която липсва родан, се провежда паралелно. Количеството образуван тиоцианат се определя, като се използва стандартна крива, генерирана с тиоцианат, варираща от 0,1 до 5 μmol. Една единица ензимна активност катализира образуването на 1 μmol тиоцианат min - 1 при 25 ° C. Специфичната активност се изразява като единици mg протеин - 1 .
3.3.2 Анализ за получаване на тиосулфат от роданан
1 М натриев тиосулфат
100 mM натриев сулфит
50 mM GSSH (вж. Раздел 3.2.1 за подготовка)
100 mM монобромбиман, разтворен в DMSO
100% оцетна киселина
0,2 тМ натриев цитрат, рН 2,0
100 mM HEPES буфер, рН 7,4, съдържащ 150 mM NaCl
Метод: Пробната смес се получава чрез смесване на 2 μl натриев сулфит, 8 μl GSSH в 200 μl буфер HEPES и 1 μg роданес. Реакцията се инициира чрез добавяне на 1 μg роданан и се инкубира в продължение на 5 минути при 25 ° C, последвано от дериватизация на проби с 2 μl монобромбиман. Инкубацията продължава 10 минути преди подкисляването със 100 μl натриев цитрат. Паралелно се приготвя контролна реакция, в която липсва родан. Дериватизираните проби се центрофугират при 10 000 × g в продължение на 10 минути при 4 ° C и 50 μl от супернатантата се инжектират върху C8 обратнофазова HPLC колона (4,6 × 150 mm, 3 μm опаковка, Phenomenex), предварително уравновесена с 80% разтворител А (10% метанол и 0,25% оцетна киселина) и 20% разтворител В (90% метанол и 0,25% оцетна киселина). Пробата се елуира, като се използва следния градиент: разтворител В: 20% от 0 до 10 минути, 20-40% от 10 до 25 минути, 40–90% от 25 до 30 минути, 90–100% от 30 до 32 минути, 100% от 32 до 35 минути, 100–20% от 35 до 37 минути и 20% от 37 до 40 минути. Дебитът е 0,75 ml min - 1. Бимановият адукт на тиосулфат се елуира при
22 минути при тези условия и се открива чрез възбуждане при 340 nm и излъчване при 450 nm. Концентрацията на тиосулфат се определя, като се използват тиосулфатни стандарти с известна концентрация. Една единица ензимна активност катализира образуването на 1 μmol тиосулфат min - 1 при 25 ° C. Специфичната активност се изразява в единици mg - 1 протеин.
3.3.3 Анализ за производство на H2S от роданес
1 М натриев тиосулфат
200 mM глутатион
200 тМ цистеин
200 mM хомоцистеин
100 mM оловен ацетат
100 mM HEPES буфер, рН 7,4, съдържащ 150 mM NaCl
Метод: Пригответе реакционната смес в полистиролова кювета, като добавите 1,5 μl тиосулфат, 50 μl глутатион (или 50 μl цистеин или 100 μl хомоцистеин), 2 μl оловен ацетат и 350 μl HEPES буфер в краен обем от 500 μl. Кюветата, поставена в спектрофотометър, се поддържа при 37 ° С в продължение на 4 минути. Реакцията се инициира чрез добавяне на 1-10 μg роданес. Наблюдава се увеличаването на абсорбцията при 390 nm поради образуване на оловен сулфид. Специфичната активност се изчислява, като се използва моларен коефициент на екстинкция от 5500 М - 1 см - 1 за оловен сулфид (Singh et al., 2009).
Фармакология на кръвно-мозъчната бариера: насочване към нарушения на ЦНС
Нанси Д. Дулитъл,. Едуард А. Нойвелт, в Напредък във фармакологията, 2014
4 Проучвания за химическа защита
Платиновата химиотерапия е свързана с прогресивна и необратима ототоксичност и може също да причини токсичност на костния мозък, бъбречна токсичност и хепатотоксичност. Индуцираната от платината токсичност се медиира поне отчасти от увреждане на свободните радикали. Съдържащите сяра тиолови хемопротективни агенти, които имитират активността на ендогенния антиоксидант глутатион, могат да предпазят от увреждане на свободните радикали и химиотерапевтична токсичност. Нашите предклинични и клинични проучвания са оценили химиопротекцията, използвайки STS и N-ацетилцистеин (NAC).
4.1 Предклинични изследвания на химиопротекция с тиоли
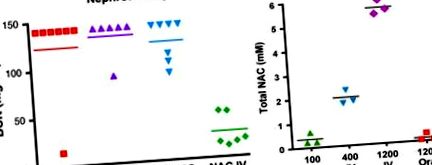
Фигура 11. Ефект на дозата и начина на приложение върху хемопротекцията на N-ацетилцистеин (NAC). (А) Нефропротекция. Плъховете получават нефротоксична доза цисплатин, последвана за 4 часа, без NAC или NAC 400 mg/kg, дадени през перорален или IV път на приложение. NAC значително намалява индуцираната от цисплатин токсичност за бъбреците, когато се прилага интравенозно, но не и перорално. (B) NAC фармакология. Концентрациите на NAC в серума са измерени чрез HPLC 15 минути след IV или перорално приложение. Хемопротективните дози NAC (400–1000 mg/kg) дават пикови концентрации в кръвта от 2 mM или по-големи само когато се прилагат интравенозно и не са ефективни, когато се прилагат интраперитонеално или перорално.
Клиничната употреба на хемопротекция е ограничена от възможността за защита на рака срещу химиотерапевтична токсичност. Нашите in vitro проучвания демонстрират, че докато STS и NAC са защитни за туморните клетки, ако се прилагат едновременно с химиотерапията, защитата на туморните клетки се губи, ако тиолите се забавят с 2–4 часа (Muldoon et al., 2001; Wu, Muldoon, & Neuwelt, 2005). STS не е защитен от тумор в миши модел на невробластом, ако се забави до 6 часа след цисплатин (Harned et al., 2008). При модел на метастази на рак на белия дроб на плъх в мозъка, 8 h забавено STS, 1 h предварително лечение с NAC или комбинацията от NAC предварителна обработка плюс STS последващо лечение не повлиява антитуморната ефикасност на химиотерапията с карбоплатин (Neuwelt et al., 2004). По-нататък оценихме въздействието на времето на NAC върху ефикасността на цисплатин в модели на плъхове на педиатрични тумори (Muldoon, Wu, Pagel и Neuwelt, представени за публикуване). Установихме, че предварителната обработка с NAC значително намалява ефикасността на цисплатин както при системен модел на солиден тумор (невробластом), така и при интрацеребрален туморен модел (медулобластом). За разлика от това, забавянето на NAC до 4 часа след цисплатин не намалява ефикасността на химиотерапията и в двата туморни модела.
4.2 Клинични проучвания за химиопротекция с тиоли
Интензивните дози химиотерапевтични стратегии за лечение на злокачествени мозъчни тумори изискват свеждане до минимум на ЦНС и системна токсичност. Карбоплатинът показва ефикасност при злокачествени мозъчни тумори. Въпреки това, карбоплатинът причинява миелосупресия, включително тежка тромбоцитопения, като често изисква трансфузия на тромбоцити и намаляване на дозата при последващи лечения с карбоплатин. Когато се прилага заедно с BBBD, карбоплатинът (IA) причинява необратима загуба на слуха при голяма част от пациентите (Doolittle, Muldoon, et al., 2001; Neuwelt, Brummett, et al., 1998).
Фигура 12. Натриевият тиосулфат (STS) показва защита на слуха при възрастни със злокачествени мозъчни тумори. Сравнение на изместването на прага на слуха спрямо броя на лечението с карбоплатин, при 4000 Hz, при исторически сравнения пациенти с мозъчен тумор, лекувани с карбоплатин (интраартериален [IA]) с нарушение на кръвно-мозъчната бариера (BBBD) без STS и пациенти с мозъчен тумор, лекувани със забавено STS 2 часа (STS2) или 4 часа (STS4) след карбоплатин (IA) с BBBD. Имаше значителна разлика в защитата на слуха между групите за лечение на STS и историческата група за сравнение (P = 0,0075).
Препечатано от Doolittle, Muldoon, et al. (2001) .
Клиничното проучване на фаза I на NAC при възрастни пациенти, подложени на ендоваскуларни процедури, е почти завършено. Шестнадесет пациенти са рандомизирани да получават IV или IA NAC в проучване за повишаване на стандартната доза. С наближаването на проучването изглежда, че MTD на NAC е в диапазона от 300-450 mg/kg. В ход е проучване за повишаване на дозата на NAC на фаза I при деца с различни ракови диагнози, подложени на лечение с химиотерапия на базата на цисплатин.
АНТИОКСИДАНТИ | Синтетични антиоксиданти
Натриев тиосулфат
Добавянето на сяра към натриевия сулфит води до натриев тиосулфат, сол, която съдържа S-S връзка. Неговите антиоксидантни свойства се дължат на наличието на редуциран серен атом, но той също така образува силни комплекси с железни, медни и други метални йони. Може да се добавя към алкохолни напитки (0,00005%) и готварска сол (
Химиотерапия при нарушаване на кръвно-мозъчната бариера
Нанси Д. Дулитъл,. Едуард А. Нойвелт, в Наръчник по химиотерапия на мозъчен тумор, 2006
КЛИНИЧНИ ИЗСЛЕДВАНИЯ НА ТИОЛНА ХЕМОЗАЩИТА
Клиничните проучвания показват защита на слуха, когато се прилагат високи дози STS (16–20 g/m 2) като част от двукамерния модел при пациенти със злокачествени мозъчни тумори [24, 25]. Тоест, карбоплатинът се прилага интраартериално веднага след BBBD. Висока доза STS се прилага интравенозно по забавен начин, 4 (или 4 и 8) часа след карбоплатин, като по този начин се осигурява пространствено и времево разделяне между химиотерапията и химиопротекцията. Проучването показа ясен защитен ефект срещу индуцирана от карбоплатин загуба на слуха [25].
Прегледахме хематологични данни от пациенти със злокачествени мозъчни тумори, лекувани с карбоплатин (интраартериално), циклофосфамид (интравенозно) и етопозиден или етопозиден фосфат (интраартериален или интравенозен) BBBD с (n = 29) или без (n = 24) забавено STS с висока доза за защита на слуха (вж. таблица 18.2) [42]. STS се прилага 4 (или 4 и 8) часа след карбоплатин. Степента на токсичност на тромбоцитите от степен 3 или 4 (Общи критерии за токсичност по NCI) без STS е била 47,8%, а със STS - 17,2%; е налице значителна асоциация на тромбоцитна токсичност степен 3 или 4 при пациенти без лечение на STS (p = 0,0018). Скоростите на намаляване на дозата на карбоплатина, контролиращи предишната химиотерапия, са били статистически значими между двете групи (p = 0,0046). Тези резултати предполагат, че STS може да предпазва от тежка тромбоцитопения, като намалява броя на кръвопреливанията на тромбоцити и намалява дозата на карбоплатина.
ТАБЛИЦА 18.2. Процент пациенти и проценти курсове на карбоплатин с тромбоцити Nadir По-малко от 20 × 10/mm 3, процентът на пациентите и курсове карбоплатин, изискващи трансфузия на тромбоцити, и процентът на пациентите, които се нуждаят от намаляване на дозата на карбоплатин
| Карбоплатин/без STS | |||
| n = 24 пациенти | 25% пациенти | 33% пациенти | 33% пациенти |
| 125 курса | 7% курсове | 9% курсове | |
| Карбоплатин/STS | |||
| n = 29 пациенти | 4% пациенти | 7% пациенти | 0% пациенти |
| 129 курса | 1% курсове | 2% курсове |
В ход е рандомизирано клинично изпитване за по-окончателно определяне на ефекта на забавените STS с високи дози върху броя на тромбоцитите при пациенти със злокачествени мозъчни тумори. Проспективното клинично проучване включва карбоплатин (интраартериално), циклофосфамид (интравенозно) и етопозид фосфат (интравенозно) без BBBD, при пациенти с високостепенен глиом, с субекти, рандомизирани да получават отложена STS с високи дози (интравенозно) или без STS . Първичните крайни точки са процента от пациентите с надир на тромбоцитите 3/mm 3 и процента от пациентите, които се нуждаят от трансфузия на тромбоцити. Туморният отговор и продължителността на отговора се проследяват, за да се определи по-окончателно ефектът от STS върху клиничните резултати.
Цисплатинът е широко използван и ефективен химиотерапевтичен агент, но има висока честота на свързани токсичности, включително токсичност на слуха. Обсъжда се проспективно проучване на фаза 3 за детска онкологична група, при което отложените STS с високи дози ще бъдат оценени в няколко педиатрични хистологии, които рутинно се лекуват с цисплатин (интравенозно). Това проучване ще оцени дали може да се постигне защита на слуха със забавено STS при педиатричната популация, без да се намалява противотуморната ефикасност.
Тече клинично проучване за повишаване на дозата на NAC за фаза 1, за да се оцени токсичността и да се определи максимално поносимата доза NAC, приложена с химиотерапия на базата на карбоплатин при пациенти със злокачествени мозъчни тумори. NAC се прилага интравенозно 60 минути преди BBBD и химиотерапия на базата на карбоплатин (интраартериална). В отделно изследвано изследване, NAC се прилага в низходяща аорта 30 минути преди BBBD.
Болести на хемолимфатичната и имунната системи
Лечение
Стандартното първично лечение е IV инжекция на смес от натриев нитрит и натриев тиосулфат (5 g натриев нитрит и 15 g натриев тиосулфат в 200 ml вода за говеда; 1 g натриев нитрит и 3 g натриев тиосулфат в 50 ml вода за овце), и полевият опит с него беше много добър. Преживните животни са лекувани успешно с 30% до 40% разтвор на IV натриев тиосулфат при 25 до 50 g/100 kg BW и без натриев нитрит. 12 Конете могат да получат 10 до 20 mg/kg натриев нитрит IV в 20% разтвор, последвано от 30 до 40 mg/kg BW натриев тиосулфат IV в 20% разтвор. 13
Резултатите при говедата могат да се подобрят, като се използват следните дози:
Натриев тиосулфат в много по-тежка доза (660 mg/kg телесно тегло в 30% разтвор) 13
Тежка доза натриев тиосулфат, комбинирана с натриев нитрит (22 mg/kg телесно тегло)
Тежка доза натриев тиосулфат с р-аминопроприофенон (1 до 1,5 mg/kg телесно тегло)
Тежка доза натриев тиосулфат плюс кобалтов хлорид (10,6 mg/kg телесно тегло)
Във всички случаи и при животни, изложени, но без признаци, дози от 30 g натриев тиосулфат се дават перорално на говеда и се повтарят на всеки час.
Изследващи лечения
Хидроксокобаламинът, естествената форма на витамин В12, се използва успешно в много страни като противоотрова при хора, кучета, мишки, морски свинчета, зайци и бабуини. 14 Неотдавнашната работа по свинете показа, че хидроксокобаламинът (150 mg/kg телесно тегло) е по-ефективен от натриевия тиосулфат (413 mg/kg телесно тегло) или комбинация от хидроксокобаламин и натриев тиосулфат при лечение на експериментално индуцирано отравяне с цианид. 15
Сулфанеген натрий (2,5 грама IV болус; повтаря се на час), пролекарство на 3-меркаптопируват, в експериментален модел на свине е ефикасен при обръщане на признаци на централната нервна система (ЦНС) и може да осигури друг антидот в бъдеще. 16.
Лечението, който и продукт да се използва, може да се наложи да се повтори поради по-нататъшното освобождаване на HCN. Съществува горна граница на безопасна метхемоглобинемия, след която се появява анемична аноксия и дози нитрит, по-големи от препоръчаните, могат да влошат тъканната аноксия. Включването на кобалт се основава на неговия подчертан антагонистичен ефект срещу цианида, който може да бъде засилен чрез комбинация с тиосулфат или нитрит.
Неспецифичното поддържащо лечение, включително дихателни стимуланти и изкуствено дишане, е малко вероятно да окаже влияние върху хода на заболяването.
Лечение и профилактика
Преживни животни (вижте текста за други опции)
Всичко: натриев тиосулфат 660 mg/kg телесно тегло IV в 30% разтвор (R1)
Крави: 5 g натриев нитрит, 15 g натриев тиосулфат IV в 200 ml вода (R2)
Овце: 1 g натриев нитрит, 3 g натриев тиосулфат в 50 ml вода (R2)
Коне
Натриев нитрит (10 до 20 mg/kg BW IV в 20% разтвор), последван от натриев тиосулфат (30 до 40 mg/kg BW IV в 20% разтвор) (R1)
- Rubus Chamaemorus - общ преглед на ScienceDirect теми
- Техника за прочистване и улавяне - общ преглед на темите на ScienceDirect
- Пиелонефрит - общ преглед на ScienceDirect теми
- Хранителна добавка - общ преглед на ScienceDirect теми
- Натриев тиосулфат - общ преглед на ScienceDirect теми