Нашите редактори ще прегледат подаденото от вас и ще определят дали да преразгледат статията.
Натрий (Na), химичен елемент от групата на алкалните метали (група 1 [Ia]) от периодичната таблица. Натрият е много мек сребристо-бял метал. Натрият е най-често срещаният алкален метал и шестият най-разпространен елемент на Земята, съдържащ 2,8% от земната кора. Той се среща обилно в природата в съединения, особено обикновена сол - натриев хлорид (NaCl), който образува минерала халит и представлява около 80% от разтворените съставки на морската вода.
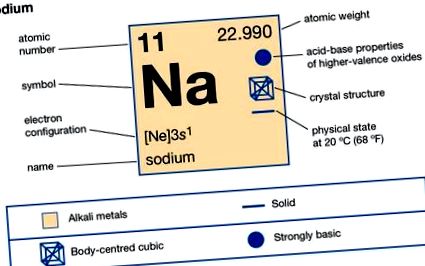
| 11. |
| 22.9898 |
| 97,81 ° C (208 ° F) |
| 882,9 ° C (1,621 ° F) |
| 0,971 (20 ° C) |
| +1, -1 (рядко) |
| 2-8-1 или 1s 2 2s 2 2p 6 3s 1 |
Свойства и производство
Тъй като натрият е изключително реактивен, той никога не се появява в свободно състояние в земната кора. През 1807 г. сър Хъмфри Дейви става първият, който приготвя натрий в елементарната му форма, прилагайки електролиза към разтопен натриев хидроксид (NaOH). Натрият е важен компонент на редица силикатни материали, като полеви шпат и слюди. В различни части на света има огромни находища на каменна сол, а в Чили и Перу има находища на натриев нитрат. Съдържанието на натрий в морето е приблизително 1,05 процента, което съответства на концентрация от приблизително 3 процента натриеви халиди. Натрият е идентифициран както в атомната, така и в йонната форма в спектрите на звездите, включително Слънцето, и междузвездната среда. Анализът на метеоритите показва, че присъстващият силикатен материал има средно съдържание от около 4,6 атома натрий на всеки 100 атома силиций.
По-лек от водата, натрият може да се реже с нож при стайна температура, но е крехък при ниски температури. Провежда топлина и електричество лесно и проявява фотоелектричния ефект (излъчване на електрони при излагане на светлина) в значителна степен.
Натрият е най-важният търговски важен алкален метал. Повечето процеси за производство на натрий включват електролиза на разтопен натриев хлорид. Евтин и достъпен в колички за коли, елементът се използва за производство на бензинови добавки, полимери като найлон и синтетичен каучук, фармацевтични продукти и редица метали като тантал, титан и силиций. Също така се използва широко като топлообменник и в лампи с натриеви пари. Жълтият цвят на натриевата лампа и натриевия пламък (основата на аналитичен тест за натрий) се идентифицира с две изпъкнали линии в жълтата част на светлинния спектър.
Значителни приложения
Две от най-ранните употреби на метален натрий са били при производството на натриев цианид и натриев пероксид. Значителни количества бяха използвани при производството на тетраетил олово като добавка към бензин, пазар, който изчезна с появата на безоловен бензин. Значителни количества натрий се използват при производството на натриеви алкил сулфати като основна съставка в синтетичните детергенти.
Натрият също се използва като изходен материал при производството на натриев хидрид (NaH) и натриев борохидрид (NaBH4). В допълнение, натрият се използва в производството на багрила и междинни продукти за оцветяване, в синтеза на парфюми и в голямо разнообразие от органични редукции. Използва се при пречистването на въглеводороди и при полимеризацията на ненаситени въглеводороди. В много органични приложения натрият се използва под формата на дисперсии във въглеводородна течна среда.
Разтопеният натрий е отличен флуид за пренос на топлина и поради това свойство е намерил приложение като охлаждаща течност в реактори за бързо размножаване на течни метали. Натрият се използва широко в металургията като дезоксидант и като редуциращ агент за получаване на калций, цирконий, титан и други преходни метали. Търговското производство на титан включва редукция на титанов тетрахлорид (TiCl4) с натрий. Продуктите са метални Ti и NaCl.
Основни съединения
Натрият е силно реактивен, образувайки голямо разнообразие от съединения с почти всички неорганични и органични аниони (отрицателно заредени йони). Обикновено има степен на окисление +1 и единичният му валентен електрон се губи с голяма лекота, като се получава безцветният натриев катион (Na +). Съединенията, които съдържат натриевия анион, Na -, също са синтезирани. Основните търговски натриеви съединения са хлоридът, карбонатът и сулфатът.
Най-важното и познато натриево съединение е натриевият хлорид или обикновената сол, NaCl. Повечето други натриеви съединения се получават директно или индиректно от натриев хлорид, който се среща в морската вода, в естествени саламури и като каменна сол. Големи количества натриев хлорид се използват в производството на други тежки (индустриални) химикали, както и се използват директно за отстраняване на лед и сняг, за кондициониране на вода и в храни.
Други основни търговски приложения на натриевия хлорид включват използването му при производството на хлор и натриев хидроксид чрез електролитно разлагане и при производството на натриев карбонат (Na2CO3) чрез процеса на Солвей. При електролизата на воден натриев хлорид се получава натриев хипохлорит, NaOCl, съединение на натрий, кислород и хлор, използвано в големи количества в домакински хлорен белина. Натриевият хипохлорит се използва също като промишлено избелващо средство за хартиена маса и текстил, за хлориране на вода и в някои лекарствени препарати като антисептик и фунгицид. Това е нестабилно съединение, известно само във воден разтвор.
Карбонатите съдържат карбонатния йон (CO3 2–). Натриевият бикарбонат, наричан още натриев хидроген карбонат или соден бикарбонат, NaHCO3, е източник на въглероден диоксид и затова се използва като съставка в бакпулвери, в ефервесцентни соли и напитки и като основна съставка на сухохимичните пожарогасители . Неговата лека алкалност го прави полезен при лечение на стомашна или пикочна хиперацидност и ацидоза. Той се използва и в определени промишлени процеси, като например в дъбенето и приготвянето на вълна. Натриевият карбонат, или натриевата сода, Na2CO3, е широко разпространен в природата, среща се като съставни части на минералните води и като твърди минерали натрон, трона и термонатрит. Големи количества от тази алкална сол се използват за направата на стъкло, препарати и почистващи препарати. Натриевият карбонат се обработва с въглероден диоксид, за да се получи натриев бикарбонат. Монохидратната форма на натриев карбонат, Na2CO3 · H2O, се използва широко във фотографията като съставна част в разработчиците.
Натриевият сулфат, Na2SO4, е бяло кристално твърдо вещество или прах, използвани в производството на крафт хартия, картон, стъкло и детергенти и като суровина за производството на различни химикали. Получава се или от находища на минерали натриев сулфат мирабилит и тенардит, или синтетично чрез обработка на натриев хлорид със сярна киселина. Кристализираният продукт е хидрат, Na2SO4 · 10H2O, известен като глауберова сол. Натриевият тиосулфат (натриев хипосулфит), Na2S2O3, се използва от фотографите за фиксиране на развити негативи и отпечатъци; той действа чрез разтваряне на покритата върху филма част от сребърните соли, които остават непроменени при излагане на светлина.
Натриевият хидроксид (NaOH) е корозивно бяло кристално твърдо вещество, което лесно абсорбира влагата, докато се разтвори. Обикновено наричаната сода каустик или луга, натриевият хидроксид е най-широко използваната индустриална алкала. Той е силно корозивен за животински и растителни тъкани. Алкалните разтвори, които той образува при разтваряне във вода, неутрализират киселините в различни търговски процеси: при рафинирането на петрол той премахва сярните и органичните киселини; при производството на сапун реагира с мастни киселини. Разтворите на NaOH се използват при лечението на целулоза и при производството на много химикали.
Натриевият нитрат или натриевият натрий, NaNO3, обикновено се нарича чилийска селитра, след нейните минерални находища в Северно Чили, основният източник. Натриевият нитрат се използва като азотен тор и като компонент на динамит.
- Meerkat Характеристики, местообитание, диета, поведение и факти Британика
- Масло от шеа - свойства на маслото от ший и хранителни факти
- Супа, кубчета и гранули от бульон, ниско съдържание на натрий, сухи хранителни факти и калории
- Корен от бяла ружа Ползи, рискове и употреба
- Шест храни с високо съдържание на натрий вие; Никога не очаквам - Chatelaine