Катедра по кардиология, болница "Женмин" на университета в Ухан, Ухан, Китай;
Институт за сърдечно-съдови изследвания, Университет Ухан, Ухан, Китай;
Национална лаборатория по медицинска молекулярна биология, Институт по основни медицински науки, Китайска академия на медицинските науки и Медицински колеж на Пекинския съюз, Пекин, Китай;
Катедра по кардиология, болница "Женмин" на университета в Ухан, Ухан, Китай;
Институт за сърдечно-съдови изследвания, Университет Ухан, Ухан, Китай;
Катедра по кардиология, Институт по сърдечно-съдови заболявания, болница Union, Медицински колеж Tongji, Университет за наука и технологии Huazhong, Ухан, Китай;
Катедра по кардиология, болница "Женмин" на университета в Ухан, Ухан, Китай;
Институт за сърдечно-съдови изследвания, Университет Ухан, Ухан, Китай;
Катедра по кардиология, болница "Женмин" на университета в Ухан, Ухан, Китай;
Институт за сърдечно-съдови изследвания, Университет Ухан, Ухан, Китай;
Катедра по кардиология, болница "Женмин" на университета в Ухан, Ухан, Китай;
Институт за сърдечно-съдови изследвания, Университет Ухан, Ухан, Китай;
Катедра по кардиология, болница "Женмин" на университета в Ухан, Ухан, Китай;
Институт за сърдечно-съдови изследвания, Университет Ухан, Ухан, Китай;
Катедра по кардиология, болница "Женмин" на университета в Ухан, Ухан, Китай;
Институт за сърдечно-съдови изследвания, Университет Ухан, Ухан, Китай;
Катедра по кардиология, болница "Женмин" на университета в Ухан, Ухан, Китай;
Институт за сърдечно-съдови изследвания, Университет Ухан, Ухан, Китай;
Медицински изследователски институт в Санфорд-Бърнам, Център за рак, Ла Джола, Калифорния; и
Колеж по науки за живота, Университет Ухан, Ухан, Китайска народна република
Катедра по кардиология, болница "Женмин" на университета в Ухан, Ухан, Китай;
Институт за сърдечно-съдови изследвания, Университет Ухан, Ухан, Китай;
Адрес за заявки за повторно отпечатване и друга кореспонденция: H. Li, отдел по кардиология, болница Renmin на Университет Ухан, Институт за сърдечно-съдови изследвания, Университет Ухан, JieFang Road 238, Вухан 430060, ПР Китай (имейл: [имейл защитен] ).
Резюме
Възпалението, свързано със затлъстяването, е замесено в патогенезата на инсулиновата резистентност и диабет тип 2. В това проучване разгледахме потенциалната роля на регулаторния фактор 7 на интерферон (IRF7), главен регулатор на имунологичните реакции, зависими от тип I, в регулирането на енергийния метаболизъм. Експресионните нива на IRF7 са повишени в бяла мастна тъкан, чернодробна тъкан и гастрокнемиален мускул както на индуцирани от диета затлъстели мишки об/об мишки в сравнение със слабите си колеги. След хранене на диета с високо съдържание на мазнини (HFD) в продължение на 24 седмици, нокаутиращите мишки IRF7 (KO) показват по-малко наддаване на тегло и затлъстяване, отколкото контролите от див тип. KO на IRF7 подобрява глюкозната и липидната хомеостаза и чувствителността към инсулин. Освен това KO на IRF7 подобрява чернодробната стеатоза, индуцирана от диета. След това оценихме възпалителното състояние на мишките IRF7 KO върху HFD. Тези мишки показват по-малко инфилтрация на макрофаги в множество органи и са защитени от локално и системно възпаление. Това проучване демонстрира ролята на IRF7 в индуцираните от диетата промени в енергийния метаболизъм и инсулиновата чувствителност. Нашите резултати също така предполагат, че IRF7 участва в етиологията на метаболитните аномалии, което предполага нова стратегия за лечение на затлъстяване и диабет тип 2.
Интерферонът (IFN) α и IFNβ, общо известни като IFN от тип I, са основните медиатори на имунния отговор на гостоприемника срещу вирусни инфекции (14, 31). IFN регулаторните фактори (IRF) са семейство транскрипционни фактори, което се състои от девет членове (IRF-1 до IRF-9) при бозайници (36). Повечето IRF участват във вродения имунитет и защитата срещу патогени (1, 17). IRF7 за първи път е идентифициран като фактор, който се свързва с промотора EBNA1 Q на вируса Epstein-Barr по време на латентна инфекция (46). След това се установи, че IRF7 е главен регулатор на IFN-зависим имунен отговор от тип I (18). IFN от тип I могат да индуцират експресията на IRF7 в различни клетъчни типове (40). IRF7, разположен главно в цитоплазмата, може да се фосфорилира при вирусна инфекция и зависима от Toll рецепторна сигнализация. След това се транслоцира в ядрото, за да активира транскрипцията на IFN от тип I, създавайки положителна обратна връзка (40). Съобщава се, че IRF7 потиска метастазите на рака на гърдата чрез активиране на механизмите за туморен имунен надзор (2). Членовете на семейството IRF могат да регулират диференциацията и пролиферацията на хемопоетични клетки, което включва тези транскрипционни фактори в развитието и онкогенезата (36).
Няколко последни редици доказателства предполагат участието на IRF в метаболизма. Предишната ни работа установи, че IRF9 взаимодейства с активиран от пероксизома пролифератор рецептор (PPAR) -α, за да смекчи NAFLD (42). Съобщава се, че IRF3 регулира свързаните с метаболизма ядрени рецептори, като чернодробен X рецептор (LXR) и ретиноиден X рецептор α (4, 8). Друга група установява, че IRF регулират адипогенезата и липидния метаболизъм в адипоцитите (10, 11). Системните ефекти на IRF върху метаболизма обаче са до голяма степен неизвестни. В това проучване имахме за цел да идентифицираме метаболитните роли на IRF7 при затлъстяване и да предоставим нова гледна точка за лечението на метаболитно разстройство.
Животни и диети.
C57BL/6 [див тип (WT)] мишки и IRF7 нокаутиращи (KO) мишки (C57BL/6 фон, любезно предоставени от д-р Tadatsugu Taniguchi, Университет в Токио, Япония) бяха настанени в 12: 12-часов светлинен тъмен цикъл със свободен достъп до вода и стандартна диета за гризачи преди началото на проучването. За експерименти са използвани само 8-седмични мъжки мишки. Мишките бяха разделени на случаен принцип в две групи: HFD група, хранена ad libitum с диета с високо съдържание на мазнини (60% ккал мазнини, D12492; Изследователски диети) и NC група с нормална чау диета (10% ккал мазнини, D12450B; Изследвания Диети) за следващите 24 седмици. Деветседмична женска об/об мишки са получени от лабораторията Джаксън (номер на запаса: 000632). об/об мишките се хранят ad libitum със стандартна диета с гризачи за гризачи. Всички протоколи бяха одобрени от Комитета за грижи и употреба на животните към болницата Renmin на университета в Ухан.
Метаболитни изследвания.
Приемът на храна се записва седмично. Телесното тегло и нивата на глюкоза на гладно се измерват на всеки 4 седмици. Всички мишки бяха на гладно в продължение на 6 часа (от 8:00 до 02:00 ч.) Преди серумния глюкозен тест. Кръвни проби са получени от кръвоносните съдове на върха на опашката. Нивото на глюкоза в кръвта се открива с помощта на глюкомер (One Touch Ultra Easy; Life Scan). Нивата на представителни метаболити и инсулин в серума са тествани на всеки 8 седмици. Мишките се анестезират чрез вдишване на диетилов етер и кръвта се събира чрез орбитална пункция. Събраната кръв се центрофугира при 4000 об/мин за 30 минути при 4 ° С и след това се съхранява при -80 ° С за бъдещ анализ. Концентрацията на триглицериди (TG), общ холестерол (TC), липопротеин с висока плътност (HDL) -холестерол (C), липопротеин с ниска плътност (LDL) -C, нестерифицирана мастна киселина (NEFA) и β-хидроксибутират в серумът се определя с търговски комплекти (Wako и Abcam). Серумните цитокини бяха измерени с помощта на комплекти ELISA, закупени от RayBio (Norcross, GA), MBL (Woburn, MA), Invitrogen (Camarillo, CA), Peprotech (Farmingdale, NY) и R&D (Minneapolis, MN), според производителите инструкции. Нивото на серумния инсулин на гладно се измерва с инсулинов комплект ELISA (Millipore, Billerica, MA). Оценката на модела на хомеостаза за инсулинова резистентност (HOMA-IR) е изчислена като [кръвна глюкоза на гладно (mmol/l) × инсулин на гладно (mIU/l)]/22,5. След 23 и 24 седмици от HFD или NC хранене бяха проведени съответно тест за глюкозен толеранс и инсулинов толеранс. Мишките са гладували в продължение на 6 часа преди интраперитонеално инжектиране с глюкоза (1 g/kg телесно тегло; Sigma-Aldrich, Сейнт Луис, Мисури) или инсулин (0,75 U/kg телесно тегло; Novolin R; Novo Nordisk, Bagsvaerd, Дания) . Кръвни проби са получени от кръвоносните съдове на върха на опашката преди инжектирането и 15, 30, 60 и 120 минути след прилагането на глюкоза или инсулин.
Обработка на тъкани.
Мишките бяха анестезирани с 3% пентобарбитал натрий за макроскопско улавяне на изображение и след това бяха убити. Чернодробната тъкан, висцералните мастни тъкани [включително епидидимални бели мастни тъкани (WAT), мезентериална мастна тъкан и периренална мастна тъкан] и гастрокнемиален мускул бяха събрани и претеглени. Тъканите незабавно бяха замразени в течен азот за PCR в реално време и Western blot анализи. За хистологичен анализ тези три вида тъкани бяха или замразени с Tissue-Tek OCT Compound (Sakura; Finetek Japan, Tokyo, Japan) в сух лед или фиксирани с 10% формалин и след това обработени за влагане на парафин. За да се оцени степента на чернодробна стеатоза, вградените чернодробни парафинови участъци (5 μm) и замразени участъци (10 μm) бяха оцветени съответно с хематоксилин и еозин (H&E) и Маслено червено O (Sigma). За да се покаже хипертрофия в адипоцитите, вградените в парафин епидидимни WAT секции (5 μm) бяха оцветени с H&E. Цифровите изображения са заснети на светлинен микроскоп (Олимп, Токио, Япония). Площта на единичен адипоцит беше измерена с помощта на Image-Pro Plus (версия 6.0) и 500 статистически анализа бяха използвани 500 адипоцити. Данните са получени от поне три мишки за всяка група.
Чернодробни липидни измервания.
За всяка проба бяха извлечени 50 mg чернодробна тъкан за измерване на липидите. Нивата на TG, TC и NEFA в чернодробната тъкан се определят с помощта на комплекти (Wako, Osaka, Japan), както е описано по-рано (20).
Имунофлуоресцентно оцветяване.
За имунофлуоресцентно оцветяване бяха използвани замразени чернодробни и гастрокнемиални мускулни тъканни участъци (4 μm) и епидидимални мастни тъкани (5 μm), вградени в парафин. Заешко антимиши IRF7 антитяло (Santa Cruz Biotechnology, Santa Cruz, CA) беше използвано за оценка на експресията на IRF7. Плъх анти-мишка 7/4 антитяло (Abcam, Кеймбридж, Великобритания), плъх анти-мишка CD45 антитяло (BD, Сан Хосе, Калифорния) и плъх анти-мишка CD68 антитяло (AbD, Оксфорд, Великобритания) са използвани за откриване на пан левкоцити, неутрофили и провъзпалителни M1-тип макрофаги. Противовъзпалителни М2 макрофаги бяха открити с анти-миши CD206 антитяло на плъх (AbD) и анти-аргиназа 1 на мишка антитяло (BD). DAPI (Invitrogen) се използва за показване на ядра.
Уестърн петно.
Протеините бяха извлечени от епидидимални мастни тъкани (200 mg за всяка проба), чернодробна тъкан (60 mg за всяка проба) и гастрокнемиална мускулна тъкан (150 mg за всяка проба) с помощта на RIPA лизисен буфер [RIPA (720 μl) съдържа 20 μl фенилметилсулфонил флуорид (P7626; Sigma), 100 μl пълен (04693124001; Roche), 100 μl Phosstop (04906837001; Roche), 50 μl NaF и 10 μl Na3VO4. RIPA (100 ml, рН = 7,5) съдържа 0,7882 g Tris · HCl, 0,8766 g NaCl, 1 ml Nonidet P-40, 0,5 g натриев дезоксихолат, 0,1 g SDS и 0,0292 g EDTA]. Уестърн петна са обработени, както е описано по-рано (9, 23). Нивата на протеина се определят количествено и се нормализират спрямо контрола на зареждане GAPDH. Антителата, използвани в това проучване, са получени от Cell Signaling Technology (Danvers, MA), Santa Cruz Biotechnology, Bioworld Technology (Minneapolis, MN), Millipore и Abcam.
РНК изолация и PCR в реално време.
Общата РНК се извлича от епидидимална мастна тъкан, чернодробна тъкан и гастрокнемиална мускулна тъкан с реагент TRIzol (Roche, Mannheim, Германия). cDNA се синтезира с Transcriptor First Stand cDNA Synthesis Kit (Roche). Количествената PCR в реално време се извършва с Light Cycler 480 SYBR Green I Master (Roche), като се използва PCR системата в реално време Light Cycler 480, съгласно инструкциите на производителя (Roche). Експресионните нива на целевите гени се нормализират до β-актин.
Статистически анализ.
Данните са изразени като средни стойности ± SE. Всички статистически анализи бяха извършени от двустранен студент т-тест или еднопосочен ANOVA, последван от процедурата за най-малко значима разлика на Fisher за post hoc тестване. A P стойност 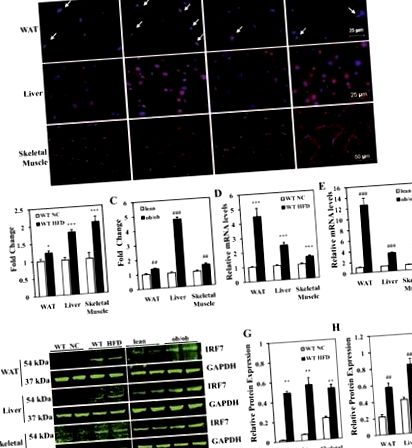
Фиг. 1.Експресия на регулаторен фактор 7 на интерферон (IRF7) в инсулиновите целеви органи. A: представителна имунофлуоресцентна експресия на IRF7 (червено) в инсулиновите целеви органи: бяла мастна тъкан (WAT), чернодробна тъкан, скелетна мускулатура (гастрокнемиален мускул) при мишки C57BL/6 [див тип (WT)] и об/об мишки. WT мишките са били на нормална диета с чау (NC) или диета с високо съдържание на мазнини (HFD) в продължение на 24 седмици. об/об мишките и техните слаби контроли (WT при нормална чау) бяха хранени със стандартна диета с гризачи за 9 седмици. Всяка група съдържа четири секции за анализ на оцветяването. Стрелките показват положителни клетки в WAT. Мащабните стълбове са 25 μm (WAT), 25 μm (черен дроб) и 50 μm (скелетни мускули). Б. и ° С: относително количествено определяне на IRF7-положителни клетки в WAT, чернодробна тъкан и скелетни мускули. Данните са представени като средни стойности ± SE; н = 4 мишки. *P
IRF7 KO мишки показаха намалено наддаване на тегло и затлъстяване на HFD.
Фиг. 2.IRF7 нокаутиращите мишки показват намалено наддаване на тегло и затлъстяване на HFD. A: сравнението на нарастването на телесното тегло при WT или irf7 -/- (KO) мишки при 24-седмично NC или HFD хранене; н = 15–22/група. ###P
КО на IRF7 подобрява глюкозната и липидната хомеостаза и инсулиновата чувствителност.
Таблица 1. Параметрите на серумния метаболизъм варират по време на започване и след 24 седмици диетично лечение както при WT, така и при KO мишки
Данните са изразени като средни стойности ± SE; н, не. на мишки. NC, нормален чау; HFD, диета с високо съдържание на мазнини; WT, див тип; KO, нокаут; HDL, липопротеин с висока плътност; LDL, липопротеин с ниска степен на задържане; FFA, свободна мастна киселина.
## P ** P
Фиг. 4.IRF7 нокаутиращите мишки са защитени от индуцирана от диетата чернодробна стеатоза. A: макроскопски изображения на черен дроб при WT и KO мишки, хранени с HFD. Б.: количествено определяне на теглото на черния дроб и съотношението към телесното тегло; н = 15–31/група. ° С: представителни чернодробни секции, оцветени с H&E (Горна част) или Маслено червено O (отдолу) при WT или KO мишки с 24 седмици NC или HFD хранене. Скалите представляват 100 μm. д: нивата на триглицеридите (TG), холестерола и нестерифицираната мастна киселина (NEFA) бяха извлечени от чернодробната тъкан в WT с KO мишки при HFD; н = 4–5/група. Е.: нивата на иРНК на гени, които участват в синтеза на мастни киселини, усвояването, липогенезата, липолизата и окислителното действие на мастните киселини, синтеза на холестерол и изтичането в чернодробната тъкан; н = 6–12/група. Всички стойности са изразени като средни стойности ± SE. В Б., д, и Е., ##P
IRF7 KO мишките са защитени от индуцирано от диетата възпаление.
Таблица 2. Серумни нива на възпалителни цитокини при WT и KO мишки с 24-седмично диетично лечение
Данните са изразени като средни стойности ± SE; н, не. на мишки. MCP-1, моноцитен хемотактичен протеин-1.
## P ** P
Фиг. 5.Нокаутиращите мишки IRF7 бяха защитени от възпаление, предизвикано от диета. A: нивата на иРНК на макрофаги маркер F4/80 и маркери на провоспалителни M1 тип макрофаги бяха изследвани чрез PCR в реално време; н = 6–12/група. Б.: нивата на тРНК маркерите на противовъзпалителни М2-тип макрофаги са изследвани чрез PCR в реално време; н = 6–12/група. ° С: активирането на NF-кВ сигнализиране е показано чрез имуноблотинг. д: количественото определяне на промените в експресията на протеин е представено като средно ± SE; н = 4/група. В A, Б., и д, *P
В настоящото проучване е показано, че IRF7, главен регулатор на интерферон-зависим имунен отговор от тип I (18), се увеличава в множество тъкани както при диетични, така и при генетично затлъстели мишки. Използвайки IR мишки от цялото тяло KO, установихме, че IRF7 има решаваща роля в развитието на затлъстяване и диабет. На HFD, WT мишките представиха компрометирани енергийни регулаторни функции и значително затлъстял фенотип. Въпреки това, дори хронично предизвикани с HFD, мишките IRF7 KO все още показват почти непокътната хомеостаза на глюкоза и липиди, устойчивост на индуцирана от диетата чернодробна стеатоза, по-малко затлъстяване и относително нормален външен вид. Чернодробният ER стрес и локалното и системно възпаление също са отслабени при IRF7 KO мишки в сравнение с WT мишки. Следователно насочването към IRF7 може да помогне за поддържане на енергийния баланс и предотвратяване на метаболитни заболявания.
Въпреки че преобладаващата им функция е вродените имунни отговори и онкогенезата, в момента се смята, че членовете на семейството IRF също регулират енергийния метаболизъм. Eguchi et al. съобщава, че IRF регулират адипогенезата и допълнително идентифицират антиадипогенните свойства на IRF4 (10, 11). За разлика от IRF4, чиято експресия е силно ограничена до мастната тъкан и имунните клетки, IRF7 е широко разпространен. Потвърдихме отслабването на диета, предизвикано от затлъстяване, инсулинова резистентност, ER стрес и възпаление при мишки с дефицит на IRF7. Въпреки че основният механизъм не е напълно разбран, ние предлагаме, че подобряващите метаболизма ефекти на дефицита на IRF7 могат да бъдат частично медиирани от PPARγ. Нашите резултати разкриват многостранна роля на IRF7 в метаболизма и предлагат нова връзка между имунитета и метаболизма. Бъдещата работа може да се съсредоточи върху регулирането на IRF, както и техните регулаторни функции и взаимодействието между различни членове на семейството на IRF. В обобщение, насочването към IRF7 се надяваме да се превърне в нова стратегия за лечение на затлъстяването и свързаните с него метаболитни нарушения.
Това проучване беше подкрепено от Националната фондация за естествени науки на Китай (№ 81100230 и 81070089), Националният проект за подкрепа на науката и технологиите (№ 2011BAI15B02 и 2012BAI39B05) и Националната програма за основни изследвания на Китай (№ 2011CB503902).
Авторите не съобщават за конфликт на интереси.
Xin-An Wang проектира и изпълнява експериментите, анализира данните и пише ръкописа; Ран Джанг е написал ръкописа; Шумин Джанг, Шан Ден, Дингшен Джианг, Джинфън Чжун, Ли Ян, Тао Уанг, Сен Гуо извършиха експериментите; Shufen Hong анализира данните; Zhi-Gang She, Xiao-Dong Zhang предоставят полезни съвети и помагат за преразглеждането на ръкописа; Хонлианг Ли (автор на кореспонденция) е проектирал експерименти и е написал ръкописа.
ПРИЗНАВАНИЯ
Благодарим на д-р Tadatsugu Taniguchi (Университет в Токио, Япония) за осигуряването на нокаут мишки IRF7 и благодарим на RIKEN BRC за доставката на нокаут мишки IRF7 чрез Националния проект за биоресурси на The MEXT Япония.
- Инхибиране на GABA трансаминазата за облекчаване на индуцирана от затлъстяване хиперинсулинемия и инсулинова резистентност -
- Инсулинова резистентност и глад при детско затлъстяване Пациент и лекарска перспектива
- Чревният микробиом и неговата роля в затлъстяването и инсулиновата резистентност - Лий - 2020 - Анали на Ню Йорк
- Дефицитът на интерлевкин-6 улеснява миокардната дисфункция по време на затлъстяване, предизвикано от диета с високо съдържание на мазнини,
- Инсулинова резистентност при детско затлъстяване - физиологични ефекти и възможно диетично лечение -
