Ерика К. Клод
Университетът в Чикаго, Департаменти по педиатрия и медицина, Секции по неонатология и гастроентерология, 5841 S. Maryland Ave MC6060, Чикаго, IL 60637, САЩ
Резюме
Некротизиращият ентероколит на новороденото е опустошително възпалително заболяване на червата при недоносени деца. Патогенезата остава не напълно разбрана и няма специфично лечение. Продължават усилията за разбиране на аспекти на чревната незрялост, които допринасят за податливостта към това заболяване. Този преглед се фокусира върху моделите на бактериална колонизация, чревната бариерна функция и възпалителните реакции на незрели ентероцити, водещи до уникална уязвимост на недоносените черва. В допълнение се обсъжда възможният терапевтичен потенциал на фактори в кърмата и пробиотичните бактерии.
ВЪВЕДЕНИЕ
НЕКРОТИЗИРАЩ ЕНТЕРОКОЛИТ
NEC е възпалителна некроза на червата, която засяга предимно недоносени деца след започване на ентерално хранене. NEC засяга около 10% от недоносените деца 13 микроорганизми, новороденото черво е стерилно при раждането. Освен това, колонизацията на празната плоча на недоносеното черво се влияе от ятрогенни манипулации в интензивното отделение за новородени (NICU). Това включва болнична среда; често използване на широкоспектърни антибиотици, опиоиди и Н2 блокери; и апаратура с ендотрахеални тръби, захранващи тръби и смукателни тръби. Резултатът от променената микробна флора може да има значителни последици за развитието на незрелите недоносени черва и податливостта към NEC.
Смята се, че бактериите са важни в патогенезата на NEC; обаче не е идентифициран специфичен патоген. Предишни проучвания са ограничени от неспособността на конвенционалните микробиологични техники за култивиране да характеризират изцяло човешката стомашно-чревна микробиота. Съобщава се, че 80% от човешката микробиота на дебелото черво не се откриват чрез конвенционални културни методи [14]. Молекулярното профилиране на микробиоми вече е възможно чрез секвениране на силно запазения 16S малък субединичен бактериален ген на рибозомна РНК (rRNA), позволяващ идентифициране на неоткриваеми преди това микроби [15]. Следователно този подход дава по-пълна картина на състава на чревната микробиота на човека.
Последователността на чревния микробиом на бебета със и без NEC показа, че последователностите от пациенти с NEC се групират отделно от последователностите от контролни пациенти, дори между генетично идентични двойки близнаци [16]. Все още не е идентифициран специфичен патоген, по-скоро структурата на микробната общност при пациентите с НЕК се различава въз основа на значително намаляване на разнообразието на микробните видове с увеличаване на доминирането на протеобактериите в сравнение с други недоносени деца и специфичен цъфтеж на един род на протеобактериите до> 50% от общия бактериален състав [16]. Тези данни показват, че докато бактериите са важни в патогенезата на NEC, NEC не изглежда да е инфекция в класическия смисъл. Конкретният организъм не е причинен, а по-скоро отключващ фактор за бърза възпалителна каскада в недоносените черва, водеща до признаци и симптоми на заболяване. Има две страни на това взаимодействие - микробът и гостоприемникът.
Защита на домакина при недоносеното бебе
Преждевременните черва са по същество фетални черва, очаквайки условия на вътрематочната среда. Това включва липса на бактерии. Недоносените бебета все още може да не са подготвени за бактериално взаимодействие, когато първоначално са били колонизирани и хранени, което потенциално ги излага на по-висок риск за NEC.
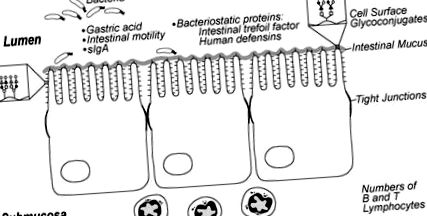
Зрелото черво има много физически бариери за бактериите, включително перисталтиката, стомашната киселина, протеолитичните ензими, чревната слуз, гликоконюгатите на клетъчната повърхност и стегнатите връзки между чревните епителни клетки. Те са предназначени да ограничат бактериите до лумена на червата и да предотвратят прикрепването и транслокацията през чревния епител. Проучванията върху животни показват, че патогенните организми се придържат и пренасят в червата в по-голяма степен при незрели животни и зрели животни Фиг. (1). Ненормалната перисталтична активност при тези кърмачета може да увеличи бактериалната адхезия, позволявайки бактериален свръхрастеж, който може да увеличи експозицията на ендотоксини и да предразположи бебето към NEC [17–19]. Гликоконюгатите на клетъчната повърхност, които служат като адхезионни места за различни микроби, имат различен модел на въглехидратни остатъци в незрелите в сравнение с червата на възрастните, което може да доведе до повишена патогенна колонизация при недоносени бебета [20–22]. Освен това е известно, че чревната слуз, която предпазва от бактериална и токсинна инвазия, е различна при развиващите се животни и може би при недоносените бебета по отношение на въглехидратния състав, плътността и евентуално включването на секреторен имуноглобулин [23].
Аспекти на незрялата защита на чревния гостоприемник при недоносеното бебе, които могат да допринесат за податливостта към некротизиращ ентероколит. Възпроизведено с разрешение [146].
Нарушаване на чревната бариера
Уникална характеристика на стомашно-чревната система е нейната лигавица от един епителен слой при непрекъснат контакт с чревна бактериална флора. Този слой е ключов защитен механизъм на гостоприемника, критичен за задържането на патогенни бактерии в лумена на червата, но също така трябва да позволява преминаването на хранителни вещества. Недоносените бебета имат повишена чревна пропускливост, може би, за да позволят очаквано преминаване на важни макромолекули от околоплодната течност или кърмата [32]. Същата тази повишена пропускливост обаче може да доведе до повишена бактериална транслокация. Възпалителният отговор на незрелите чревни епителни клетки може да бъде предизвикан от коменсални или патогенни бактерии [33]. Нарушаването на чревната епителна бариера увеличава това взаимодействие и се смята за ранно събитие в патогенната каскада на NEC.
Нарушаването на лигавичната бариера може да бъде причинено от нарушаване на стегнатите връзки между епителните клетки. Чревната бариера обикновено се състои от чревни епителни клетки (IEC), свързани чрез система от вътреклетъчни (zonula occludin протеини ZO-1, ZO-2 и ZO-3) и обхващащи мембраната (оклудин, свързваща адхезионна молекула (JAM) и семейство клаудин) протеини [34]. Епителната плътна връзка (TJ) образува селективно пропусклива бариера, която позволява на течностите и разтворените вещества да преминат, като същевременно поддържа защитна бариера срещу друго съдържание на чревния лумен. Оклудин и клаудин-3 са показали специално, че са променени в животински модели на NEC [35].
Друго средство за нарушаване на бариерата е унищожаването на самите клетки. Едно от средствата за клетъчно унищожаване е апоптозата или програмирана клетъчна смърт. Апоптозата е процес на отстраняване на увредените клетки, характеризиращ се с клетъчно свиване, хроматинова кондензация и фрагментация на ДНК [36]. Каспазните протеази са изпълнители на апоптотична клетъчна смърт. Активирането на каспаза регулира ендонуклеазите, което води до разцепване на междунуклеозомната ДНК и клетъчна смърт [37]). Освен това има независими от каспаза пътища, при които протеази, различни от каспази, инициират разцепване на хроматин [38]. Докато апоптозата е нормален аспект на оборота на ентероцитите, ускорената апоптоза може да доведе до нарушаване на критичната чревна лигавична бариера. Изследвания върху животински модели демонстрират, че апоптозата предшества некрозата в NEC и че инхибирането на апоптозата може да намали честотата на заболяването [39].
Апоптозата може да бъде предизвикана както от вътрешни, така и от външни пътища [40]. По вътрешния път клетъчният стрес води до свързване на цитоплазмени проапоптотични протеини като членове на Bcl-2 от семейството BAX и BID към митохондриите. Това води до колапс на митохондриалния потенциал. След това цитохром С се освобождава от митохондриите и се свързва с апоптотичен протеазен активиращ фактор 1, което води до образуването на апоптозома. Излагането на домейн за рекрутиране на каспаза набира каспаза -9, което води до крайно активиране на каспаза 3 и фрагментация на ДНК, водеща до клетъчна смърт. По външния път свързването на Fas лиганд или фактор на туморна некроза (TNF) с неговия рецептор води до набиране на Fas асоцииран домен на смъртния протеин [41]. Последващото набиране на каспаза 8 води до образуване на сигнален комплекс, предизвикващ смърт (DISC). Този комплекс може директно да активира каспаза 3 по независим от митохондриите начин или да действа чрез BID, за да предизвика митохондриално освобождаване на цитохром С. Апоптозата може да бъде резултат и от фрагментация на ДНК, индуцирана от продължителни повишения на калция, които действат чрез активиране на Ca 2 +/Mg 2+ ендонуклеаза или вътреклетъчна ацидоза, които могат да засилят активирането на каспази и активирането на рН чувствителни ендонуклеази [42, 43].
Активиращият тромбоцитите фактор (PAF) е фосфолипиден между- и вътреклетъчен медиатор, който е замесен в патологията на възпалителното заболяване на червата и показва, че индуцира апоптоза на чревни епителни клетки. Въпреки това, механизмът на причиненото от PAF чревно увреждане е напълно разбран. Известно е, че нивата на PAF в тъканите и/или серума са повишени при пациенти с болестта на Crohn, улцерозен колит и NEC и нивата изглежда корелират с тежестта на заболяването [44–47]. При животински модели на NEC, блокирането на PAF рецептора или прилагането на PAF-разграждащия ензим PAF ацетилхидролаза намалява честотата на експерименталните NEC [48]. Освен това, при проучвания при хора на NEC, PAF е доказано, че се повишава няколко дни преди появата на клинични симптоми при някои пациенти, което предполага, че това е критичен и евентуално иницииращ фактор за развитието на заболяването [49]. Доказано е, че нивата на PAF се повишават както от хипоксия, така и от ентерално хранене, някои от специфичните рискови фактори, свързани с NEC [50, 51].
Регулацията започва на рецепторно ниво, където PAF действа чрез свързване със седем трансмембранни домен G протеин, свързан рецептор. Идентифицирани са както PAF рецептори с висок, така и с нисък афинитет [52]. След това множество сигнални каскади са свързани с PAF рецептора. В зависимост от начина на приложение и използвания животински модел, PAF може да предизвика различни ефекти, включително агрегация на тромбоцитите, хипотония, повишена съдова пропускливост, вазоконстрикция, чревна исхемия, набиране на неутрофили и производство на реактивни кислородни видове [53]. В червата се смята, че PAF, веднъж активиран, инициира производството на други възпалителни медиатори като TNFα, простагландини, тромбоксан и комплемент, които след това водят до клиничните признаци и симптоми на възпалително заболяване на червата [54-56]. Няколко реплики обаче показват, че патологичните последици от повишените нива на PAF в червата са не само резултат от инициирането на възпалителна каскада, но че самата PAF има пряко въздействие върху чревните епителни клетки.
В изолирани линии на IEC и животински модел на NEC е показано, че PAF индуцира апоптоза чрез три механизма [39, 57]. PAF индуцира транслокация на BAX в митохондрии, което води до загуба на митохондриален мембранен потенциал и активиране на каспаза, ефект, блокиран от антиапоптотичния протеин Bcl2 [57]. PAF също инхибира фосфатидилинозитол 3-киназата/протеин киназа B Akt сигнален път [58]. И накрая, беше показано, че PAF индуцира вътреклетъчна ацидоза чрез активиране на Ca 2+ зависимия Cl - канал ClC-3, което води до апоптоза на IEC [59].
Изследвания на чревна тъкан на недоносени човешки деца с NEC са забелязали допълнителни маркери, които да дадат улики за механизма на променената бариерна функция. Тези проучвания демонстрират повишено регулиране на индуцируем азотен оксид, което корелира със степента на чревно увреждане и броя на апоптотичните ядра, Локалното чревно производство на азотен оксид (NO), индуцирано от цитокини, води до чревна апоптоза, потенциално влошаваща чревното увреждане [60]. В допълнение са открити повишени нива на протеин на група 1 с висока подвижност (HMGB1), който се освобождава от макрофаги и некротични клетки и е свързан с повишена бариерна дисфункция и бактериална транслокация [61].
Възпаление на червата и NEC
Некрозата, която следва апоптозата, е резултат от прогресирането на задействаната възпалителна каскада. IL-8 е хемокин, който стимулира миграцията на неутрофилите от интраваскуларните към интерстициалните места и може директно да активира неутрофилите и да регулира експресията на молекулите на адхезия на неутрофили [62–64]. По този начин чрез набиране и активиране на имунни клетки, IL-8 може да играе важна роля при възпалението. Предишни проучвания показват, че концентрациите на серумен IL-8 са били значително повишени при тежки случаи на НЕК от началото му през първите 24 часа [65]. Хирургични образци на червата от кърмачета с остър NEC показват повишена регулация на IL-8 mRNA през серозата, мускулатурата и чревния епител в сравнение с тези с други възпалителни състояния или такива без заболяване [66]. Проучванията също така показват повишени серумни нива на провъзпалителните цитокини IL-6 и TNFα при кърмачета с NEC [51, 67, 68].
Недоносените бебета не само имат променена бактериална колонизация и незряла защита на гостоприемника, но и незрял отговор на бактерии. Потенциално е важна стъпка за развитието на ентероцитите за намаляване на възпалителната реакция, за да се предотвратят имунните защитни механизми срещу нормалната флора. Недоносените деца може да не са завършили това съзряване, когато първоначално са били хранени и колонизирани от бактерии. Данните сочат, че недоносеното новородено може да бъде предразположено към чревно възпаление. Проучванията показват, че в сравнение с IEC за възрастни човешкият фетален IEC има преувеличено производство на IL-8 в отговор както на патогенни и коменсални бактерии, така и на ендогенни възпалителни медиатори като TNFα и IL-1γ [69, 70].
Toll-подобни рецептори (TLR) са силно запазено семейство от патоген-асоциирани молекулни модели (PAMP) рецептори, които разпознават бактериалните компоненти. TLR4 специфично разпознава компонента на бактериалната клетъчна стена липополизахарид (LPS). Интересното е, че експресията на TLR4 намалява след раждането в червата на здрави майки, хранени с плъхове, но се увеличава в чревния епител, когато малките са изложени на стрес, общ за недоносените бебета, като хранене с адаптирано мляко и асфиксия [71]. Освен това животински модели на NEC демонстрират, че мутантните мишки TLR4 са защитени от NEC [71].
- Некротизиращ ентероколит Статия
- Некротизиращ ентероколит - NORD (Национална организация за редки заболявания)
- Некротизиращ ентероколит Симптоми, причини, лечение
- Некротизиращ ентероколит IntechOpen
- Некротизиращо намаляване на ентероколита с помощта на ексклузивна диета с човешко мляко и пробиотик