Субекти
Резюме
Въведение
Плексиновите рецептори са семейство от трансмембранни протеини от тип I (A – D), които се свързват със семафорините. 1, 2, 3 плексинови рецептори са идентифицирани въз основа на тяхната хомология с извънклетъчния домен на рецепторите на разсейващия фактор и техните цитоплазмени домени са силно запазени. 1, 4 Въпреки че нямат присъща киназна активност, вътреклетъчният домейн на плексините съдържа вътрешен Ras-GTPase активиращ (GAP) домейн, което води до обмен на GTP за БВП на M-Ras и R-Ras. 5, 6, 7, 8 Неотдавнашен доклад показва, че плексиновите рецептори също имат Rap1-GAP активност, с особено високи нива на Rap1-GAP активност в Plexin C1. 9 Местата на свързване за Rho-гуанин нуклеотидни обменни фактори и Rho-GAPs също са идентифицирани в цитоплазмения домейн на Plexin рецепторите, които медиират плейотропни ефекти върху миграцията на клетките и невритния растеж чрез регулиране на Rho и Rac активността. 10, 11 Семафорините са голямо семейство трансмембранни и секретирани протеини, които са лиганди за плексиновите рецептори и първоначално са идентифицирани в нервната система. 12 В зависимост от семафорина, те свързват и невропилиновите, и плексиновите рецептори, или само плексиновите рецептори, за да медиират техните ефекти.
Резултати
Плексин С1 регулира миграцията при меланома и меланоцитите
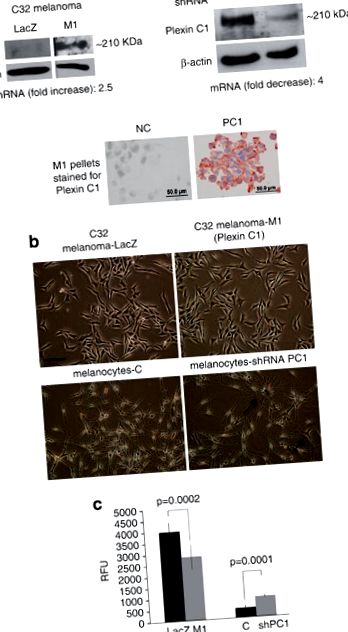
Плексин С1 инхибира насочената миграция на меланома и меланоцитите. (а) Общият клетъчен лизат на LacZ и M1 клетките се разтваря на 7,5% SDS-PAGE и се попива за Plexin C1. Лента с очаквания размер (∼ 210 kDa) беше открита в M1 клетки. Western blot от нормални човешки меланоцити, заглушени за Plexin C1, показват почти пълно заглушаване на Plexin C1 в сравнение с нецелевите контроли. Плексин С1 е идентифициран в мембраната в клетъчни пелети на М1 клетки, оцветени за Плексин С1. ‘NC’ = клетки, оцветени с неимунен серум вместо първично антитяло. (б) Фазова контрастна микрография на меланомни клетки, експресиращи Plexin C1, и меланоцити, в които Plexin C1 е заглушен. Заглушаването на Plexin C1 увеличава дендричността в меланоцитите, но въвеждането на Plexin C1 няма очевиден ефект върху морфологията на меланома. Лента ∼ 100 μm. (° С) Миграцията на меланомни клетки, експресиращи Plexin C1 (M1), е значително по-малка в сравнение с контролите на LacZ. За разлика от тях, меланоцитите, в които Plexin C1 е заглушен, показват значително по-голяма миграция в сравнение с контролните клетки. Резултатите са представителни за четири отделни експеримента. Всяка лента е средната стойност на девет кладенци ± s.d. RFU, относителни флуоресцентни единици.
Плексин С1 регулира активирането на R-Ras в меланоцитите и меланома
Плексин С1 има присъща R-Ras и Rap1 GAP активност. 7, 9 Тъй като R-Ras и Rap1 регулират миграцията на меланома, 27, 28, 29, 30 определихме дали Plexin C1 регулира активирането на R-Ras и Rap1 в меланома. Стационарните нива на R-Ras и Rap1 протеин са сходни при меланоцитите и меланома, с по-високи нива на R-Ras в сравнение с Rap1 (Фигура 2А). Други тествани меланомни клетъчни линии (WW165 и WM115) показват сходни резултати (данните не са показани). Клетките бяха гладувани от серум (меланом) или отгледани в среда без растежни фактори или серум (меланоцити) в продължение на 24 часа преди улавяне на афинитета на GTP-R-Ras. Изненадващо, меланоцитите имат значително по-високи нива на активен R-Ras в сравнение с меланома С32 (Фигура 2В). Дори когато меланомните клетки бяха анализирани при условия на растеж, съдържащи серум, нивата на активен R-Ras бяха по-високи в меланоцитите (данните не са показани). Експресията на Plexin C1 е обратно свързана с активирането на R-Ras в меланоцити и меланом. Заглушаването на Plexin C1 удвои нивата на активен R-Ras в меланоцитите, а експресията на Plexin C1 в меланома понижи активния R-Ras с почти 40%. И при двата клетъчни типа промените в R-Ras-GTP са значителни (P Фигура 2
Тъй като експресията на R-Ras в тъканите in vivo е доста ограничено, значението на Plexin C1-зависимата регулация на R-Ras при меланома е изследвано допълнително чрез анализ на експресията на R-Ras при меланоцитни лезии от проби на пациенти. Имунохистохимичните оцветени тъканни микрочипове на невуси, първичен меланом и метастатичен меланом показват, че експресията на R-Ras е силно ограничена в кожата, липсва в епидермиса, придатъците, гладката мускулатура, лимфоцитите и ендотелните клетки и се открива само в резидентни кожни макрофаги. Всъщност експресията на R-Ras по същество е ограничена до меланоцитните клетки в лезиите (Фигура 2С). R-Ras се експресира предимно при първичен меланом, при който 40/77 (52%) от тумори експресират R-Ras. R-Ras е идентифициран върху плазмената мембрана на меланом, с особено силна експресия в на място (интра-епидермално) отделение. Когато резултатите от интензивността (IS) на експресията на R-Ras при първичен меланом бяха разбити по патологичен стадий, 73% от pT1 меланомите експресираха R-Ras със средно IS 0,69 (± 0,44), в сравнение с меланомите pT2 и по-високи, при които само 11/38 (29%) изразява R-Ras, със средна оценка на интензитета от 0,28 ± 0,04 (P Фигура 3
Плексин С1 регулира отрицателно пролиферацията на меланома и меланоцитите. (а) Пролиферацията на меланомни клетки, експресиращи плексин С1 (М1), е намалена с почти 50% в сравнение с контролите на LacZ. За разлика от тях, меланоцитите (‘MC’), при които Plexin C1 е заглушен, показват значително повишена пролиферация. Десният панел показва представителни изображения от проучвания на Click-IT. Резултатите са представителни за три отделни експеримента. Лентите представляват средния процент на Edu-положителни клетки ± sd. (б) Клетките се поставят в базална среда за 24 часа, след това се лизират и общият клетъчен протеин се разделя на 10% SDS-PAGE и се попива за фосфорилиран Erk1/Erk2. Не бяха открити разлики в нивата на активен Erk1/Erk2. Експресията на β-галактозидаза, свързана със стареенето (рН 6.0), е количествено определена в клетки LacZ и M1. Показани са представителни изображения на ярко поле на клетки, оцветени за β-галактозидаза. Не са открити значителни разлики в процента на β-галактозидаза-положителни клетки (P= 0,12). Резултатите са представителни за два експеримента. Стрелките показват β-галактозидазни положителни клетки; Лента ∼ 30 μ M .
Плексин С1 забавя образуването на тумор при мишки
Нашите проучвания показват, че експресията на Plexin C1 в човешка меланомна клетъчна линия инхибира две ключови стъпки от прогресията на меланома, миграцията и пролиферацията, но ги прави по-устойчиви на апоптоза чрез активиране на Akt, зависима от PI3-киназа. За да се определи дали Plexin C1 потиска прогресията на тумора in vivo, измерихме образуването на тумор в NOD.Cg-Prkdc scid Il2rg tm1Wjl/SzJ мишки. Клетките се инжектират двустранно във фланговете на мишки (н= 5) и развитието на осезаеми тумори и обем на тумора са документирани ежеседмично. Плексин С1 значително забавя развитието на тумори на седмици 2 и 3 в сравнение с тумори от LacZ-експресиращи контролни клетки (P Фигура 5
Плексин С1 забавя растежа на тумора при мишки. (а) Показани са брой тумори и обеми на тумора (mm 2) за седмици 1–5 след инжектиране. Броят на туморите беше значително по-малък на 2 и 3 седмица при мишки, инжектирани с M1 клетки; обемите на тумора са значително по-малки на седмици 2–4. Резултатите са представени като среден брой/обем на тумора ± sd. (б) Снимки на мишки, носещи тумори от контроли LacZ и клетки, експресиращи плексин C1 (M1). Стрелките показват подкожните тумори, присъстващи във фланговете по време на жертвоприношението. Пръчка ∼ 5 мм. Показани са оцветени с хематоксилин и еозин (H&E) участъци от тумори. Стрелките показват области на некроза/апоптоза, която е по-обширна при тумори от контролни мишки. Имуноцитохимичните (ICC) оцветявания за Plexin C1 показват задържане на експресията на Plexin C1 в тумори от клетки M1 (долния десен панел) и липса на експресия на Plexin C1 в тумори от контролите LacZ. Лента ∼ 100 μ M. (° С) TUNEL оцветяването на тумори показва повече TUNEL-положителни ядра в LacZ тумори в сравнение с тумори от M1 клетки. Показани са представителни изображения от флуоресцентни микрографии. Секциите бяха оцветени с DAPI, за да се подчертаят ядрата. Лента = 1 мм.
Дискусия
Ние се интересуваме от Plexin C1, тъй като той се експресира при високи нива в нормалните човешки меланоцити инвитро и in vivo, регулира адхезията на меланоцитите и се губи при меланома при субектите in vivo. Експресията на Plexin C1 се регулира надолу чрез ниски дози ултравиолетово-B облъчване (лични наблюдения), което предполага, че UV-зависимото регулиране на Plexin C1 може да стимулира меланома иницииране или прогресия. Целта на тази работа беше да се провери хипотезата, че Plexin C1 потиска прогресията на меланома. В този доклад ние показваме, че Plexin C1 забавя прогресията на тумора при миши ксенотрансплантати и през инвитро проучвания са идентифицирали ролята на Plexin C1 в регулирането на разпространението и миграцията на меланом. Може би тъй като Plexin C1 е голям рецептор, ние получихме само умерена експресия в клетки C32 и въпреки няколко опита не успяхме да постигнем експресия в други меланомни клетъчни линии. Въпреки това, рецепторът е локализиран правилно в плазмената мембрана на трансдуктанти и експресията се запазва при тумори на ксенографт. Анализът на ефектите от заглушаването на Plexin C1 в меланоцитите се извършва като допълнителни проучвания за свръхекспресия на рецептора в меланома.
Донякъде изненадващо, нормалните меланоцити имат по-високи базални нива на R-Ras активност в сравнение с меланома. Подобни наблюдения бяха направени, когато меланоцитите бяха сравнени с клетъчната линия на меланома WW165 (непубликувани наблюдения). Меланоцитите се култивират в среда, богата на растежен фактор, чиито ефекти могат да продължат дори 24 часа след отстраняването, което може да доведе до високи нива на R-Ras, свързани с GTP. Функцията на R-Ras в меланоцитите остава да бъде проучена. R-Ras, макар и да се експресира от меланоцитите в културата, не е открит в меланоцитите в кожата in vivo, но е открит в трансформирани меланоцитни клетки на първичен меланом. Следователно, експресия на R-Ras може да възникне в отговор на пътищата за реакция на стрес, инициирани от ултравиолетово облъчване или вторични на онкогенната трансформация. Меланоцитите са силно дендритни клетки и активността на R-Ras е критично важна за израстването на аксони и образуването на неврити. 36, 37 Спекулираме, че в меланоцитите R-Ras контролира дендричността или чрез регулиране на Rac и Rho, или чрез модулация на афинитета на β1-integirn, ключови регулаторни молекули в образуването и поддържането на дендрита на меланоцитите. 38, 39, 40 Плексин С1 следователно може да контролира меланоцитната дендричност отчасти чрез регулиране на R-Ras активността.
Модел на плексин С1 в ранните етапи на прогресия на меланома. (а) Предложен модел на сигнализация на Plexin C1 при меланом. Плексин С1 потиска R-Ras активността, което се очаква да намали адхезията и миграцията на меланома. Разпространението също се намалява чрез сигнални пътища, които са независими от Erk1/Erk2. Активирането на PI3-киназния път обаче отменя туморно-супресивните ефекти на Plexin C1, насърчавайки оцеляването на клетките. (б) R-Ras и Plexin C1 показват координирано увеличение (R-Ras) и намаляване (Plexin C1) в експресията при невуси и първичен меланом in vivo. Тъй като Plexin C1 потиска R-Ras активността в меланома и меланоцитите, крайният ефект се очаква да бъде повишен R-Ras-зависими фенотипове надолу по веригата, включително засилена адхезия и миграция.
Материали и методи
Реактиви
Клетки и клетъчна култура
Препуциумите за новородени са получени съгласно указанията на Съвета за преглед на изследванията на университета в Рочестър и са източник на култивирани човешки меланоцити. Човешки меланоцити са култивирани в Opti-MEM (Gibco-BRL, Grand Island, NY, USA), съдържащи: 5% FBS (фетален говежди серум; Atlanta Biologicals; Lawrenceville, GA, USA), 10 -4 М изо-бутил-метилксантин ( IBMX), Anti-Anti (Gibco-BRL), 2.5 n M холерен токсин, 0.1 m M dbcAMP, 25 ng/ml естер на форбол. C32 първични човешки меланомни клетки са получени от ATCC (Manassas, VA, USA) и са култивирани в EMEM (BioWhittaker, Walkersville, MD, USA) и L-глутамин (Lonza, Walkersville, MD, USA) с 10% FBS, анти- Анти и 1 тМ натриев пируват (Invitrogen, Карлсбад, Калифорния, САЩ). Клетките C32 съдържат мутацията V600E в гена BRAF. 31
Установяване на меланомни клетки, експресиращи плексин С1
Отворената рамка за четене на човешки Plexin C1 в Myc-DDK (RC211396; Origene Technologies, Rockville, MD, USA) беше субклонирана в бисцистронния лентивирусен вектор pLVX-IRES-NEO (Clontech, Grand Island, NY, USA). Некомпетентен VSV-G-псевдотипен лентивирус с репликация с висок титър е направен с помощта на Lenti-X HT Packaging System в 293 FT клетки (Clontech). За количествено определяне на вируса се използва свързан с Lentivirus p24 ELISA комплект (Cell Biolabs, Сан Диего, Калифорния, САЩ). Клетките се трансдуцират с лентивирус при множественост на инфекцията от 2,5. Контролите се състоят от клетки, трансдуцирани с празен вектор. Три дни след трансдукцията се извършва селекция с неомицин (Sigma Co.).
Заглушаване на плексин С1
Човешки меланоцити се поставят в 105 клетки в шест ямкова плака. Клетките бяха заразени при 2.5 множественост на инфекцията с частици MISSION Lentivirus (Sigma Co.), експресиращи shRNA в pLKO.1-CMV-neo, насочени към човешки плексин C1 (Clone TRCN0000060645). Като контроли бяха използвани клетки, заразени с нецелева shRNA (shRNA-NT) в Lentivirus. Заглушени клетки бяха избрани с неомицин.
Уестърн блотинг
Клетките се лизират в RIPA буфер (150 m M NaCl, 1% NP-40, 0,5% DOC, 0,1% натриев додецил сулфат (SDS), 50 m M Tris-HCl) с протеазни инхибитори (Boehringer Mannheim, Gmbt, Германия) и белтъкът се определя количествено, използвайки говежди серумен белтък като стандарт (Bio-Rad Laboratories, Hercules, CA, USA). Протеинът се отделя върху SDS-PAGE (полиакриламиден гел електрофореза) гелове и се попива, използвайки стандартни процедури. Визуализацията на имунореактивните протеини се извършва с усилена реакция на хемилуминесценция (Pierce Chemical, Rockford, IL, USA).
Изграждане и анализ на тъканни микрочипове
Проектът получи освобождаване от Съвета за преглед на институциите от Съвета за преглед на човешките субекти в Университета в Рочестър: Категория 4 (45 CRF 46.101): вторично използване на вече съществуващи данни. Двадесет и шест случая на доброкачествени невуси, 77 случая на меланом първичен за кожата и 37 случая на метастатичен меланом са избрани от фиксиран с формалин, вграден в парафин архивен материал от Патологичния отдел за силни мемориали. От всеки слайд бяха избрани три представителни области и от всеки блок бяха взети проби от 1 mm, съответстващи на тези области. Всички невуси бяха дермални невуси; първичните меланоми са патологично състояние pT1 (н= 36), pT2 (н= 20), pT3 (н= 8) и pT4 (н= 13). Метастатичните меланоми са от лимфни възли (20/37), кожа (9/37) и твърди органи, включително бели дробове, черен дроб, кости и черва (8/37). Всяко оцветено ядро се изследва под светлинен микроскоп от един от авторите (GS). Оцветяването беше количествено определено като отсъстващо (0) или присъстващо (1+) и бяха осреднени резултатите от трите ядра, за да се определи интензитетен резултат (IS). Ядра с 43 Минимум 200 клетки бяха оценени за експресия на β-галатозидаза чрез микроскопия с ярко поле и беше определен процент експресиращи β-галатозидаза клетки.
Click-IT анализи
Оцветяването беше извършено върху клетки, култивирани върху покрити с покритие PureCol покрития чрез Click-IT анализ (Invitrogen). Click-IT-положителни ядра бяха идентифицирани с помощта на филтър с дължина на вълната на възбуждане 495 nm. Положителните ядра бяха преброени в минимум 200 клетки, а процентите положителни ядра, определени чрез разделяне на общи ядра, идентифицирани чрез DAPI контраоцветяване, се гледаха с филтър с дължина на вълната на възбуждане 341 nm.
Анализи за миграция
Като цяло, 96-ямкови флуорометрични анализи за миграция са закупени от Millipore (Billerica, MA, САЩ). Като цяло, 10 4 клетки се поставят в горната ямка на 96-ямкова камера и се оставят да мигрират през 8-μm мембрана към среда с 10% FBS. Тестовете за миграция се провеждат в три повторни ямки.
TUNEL оцветяване на туморни участъци
Поглъщането на TUNEL върху фиксирани с формалин парафинови туморни участъци беше открито с помощта на флуометричната система TUNEL DeadEnd (Promega, Madison, WI, USA). TUNEL-положителните ядра се визуализират с помощта на филтър с дължина на вълната на възбуждане 495 nm. Секциите бяха оцветени с DAPI, гледани с филтър с дължина на вълната на възбуждане 341 n M .
Проучвания на миши ксенографт
NSG мишки (NOD.Cg-Prkdc scid Il2rg tm1Wjl/SzJ) са закупени от лабораторията Jackson (Bar Harbor, ME, САЩ). Мишките бяха настанени в съоръжението за животни в Медицинския център на Университета в Рочестър, в съответствие с насоките за грижа за животните от Отдела по лабораторна медицина на животните към Медицинския център на Университета в Рочестър. Общо 2 × 106 меланомни клетки се инжектират подкожно в двата фланга на всяка мишка (н= 5). Развитието на туморите се наблюдава ежеседмично чрез палпация и дължината и ширината на тумора (в mm) се измерват с дебеломери. Обемът на тумора се изчислява като 4π (дължина × ширина). Мишките бяха убити 5 седмици след инжектирането и туморите бяха събрани, измерени и претеглени.
Обратна транскрипция полимеразна верижна реакция и сравнителна PCR в реално време
Общата РНК беше изолирана с помощта на RNeasy Mini Kit (QIAgen, Валенсия, Калифорния, САЩ). Праймери за амплификация на Plexin C1 бяха: fwd: 5′- IndexTerm AACCATTGCACTGCAACC-3 ′; rvs: 5′- IndexTerm GATTCCATCTTCAAGAATCACG-3 ′. Условията бяха: 95 ° С, 3 минути (1 цикъл); 95 ° C 15 s, 54,5 ° C, 30 s, 72 ° C, 40 s (40 цикъла). Праймери, използвани за амплифициране на β-актин, бяха: fwd: 5′- IndexTerm CACGCACGATTTCCCGCTCGG-3 ′; rvs: 5′- IndexTerm CAGGCTGTGCTATCCTGTAC-3 ′. Условията бяха 95 ° С, 3 минути (1 цикъл); 95 ° C 15 s, 54,5 ° C, 30 s, 72 ° C, 40 s (40 цикъла). Номерът на PCR цикъла се нормализира до β-актин, за да се получи коригиран относителен брой на цикъла за всяка проба.
Пречистване на Fc-маркиран Sema7A
Fc-маркиран Sema7A е изолиран от супернатанта на култура на трансфектанти на 293FT клетки (Invitrogen), както е описано по-рано. 16 Активността на рекомбинантния протеин е анализирана чрез активиране на Erk1/Erk2 в нормални меланоцити (допълнителна фигура 3).
Статистически анализ
Различията между средствата бяха анализирани от двустранни Student's т-тест. A P-стойност
- Напредък на тренировката Кога; Как да напредваме в тренировките с тежести
- Прогресия на загуба на тегло - От 90KG - Продължава
- Инструменти за диета на зона, Съдържание; Ресурси Насоки за отслабване
- TNT забавя заснемането на „Последен кораб“ поради депресията на звездата Ерик Дейн - краен срок
- Туморният некротичен фактор α е определящ фактор за патогенезата и прогресирането на заболяването при микобактериите