Джаред Чиарчиаро
отдел по белодробна, алергична и критична медицина, Дороти П. и Ричард П. Симънс Център за интерстициална белодробна болест, Университет в Питсбърг, Медицинско училище, Питсбърг, Пенсилвания, САЩ
b Катедра по медицина, Дороти П. и Ричард П. Симънс Център за интерстициална белодробна болест, Университет в Питсбърг, Медицинско училище, Питсбърг, Пенсилвания, САЩ
Бил Б. Чен
отдел по белодробна, алергична и критична медицина, Дороти П. и Ричард П. Симънс Център за интерстициална белодробна болест, Университет в Питсбърг, Медицинско училище, Питсбърг, Пенсилвания, САЩ
Кевин Ф. Гибсън
отдел по белодробна, алергична и критична медицина, Дороти П. и Ричард П. Симънс Център за интерстициална белодробна болест, Университет в Питсбърг, Медицинско училище, Питсбърг, Пенсилвания, САЩ
b Катедра по медицина, Дороти П. и Ричард П. Симънс Център за интерстициална белодробна болест, Университет в Питсбърг, Медицинско училище, Питсбърг, Пенсилвания, САЩ
Резюме
Цел на прегледа
Саркоидозата е хронично грануломатозно заболяване, което обикновено засяга белите дробове, лимфните възли и други органи. Данните сочат, че заболеваемостта и смъртността от саркоидоза в САЩ нарастват, въпреки широкото използване на противовъзпалителни терапии. В този преглед ние изследваме нови терапии, насочени към специфични възпалителни пътища при други заболявания (като ревматоиден артрит, болест на Crohn и псориазис), които са подобни на пътища, свързани с имунопатогенезата на саркоидоза, и следователно представляват потенциално нови терапии за саркоидоза.
Последни открития
Имунопатогенезата на саркоидозата е добре изяснена през последните няколко години. Има изобилие от доказателства за активиране на Т-клетки при саркоидоза, водещо до активиране както на Th1, така и на Th17 възпалителни каскади. Терапиите, насочени към активиране на Т-клетки, Th1 пътища (като инхибиторите на интерлевкин-6), Th17 медиатори на пътища и други са одобрени или разследвани от Администрацията по храните и лекарствата за лечение на различни автоимунни възпалителни заболявания, но не са проучени в саркоидоза. Насочването към активираните с митоген р38 протеинкинази и убиквитиновата протеазомна система с нови агенти може също да представлява нова терапевтична възможност за пациенти със саркоидоза.
Обобщение
Нарастващите заболеваемост и смъртност при пациенти със саркоидоза категорично подкрепят необходимостта от разработване на по-ефективни противовъзпалителни терапии за лечение на хронични заболявания.
ВЪВЕДЕНИЕ
Саркоидозата е хронично, мултисистемно грануломатозно разстройство, което обикновено обхваща белите дробове и лимфните възли [1], но може да обхване и всички други органи. Смята се, че болестта засяга 10 на 10 000 бели американци и 35 на 10 000 афро-американци [2]. И все пак до 80% от пациентите ще се нуждаят от лечение [2], а почти половината от тези, които се нуждаят от системна терапия, пак ще се нуждаят от терапия 5 години след поставянето на диагнозата [3]. От 1951 г. кортикостероидите са първата терапевтична линия за пациенти със симптоматично и прогресивно заболяване, но употребата му, макар и ефективна в краткосрочен план, е ограничена като дългосрочна терапия от дозозависими странични ефекти и липса на доказателства, че благоприятно променя естествената история на прогресиращо заболяване [4▪, 5-7].
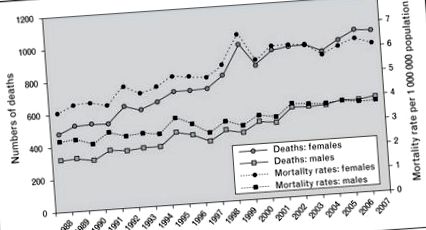
Последните данни показват, че въпреки широкото използване на кортикостероиди и други имуносупресори, смъртността при саркоидоза непрекъснато се увеличава [8]. Между 1998 г. и 2007 г. смъртността, свързана с саркоидоза, се е увеличила. Те са се увеличили с повече от 50% при жените и 30% при мъжете, със средно годишно увеличение от 3% от 1988 до 2007 г. [8]. Интересното е, че въпреки че най-голямото относително увеличение на смъртността, коригирана с възрастта, се наблюдава при неиспанските бели в сравнение с неиспанските гърбове, най-голямото абсолютно увеличение се наблюдава сред неиспанските чернокожи жени. Най-честата причина за смъртта, цитирана в това проучване, е самият болестен процес, като се посочва необходимостта от по-ефективни терапии за прогресиращо заболяване [8] (фиг. 1).
Паркогенезата на саркоидозата започва, когато все още неидентифициран антиген се обработва от антиген-представящи клетки и се представя на Т-лимфоцитите в контекста на основните повърхностни молекули от клас II на хистосъвместимост (MHC). Взаимодействието води до активиране на възпалителен отговор с определено отклонение Th1, набиране на възпалителни клетки и образуване на неказеиращи грануломи. Съвсем наскоро има убедителни доказателства за ролята на Th17 имунните пътища в генерирането и поддържането на саркоидозни грануломи. Преобладаващата хипотеза е, че персистенцията на антигена води до увеличаване и персистиране на възпалителната каскада (с повишаване на фактора на туморна некроза), докато антигенният клирънс е последван от прекратяване на възпалителната каскада и ремисия на заболяването [9].
Доказано е, че кортикостероидите предлагат краткосрочни ползи (при симптоми, белодробна функция и рентгенографски), но ранните проучвания показват, че не предлагат дългосрочни ползи (рентгенологично или чрез изследване на белодробната функция) в сравнение с плацебо [11]. Използването на съхраняващи кортикостероиди средства (като антиметаболити) подобри възможностите за лечение, достъпни за пациентите, но не всички се възползват от тази терапия и някои изпитват неблагоприятни ефекти, изискващи прекратяване на терапията [12]. С появата на много други биологични препарати, насочени към специфични молекули във възпалителната каскада, има обременяваща необходимост от изследването им като потенциални терапии за пациенти със саркоидоза. Необходимо е също така да се разработят нови терапевтични подходи с цел модифициране на естествената история на активно прогресиращо и рецидивиращо-ремитиращо заболяване, т.е. необходимост от модифициращи заболяването антисаркоидозни лекарствени терапии.
ИМУНОПАТОГЕНЕЗА НА САРКОИДОЗАТА
Образуване на гранулом - хипотеза Th1/Th17. Иницииране: алвеоларните макрофаги и дендритните клетки се активират от предполагаем антиген. Дендритните клетки мигрират към лимфните възли и инициират амплификация на Th1/Th17-клетки. Хемокините, произведени от алвеоларни макрофаги, привличат Th1/17, Treg, В-клетки, както и CD8 + клетки и фибробласти и инициират образуването на гранулом (ефекторна фаза). И дендритните клетки, и макрофагите произвеждат цитокини, благоприятстващи Th1 и Th17 клетки при саркоидоза [54].
АНТИМЕТАБОЛИТИ: МЕТОТРЕКСАТ, АЗАТИОПРИН, ЛЕФЛУНОМИД И МИКОФЕНОЛАТ
маса 1
| Метотрексат | Двойно слепи плацебо контролирани проучвания, проспективни серии от случаи и доклади от случаи | Гадене, язви в устата, левкопения, хепатотоксичност, гадене и инфекции | Пневмонит и тератогенен |
| Азатиоприн | Бъдещи серии от случаи и доклади | Левкопения, гадене и инфекции | Тежка левкопения, хепатотоксични ефекти, панкреатит и рак на кожата |
| Лефлуномид | Двойно слепи плацебо контролирани проучвания, проспективни серии от случаи и доклади за случаи | Левкопения, хепатотоксични ефекти, инфекции и алопеция | Пневмонит, тератогенен, периферна невропатия и хипертония |
| Микофенолат мофетил | Серия калъфи | Гадене, диария и инфекции | Рак на кожата |
TNFα ИНХИБИТОРИ: ИНФЛИКСИМАБ, АДАЛИМУМАБ И НЕЦЕНТРИРАНИ ФАКТОРИ НА ФАКТОРА НА ТУМОРНИЯ НЕКРОЗ
За пациенти със системно заболяване, рефрактерно на глюкокортикоиди или антиметаболити, насоченото инхибиране на TNFα е следващата препоръчителна стъпка в лечението [9,13]. Най-добрите данни са за инфликсимаб, който показва смесени резултати в две рандомизирани клинични проучвания [22,23]. Данните за ефикасността на адалимумаб са ограничени до едно, малко отворено проучване [24]. Може да бъде ефективна алтернатива за пациенти с непоносимост към инфликсимаб, показващи подобни резултати за безопасност и ефикасност [24,25], но данните са ограничени. Талидомид, пентоксифилин и апремиласт са три лекарства с нецелеви TNFα инхибиторни ефекти и се считат за трета линия поради разочароващи данни за ефикасността и страничните ефекти [26-28].
БЛОКАДА, СВЪРЗАНА С ЦИТОТОКСИЧЕН Т-ЛИМФОЦИТ
Активирането на Т-клетки изисква костимулация чрез връзка между CD80/CD86 комплекса на макрофага и CTLA протеиновия рецептор на Т клетката. Блокирането на тази връзка води до понижаване на регулирането на отговора на Т-клетките. Abetacept е слет протеин, съставен от Fc региона на IgG1, слят с извънклетъчния домен на CTLA-4, който се свързва с молекулата CD80 и CD86. Това предотвратява костимулация и води до регулиране на Т-клетките надолу. Понастоящем Abetacept е одобрен за пациенти с ревматоиден артрит, които са имали неадекватен отговор на анти-TNFα терапия. Проведени са няколко плацебо-контролирани проучвания върху абетацепт при болестта на Crohn и улцерозен колит [29]. Това лекарство може да бъде потенциално полезен имуносупресор при пациенти със саркоидоза.
ВДИШЕН ВАЗОАКТИВЕН ЧРЕВЕН ПЕПТИД
Вазоактивният чревен пептид (VIP) е невропептид, който има плейотропни ефекти върху контрактилитета на гладката мускулатура и вазодилатация, както и противовъзпалителни ефекти. Доказано е, че инхалираният VIP има имунорегулаторни ефекти при саркоидоза, включително увеличаване на регулаторните Т клетки, което води до потискане на индукцията и пролиферацията на ефекторни Т клетки и понижаване на HLA-DR, CD86 и CD8 + в проби от бронхоалвеоларен лаваж (BAL) при пациенти със саркоидоза [30]. VIP терапията се изследва при редица възпалителни заболявания, включително саркоидоза.
СЪЩЕСТВУВАЩИ Th1-НАСОЧЕНИ ТЕРАПИИ
Съществуват терапии, насочени към овладяване на Th1-медиирано възпаление чрез инхибиране на фактора на туморна некроза, които са тествани при саркоидоза. Инфликсимаб е обсъден по-горе. Адалимумаб е показал терапевтична ефикасност в малки кохортни проучвания [31]. Голимумаб и етанерцепт са подобни агенти, за които е доказано, че са неефективни при саркоидоза [32,33].
IL-6 е важен проинфламаторен цитокин, секретиран от Т клетки и макрофаги, който стимулира имунен отговор, водещ до образуване на гранулом. Takizawa и сътр. [34] демонстрира рано, че нивата на IL-6 са повишени в BAL течността на пациенти със саркоидоза и корелират силно с нивата на BALF CD3 + лимфоцити. Лечението с кортикостероиди доведе до значително намаляване на нивата на IL-6 клетки в тази популация. Първите биологични препарати срещу IL-6, одобрени от Администрацията по храните и лекарствата (FDA) за лечение на ревматоиден артрит, са тоцилизумаб (ACTEMRA; Genentech, Сан Франциско, Калифорния, САЩ), анти-IL-6 рецепторен блокер и силтуксимаб, антитяло, насочено срещу самия IL-6. Олокизумаб е човешко mAb, насочено към IL-6, което показва обещаващи резултати в рандомизирано проучване фаза II за пациенти с умерен до тежък ревматоиден артрит [35]. Съществуват редица терапии, насочени срещу IL-6 в ранното развитие на автоимунни заболявания. Въпреки това, терапиите, насочени срещу IL-6 или IL-6 рецептора, не са проучени при пациенти със саркоидоза.
IL-12/IL-23P40 И Th17 ПЪТИЩА
IL-12/IL-23 е хетеродимерен цитокин, съставен от второстепенната субединица IL-12p40 и основната субединица IL-23p19. IL-12 е Th1 цитокин, произведен от макрофаги, наред с други клетки, в отговор на антигенна стимулация и участва в диференциацията на наивни Т клетки в Th1 клетки. Той също така стимулира производството на TNFα. Малката субединица p40 на IL-12 (IL-12p40) е повишена в BAL проби от пациенти със саркоидоза в сравнение с идиопатични пациенти с белодробна фиброза и контролни групи [36]. Профилите на генна експресия, сравняващи лезиологични кожни биопсии на саркоидоза с нелезионални биопсии и нормални контроли, идентифицират редица дисрегулационни гени, включително IL-12p40 и IL23 рецептор, което предполага роля на Th1 и Th17 пътищата при саркоидоза. По същия начин, Ten Berge et al. [37] и Facco et al. [38] и двамата показват повишени нива на IL-17a + клетки в BAL течността на пациенти с саркоидоза в сравнение с периферна кръв и здрави доброволци и откриват IL-17a + Т клетки в тъканните грануломи, което показва ролята на Th17 пътищата в индукцията и поддържане на саркоидозни грануломи.
P38 АКТИВИРАНИ МИТОГЕН ПРОТЕИНОВИ КИНАЗИ, NLRP3 ВЪЗПАЛИТЕЛНА СИСТЕМА И УБИКВИТИНОВА ПРОТЕАЗОМНА СИСТЕМА
Съществува силна връзка между p38 групата на MAP киназите и производството на TNFα [13]. Засиленото активиране на p38 води до прекомерно производство на възпалителни цитокини Th1 и Th17. Когато BAL клетките на пациентите със саркоидоза се стимулират от продължително фосфорилиране на p38, е доказано, че те реагират с по-силна продукция на TNFα и IL-12/IL-23p40 [13]. Насочването към p38 MAP кинази има привлекателен терапевтичен потенциал, тъй като играе важна роля както за поддържане на стабилността на mRNA на туморния некротизиращ фактор, така и за активирането надолу по веригата на различни цитокини, които са резултат от сигнализирането на туморния некрозисен фактор. BIRB 796 и семапимод са p38 MAP киназни инхибитори, които са преминали клинично изпитване при болестта на Crohn, но нито един от тях не е изследван при саркоидоза [44,45].
Разпознати за първи път през 2002 г., инфламазомите са новопризнати рецептори за разпознаване на образци, експресирани върху имунни и възпалителни клетки, насочени към ендогенни и екзогенни патогени. Идентифицирани са множество инфламазоми, но най-добре проучената е инфламазома на NLRP3. Активирането на този протеинов комплекс води до активиране на каспаза-1 и освобождаване на възпалителния цитокин IL-1β, който участва както в остри, така и в хронични възпалителни реакции при различни възпалителни заболявания, включително саркоидоза. Одобрени са няколко инхибитора на NLRP3: рилоноцепт, IL-1 блокер за свързан с криопирин периодичен синдром (CAPS); канакинумаб, mAb инхибитор на IL-1β за CAPS; и анакинра, IL-1 рецепторен антагонист за ревматоиден артрит и CAPS. Никой не е проучен при саркоидоза [46–48].
ЗАКЛЮЧЕНИЕ
Въпреки че е постигнат значителен напредък в разбирането и лечението на саркоидозата, болестта продължава да носи неприемлива тежест по отношение на заболеваемостта и смъртността. Нарастващата смъртност от болестта силно подкрепя необходимостта от разработване на терапии, насочени към модифициране на естествената му история, необходимост от „терапии, модифициращи антисаркоидоза“ [61]. Съществува непреодолима необходимост от изследване на потенциалните ползи от нарастващия брой терапевтични средства, насочени към молекули, свързани с активирането на Т-клетките, Th1 и Th17 имунните пътища, важните пътища за предаване на сигнала и системата убиквитин-протеазома. Нарастващият брой терапевтични средства за лечение на заболявания, които споделят общи патогенни механизми със саркоидоза - като ревматоиден артрит, болест на Crohn и псориазис - предлагат отлична възможност за изследване на тези биологични агенти като нови терапии при пациенти със саркоидоза.
Благодарности
Бихме искали да благодарим на г-жа Тереза Хайнрих за помощта при подготовката на този ръкопис.
- Саркоидоза Симптоми, етапи, причини, диагностика и лечение
- Мезентериален аденит при деца Причини, симптоми; Лечение
- Безалкохолна мастна чернодробна болест - симптоми и лечение
- Лечение на мезентериална исхемия; Профилактика - Съдови здравни клиники
- Слаби хора 5 пъти по-вероятно да умрат след лечение на често срещани сърдечни проблеми - здраве - Hindustan