Резюме
ПАЦИЕНТИ И МЕТОДИ
Субекти.
Всички контролни субекти бяха сдвоени по възраст, тегло и пубертетен статус с CHPN (Таблица 2).
Преди да започне изследването, целта и задачите бяха внимателно обяснени на всеки предмет. Получено е информирано съгласие от децата и техните родители. Изследването е одобрено от Комитета по етика на университета в Лил (Comité Consultatif de Protection des Personnes dans la Recherche Biomédicale, Лил, Франция). Всички процедури са извършени в съответствие с етичните стандарти на Декларацията от Хелзинки от 1975 г., преработена през 1983 г., и Френските добри клинични практики (1987).
Състав на тялото.
В деня на теста всяко дете е пристигнало с кола в Центъра за клинични изследвания в Лил (CIC-9301-INSERM-CHU) или Париж (CIC-9202-INSERM-AP-HP) в 0800 ч. Контролните субекти са гладували от 2000 h предишния ден и парентералната инфузия е била прекъсната с 0800 h на предишния ден за CHPN (Фиг. 1). Теглото и височината бяха измерени. След това детето почива легнало в болнично легло за 15 минути. Съпротивлението на тялото се измерва с помощта на телесен импеданс 50-Hz метър (BIA 101/S, RJL Systems, Clinton Township, MI, USA), а FFM се изчислява по формулата на Schaefer (10).
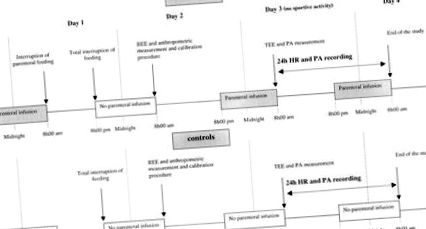
Протокол за изследване, описващ всички събития според времето за пациентите с HPN и контролите.
Дебелината на лявата кожна гънка (трицепс, бицепс, субскапулар и супралиак) е измерена с точност до 0,1 mm с дебеломер Harpenden (Holtain Ltd, Crymmych, Великобритания). FM се изчислява, като се използва или формулата на Брук за деца под 12 години (11), или формулата на Дърнин за деца над 12 години (12). Височината/възрастта и теглото/възрастта на Z-резултата са изчислени с помощта на таблиците на Sempé (13). Тъй като пациентите, лекувани с HPN, бяха изследвани в два центъра - в Лил и Париж, два различни наблюдатели бяха включени в събирането на антропометричните данни. Калиперите от Харпенден бяха сходни в двата центъра и двамата наблюдатели (L.B. в Лил и R.H. в Париж) се обучаваха заедно и бяха тествани с тази техника. Оборудването и процедурите за оценка на антропометричните данни бяха абсолютно еднакви.
Прием на енергия.
Приемът на енергия се оценява за 7 дни преди проучването. Субектите са регистрирали дневен прием на храна или инфузия на PN с конкретна форма за доклад. На всеки пациент или на родителите на пациента бяха дадени указания как да водят точна документация и родителите подпомагаха децата при идентифициране, количествено определяне и записване на консумираните храни. Хранителните записи бяха проверени от диетолог и анализирани с помощта на софтуера BILNUT (Nutrisoft версия 6, Париж, Франция) (14, 15). За CHPN общият енергиен прием е сумата от пероралния прием на храна и PN.
Термогенният ефект на нощното парентерално хранене се изчислява като DIT по формулата DIT = ВИЖТЕ - REE × 0,9 (18).
PA беше измерена в брой килограми (kcount), което е триаксиалното ускорение, едновременно с оценката на TEE, в продължение на 24 часа с помощта на триаксиален акселерометър (TriTrac-R3D, Professional Products, Reining International, Madison, WI, USA) в учебен ден, който не е имал спортни дейности. Доказано е, че TriTrac-R3D е надежден (19, 20) и точен (21–24) при откриване на движение на тялото. Носеше се здраво прикрепен към десния преден торс на субекта на нивото на талията, перпендикулярно на средната линия на предното бедро. Местоположението беше последователно за всички субекти. Всички данни, записани (записани в дневник на дейностите) по време на моторизирано движение (кола, автобус, и т.н..) бяха изтрити от анализа на PA.
Статистически анализ.
Променливите бяха сравнени с помощта на непараметричния тест за сдвоен ранг на Wilcoxon (разликите бяха счетени за значителни при стр
РЕЗУЛТАТИ
Състав на тялото.
Таблица 2 показва антропометрични данни, Z-резултати за тегло/възраст, Z-резултати за височина/възраст, телесен състав и ИТМ на CHPN в сравнение с контролите. Тегло, височина, Z-резултати за тегло/възраст, FFM и FM не се различават между двете групи. Средният ИТМ е значително по-висок с 10,1% (16,9%; диапазон, 15,5–22,0%, за CHPN срещу 15,2%; обхват, 14,2–18,6% за контролите;стр Таблица 3 REE и физическа активност (PA) в двете групи деца
Общи енергийни разходи (TEE), дневни енергийни разходи (DEE) и енергийни разходи за сън (SEE) в kJ/min за двете групи деца. P, парентерално;° С, контрол.
Връзка между разхода на енергия за сън (SEE), изразен в kJ/min на килограм FFM и енергийния поток, вливан от парентерално хранене в kJ/min на килограм тегло.
Връзка между индуцираната от диетата термогенеза като процент на енергийния поток, вливан от парентерално хранене kJ/min.
ДИСКУСИЯ
Силата на нашето проучване да покаже значителна разлика в TEE (основните критерии на нашето проучване) може да бъде изчислена a posteriori според резултатите, които открихме. Използвайки данни (средно: μ1 = 5825 kJ/d, μ2 = 5425 kJ/d, Δ = 400 kJ/d; и SD: SD1 = 2370 kJ/d; SD2 = 1580 kJ/d) и едностранно изпитване с α = 5%, мощността на нашия тест е 1 - β = 13,5% (Z1-β = 1,165). Тази лоша мощност показва, че не е получен броят на субектите, необходими за даване на статистическа разлика. Използвайки едностранен тест, α = 5% и 1 - β = 80%, броят на субектите, необходим за откриване на значителна разлика от 7%, ще бъде 383 на група. Поради ограниченията (технически и строги критерии за включване) на това проучване и относително ниския брой деца на HPN в участващите центрове (общо 100 във Франция, разпределени между пет оторизирани центъра на HPN, два от които участваха в това проучване), беше не е възможно да се включат повече пациенти. Резултатите, получени при пациенти и контролите обаче, бяха много близки (фиг. 2) и стр стойностите бяха доста високи, което подкрепи нашите заключения.
Осем деца представиха заболявания, свързани с потенциални загуби на хранителни вещества, хронична неразрешима диария (н = 5) и синдром на късото черво (н = 3) и шест деца са имали стома. При такива условия може да се предположи повишен енергиен прием. Изненадващо, TEE на тези деца не се различаваше от сдвоените контроли. Това може да се обясни с факта, че всички тези пациенти са били в стабилно състояние на HPN, когато са били изследвани, а приемът през устата е бил много ограничен (средно съотношение парентерално/перорално приемане: 99,7%; диапазон, 44,4–100%), за да се ограничи диарията, стома и загуби на хранителни вещества.
PA може да се счита за важен фактор, определящ качеството на живот. Акселерометрията показва сходни нива на рутинни PA в двете групи. За разлика от това, предишно проучване на възрастни показва силно намалени нива на PA и намаляване на качеството на живот при пациенти с HPN в сравнение с пациенти със синдром на късото черво, които не получават PN (53). Това намаляване на качеството на живот се дължи на сериозно намаляване на PA. Всъщност сериозното намаляване на PA при възрастни вероятно се дължи на ниския процент на заетост сред тези пациенти и може би на разликата в тежестта на основното храносмилателно заболяване между възрастни и деца. Всички CHPN в нашето проучване могат да посещават училище и очевидно са имали нормални рутинни дневни дейности.
Нашите резултати показват, че енергийните нужди на децата с дългосрочни циклични HPN не се различават от тези на контролите и че PN не пречи на PA. Енергийните нужди на CHPN в стабилно състояние, проявяващо се с храносмилателно заболяване, са същите като при здрави контролни субекти.
- Защо GAPS може да се провали на вашето дете - хранителни грижи за деца
- Програмите за спешна хранителна помощ (TEFAP) Хранителни програми Храна; Nutrition Home - Флорида
- Защо Pediasure може да направи вашето дете; s Нарушение на растежа по-лошо - Хранене за деца
- Използване на храненето за борба с хроничната тазова болка - физическа терапия на хармонията на тялото
- Киселото мляко може да бъде решението за много деца, алергични към краве мляко; Кисело мляко в храненето