Назанин Асгари Ханджани
Департамент по хранене, Училище за обществено здраве, Ирански университет по медицински науки, Техеран, Иран
Мохамадреза Вафа
Департамент по хранене, Училище за обществено здраве, Ирански университет по медицински науки, Техеран, Иран
Резюме
Въведение
В днешно време затлъстяването е един от тревожните проблеми, с които се сблъскват обществата по света. Затлъстяването е известно като сложно взаимодействие между генетични и екологични фактори, от време на време съобразено с заболеваемостта и смъртността. Наднорменото тегло и затлъстяването може да са началото или причините за голям брой здравословни проблеми, независимо и във връзка с друго заболяване. Консумацията на храна има две крайности: (i) достатъчно ниска, за да причини смърт от глад и (ii) достатъчно висока, за да доведе до затлъстяване. Ограничението на калориите (CR) е позиционирано между тези две крайности. CR режим обикновено се провежда чрез намаляване на приема на калории с до 20% –40% от ad libitum (AL), докато се поддържа достатъчен прием на хранителни вещества. [1,2]
През 1917 г. за първи път Osborne et al. [3] съобщава, че ограничаването на приема на храна може да забави растежа и да увеличи дълголетието на живота. Поради методологически дефекти обаче не привлече особено внимание. След това, през 1935 г., MacCay [4] публикува статия, която показва, че CR без недохранване при плъхове може да увеличи средната и максималната продължителност на живота. [5] Много изследователи по света потвърдиха това наблюдение и показаха, че CR е най-ефективната негенетична стратегия за удължаване на живота при други моделни организми, включително дрожди, плодови мухи, риби и маймуни. Наблюдава се увеличаване на продължителността на живота на плъховете, когато наличността на хранителни вещества спадне между 30% и 75% от нормалния прием на калории на вида. Не само калорично ограничените гризачи са живели по-дълго от тези, хранени с AL, но също така значителна част от тях (около 30%) са умрели без видима патология, което поражда поразителната възможност стареенето да не е тясно свързано със скъпоструващи патологии. [6,7, 8,9]
От друга страна, историята има много примери, показващи, че CR, поради лишаване от храна, е работил в полза на човешкото здраве. Втората световна война намалява приема на храна на много хора, живеещи в Европа, което води до ползи срещу стареенето. По този начин се съобщава за по-малко случаи на сърдечни заболявания, хипертония и диабет. [1] Освен това честотата на рака е била по-ниска от очакваната сред норвежките жени, преминали през пубертета по време на недостига на храна през Втората световна война. [10]
Някои изследвания показват антираковите ефекти на CR; те обаче не са категорични. [11,12,13] Предлаганият механизъм е, че дългосрочното излагане на CR може да доведе до намаляване на циркулиращите нива на няколко цитокини, растежни фактори и хормони, придружено от намаляване на растежния фактор сигнализация, минутни съдови смущения и възпаление. Същевременно тези промени, причинени от CR, водят до намален риск от рак и прогресия. [14] По-конкретно, при мишки след краткотрайно гладуване се съобщава за намаляване на телесното тегло с 20% или повече, серумен инсулиноподобен растежен фактор 1 (IGF-1) с до 75% и глюкоза с до 70%. При тези обстоятелства животни, подобни на дрожди, стават силно устойчиви на стрес. Освен това, намаляването на нивото на IGF-1 в нормални клетки и мишки повишава тяхната устойчивост на химиотерапевтично увреждане, като същевременно сенсибилизира голям брой тумори към химио и лъчетерапия. [15,16] Клинични проучвания при пациенти със затлъстяване със затлъстяване показват, че след 1 седмица на много нискокалорична диета (VLCD) от 400 kcal/ден или 3 седмици от 500 kcal/ден, секрецията на инсулин се подобрява. [17]
Мишките хомозиготни нокаути за гена на аполипопротеин Е (ApoE -/-) при калорично ограничен режим (60% от общата калория) са имали по-малко образувания на атеросклеротични лезии в относително ранните етапи в сравнение с групата AL [18]. Ендотелната дисфункция и съдовия оксидативен стрес поради затлъстяване са обърнати от CR при мишки C57Bl/6. [19] Резултатите от проучването на човешки и нечовешки примати показват, че CR може да намали триглицеридите, кръвното налягане и да увеличи нивата на липопротеините с висока плътност. [20] CR, подобно на циклофосфамид, може да забави появата на автоимунни заболявания чрез намаляване на дела на В клетките и запазване на голям брой естествени Т клетки и тяхната имунна реакция. [21]
Данните от клинични и основни изследвания сочат към дълбока връзка между спада на мозъчната функция и метаболитната дисрегулация по време на стареенето. Прекомерната наличност на хранителни вещества може да навреди на мозъчната функция. Обратно, установено е, че 30% намаляване на приема на калории за 3 месеца подобрява ефективността на паметта при възрастни хора. Освен тези наблюдения, резултатите от три текущи изследвания на CR върху маймуни резус досега показват, че застаряващите майки, лекувани с CR, страдат от по-малко тежка мозъчна атрофия (отличителен белег на застаряващ мозък) в сравнение с контрола, хранена с AL. [22] Освен това е показано, че CR може да доведе до регулиране на мозъчно-извлечения невротрофичен фактор (BDNF), който е свързан с невроналната пластичност и неврогенезата. [23]
Въпреки полезните и печеливши ефекти на CR, Giller et al. съобщава, че след 6-месечно хранително ограничение, периодът на хранене премахва приблизително всички положителни промени, получени от периода на ограничение. [24] От друга страна, 6-месечно диетично ограничение намалява основния пикочен протеин 5 (Mup5) при мъжки мишки C57BL6, които са отговорни за комуникацията и половата функция. След това, по време на периода на хранене намаляващият поток на Mup5 беше обърнат. [25]
Методи
Данните се основават на резултатите от оригинални и прегледни статии, свързани с CR, включения механизъм, чрез който действа и интервенциите, които могат да имитират подобни на CR ефекти. За тази цел използвахме основно онлайн базата данни на PubMed. Бяха търсени следните ключови думи: CR, механизъм, ограничаване на протеините, периодично гладуване (IF) и епигенетична диета. След това избрахме най-подходящите пълни текстове и прегледахме статиите. Нашият преглед включва изследвания както върху животни, така и върху хора.
Основен механизъм
Другата теория включва положителния ефект на CR върху потискането на целта на рапамицин (TOR) и Akt. Medvedik et al. съобщава, че инхибирането на TOR удължава продължителността на живота по същия механизъм като CR, което означава, че може да стабилизира локуса на рДНК и да увеличи активността на Sir2p. [30,31] Пътят на TOR на бозайниците (mTOR) е замесен в развитието на тумори на млечната жлеза. Следователно премахването на нейната субединица е свързано с намаляване на честотата на свързани с възрастта заболявания като имунна и двигателна дисфункция, костни заболявания и инсулинова чувствителност. [32,33]
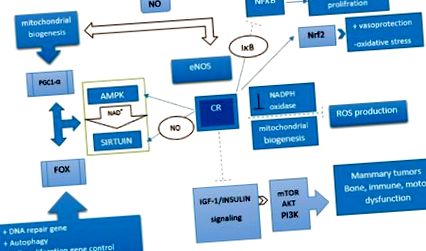
Заедно адаптациите, които се случват поради CR, са регулиране надолу на инсулин/IGF пътя (т.е. PI3K/Akt/mTOR) и регулиране на два енергийно чувствителни пътя (т.е. сиртуин [SIRT] и активирана протеинкиназа [ AMPK]), които активират разклонителя O (FOXO). FOXO е съобразен с регулиране на гените за автофагия, гена за възстановяване на ДНК и регулирането надолу на гените, които контролират клетъчната пролиферация. [34] За разлика от ефектите на FOXO върху промоцията на апоптозата, те трансактивират реактивни кислородни видове (ROS) -детоксикиращи ензими като каталаза и супероксиддисмутаза 2 (SOD2/MnSOD). Следователно вътреклетъчният оксидативен стрес ще намали, което ще доведе до оцеляване на клетките. [35,36] Следователно ролята на FOXO в апоптозата и оцеляването на клетките е като нож с две остриета.
При ниско енергийни клетъчни нива се активира AMPK, което е придружено от регулиране надолу на mTOR. [37] AMPK има основна роля в липидния метаболизъм и митохондриалната биогенеза. PGC-1α, транскрипционен регулатор, който координира биогенезата на митохондриите, трябва да бъде ниско ацетилиран от зависимата от никотинамид-аденин динуклеотид (NAD +) деацетилаза SIRT1, за да работи правилно. Остатъкът му обаче трябва да бъде фосфорилиран от AMPK, за да бъде разпознат и да взаимодейства със SIRT1. Освен това AMPK увеличава вътреклетъчното ниво NAD + и подобрява активността на SIRT1. [38]
Другият механизъм, който играе роля в CR-медиираните предимства против стареене, е автофагията. Окислителното увреждане на макромолекулите и органелите възниква чрез нормален метаболизъм. Ако тези увредени молекули не бъдат отстранени чрез автофагия, те се превръщат в източник за производство на свободни радикали, което води до оксидативен стрес, възпаление и тежки заболявания. Автофагията функционира като защитен механизъм, който премахва повредените или остарели органели, за да предпази клетките от по-нататъшен оксидативен стрес, дисфункция и клетъчна смърт. Данните показват, че намаляването на аминокиселините, дължащо се на CR, стимулира автофагията и лизозомната протеолизна активност. [39] Освен това, проучвания, проведени върху различни еукариотни видове, показват, че CR е най-мощният индуктор на автофагия и може да предотврати свързаните с възрастта заболявания. [40] Инхибирането на TOR и активирането на AMPK, произтичащи от CR, могат да активират автофагично стимулиращия Unc-51 като автофагия активиращ киназа 1 комплекс паралелно с ацетилтрансферазата Mec-17, които стимулират микротрубни транспортни машини, необходими за автофагия. Освен това автофагичните протеини ще бъдат активирани чрез деацетилиране чрез SIRT1, който сам се активира от CR. [41]
Доказано е също така, че CR намалява производството на ROS чрез регулиране надолу на NADPH оксидаза. От друга страна, очевидно е, че ядреният фактор-еритроид 2 (Nrf2) играе ключова роля във вазопротекцията и регулирането на процеса на стареене, като организира транскрипционния отговор на клетките към оксидативен стрес. CR възстановява експресията и активността на Nrf2 в остарели мозъчно-съдови ендотелни клетки на мозъка. [42] Освен това CR намалява ерозията на теломерите, свързана със стареенето, и намалява честотата на рака чрез свръхекспресия на теломераза. [43] Ядреният фактор kappa B (NFκ-B) също е редокс-чувствителен транскрипционен фактор, който индуцира експресията на гени, участващи в клетъчната пролиферация и възпаление. Предполага се, че CR повишава цитоплазмените нива на IkkB, които предотвратяват транслокацията на NFκ-B в ядрото. [44]
CR индуцира ендотелната азотна оксидна синтаза и води до увеличаване на митохондриалната биогенеза. По подобен начин NOS активира гена SIRT1 in vivo и in vitro. Бозайниците съдържат седем хомолога дрожди Sir2, SIRT1–7, които имат многобройни оздравителни и противостареещи ефекти. [45] Сред тях SIRT1 е проучен най-подробно. Той има способността да свързва метаболитния статус с транскрипционните резултати, като по този начин играе ключова роля в енергийната хемостаза. Той може да регулира стимулираната от стрес глюкозна секреция на инсулин в β-клетките на панкреаса и да насърчи оцеляването на β-клетките на панкреаса по време на оксидативен стрес и глюконеогенеза. [45] SIRT имат десетина субстрата, сред които са регулатори на възрастта, като семейството на транскрипционните фактори FOXO. [46] Ефектите на SIRT1 върху функциите на FOXO са сложни и силно зависими от целевите гени на FOXO. SIRT1 намалява транскрипцията на гени, участващи в апоптозата, като същевременно насърчава експресията на целеви гени FOXO, участващи в устойчивост на стрес. [36] Освен това се посочва, че CR предизвиква увеличаване на експресията на SIRT3. Активирането на SIRT3 по време на CR намалява оксидативния стрес чрез активиране на митохондриалния антиоксидантен ензим, SOD2 [Фигура 1]. [47]
Пътят на механизма участва в ефекта на ограничаване на калориите. Ограничението на калориите повишава регулирането на активираните протеинкинази и сиртуиновите пътища и понижава регулирането на инсулиноподобния растежен фактор 1/инсулиновия път. Като цяло, ограничаването на калориите активира път, който намалява възпалението, производството на реактивни кислородни видове и оксидативен стрес чрез подобряване на митохондриалната биогенеза и детоксикираща ензимна активност. Нещо повече, той може да регулира клетъчната пролиферация и диференциация чрез регулиране на ядрените фактори: индуцира: --->, инхибира: --- |
По време на стареенето, целостта на хроматина и способността за хемостаза ще намалеят поради аберантна генна експресия. ДНК метилирането играе основна роля в поддържането на ДНК стабилността и целостта. В допълнение, той може да регулира генната експресия в различни биологични процеси. Две основни промени в метилирането на ДНК настъпват по време на прогресията на стареенето. Тези промени водят до глобално намалени, но локално повишени статуси на метилиране на ДНК. Интересното е, че CR има способността да коригира този неправилен модел на метилиране на ДНК, предизвикан от стареене. Процесите на ацетилиране и деацетилиране на хистон се катализират от специфични ензими, наречени съответно хистон ацетилтрансферази и хистон деацетилаза (HDAC). Като цяло, колкото по-ацетилирани стават хистоновите амино опашки, толкова по-вероятно е регионът на генния промотор, съдържащ хистоните, да има повишена транскрипционна активност. Повишената активност на HDAC може да доведе до туморогенеза чрез ефекти върху епигенетичната генна експресия, което прави свръхекспресията на HDAC много често срещана характеристика на раковите клетки. Съобщава се, че HDAC активността се увеличава по време на CR, което предполага, че глобалното деацетилиране може да има защитна роля срещу хранителния стрес и може да повлияе на процесите на стареене. [48,49]
Прекъсващо гладуване
Поведението и физиологията на организма са в съответствие с 24-часовите цикли светлина/тъмнина (LD), които се контролират от еволюционно запазени естествени циркадни осцилатори. При бозайниците сигналите на LD циклите стимулират и контролират централния циркаден часовник, който се намира в супрахиазматичното ядро на хипоталамуса, което в крайна сметка води до адаптация на околната среда. [50]
Предполага се, че повишената активност по време на почивка в предмодерния свят, съчетана с нарушаване на съня, е свързана с повишено разпространение на сърдечно-съдови заболявания, диабет и затлъстяване, заедно с някои видове рак и възпалителни разстройства. [51] От друга страна, Puttonen et al. съобщава, че 2-и 3-нощните работни смени са придружени с повишено системно възпаление. [52]
Изследователите сравняват ограниченото във времето хранене (tRF) с достъпа до AL, както при диета с високо съдържание на мазнини (HFD) при мишки. Те са видели, че „мишките под tRF консумират еквивалентни калории от HFD като тези с AL достъп. Първият обаче е защитен срещу затлъстяване, хиперинсулинемия, чернодробна стеатоза и възпаление, а също така има подобрена двигателна координация. " Следователно те стигнаха до заключението, че режимът на tRF подобрява функциите на CREB, mTOR и AMPK пътя и трептенията на циркадния часовник. [53] Освен това Zarrinpar et al. са показали, че микробиотата на червата, навлажнена по време на HFD при плъхове, може да бъде възстановена чрез tRF. Тъй като чревната микробиота влияе върху метаболизма на гостоприемника, това е важна стратегия срещу затлъстяването и други заболявания. [54]
IF намалява проинфламаторните протеини като NLRP1 и NLRP3, NF-κB, IL-1 β и IL-18 в мозъка и периферията след церебрална исхемия при мишки. [55] IF, комбинирана с кетогенна диета (KD) при деца с непълен отговор на диетата, има умерени или преходни подобрения в контрола на припадъците при четири от шест деца в проучването и се дължи на невропротективните ефекти на IF. [56] Освен това се съобщава, че IF подобрява когнитивните дефицити при плъхов модел на сепсис чрез механизъм, включващ потискане на провъзпалителни цитокини, активиране на NFκB и засилване на невротрофичната подкрепа. В допълнение, намалява индуцираното от липополизахарид повишаване на нивата на интерлевкин (IL) -1α, IL-1β и фактор некроза на тумора алфа и предотвратява индуцираното от липополизахаридите намаляване на нивата (BDNF) в хипокампуса. [57] Изследвания на плъхове и мишки показват, че упражненията с бягане и IF увеличават експресията на BDNF в няколко области на мозъка и подобряват синаптичната пластичност и неврогенезата.
И при мишки, и при хора гладуването съответно за 2 или 5 дни причинява 30% или повече намаление на глюкозата, над 50% намаляване на IGF-I и 5-10-кратно увеличение на IGF-1 свързващия протеин. [ 58] IF при плъхове намалява сърдечната честота, кръвното налягане и нивата на инсулин, подобни или по-високи от тези, получени при редовно физическо натоварване, чрез механизъм, включващ стресови реакции (повишаване на плазмения адренокортикотропин и кортикостерон). Тъй като инсулиноподобните сигнални пътища регулират надолу клетъчната реакция на стрес, това е друга причина за противоположните им действия. [59] При изследването на връзката между честотата на хранене и възпалителните биомаркери се съобщава, че жените, които ядат 20% калории от протеини, срещу Jain S, Singh SN. Ограничение на калориите - подход към управлението на затлъстяването. J Nutr Disord Ther. 2015 г .; 1: 2161–0509. [Google Scholar]
- Класиране на компаниите за диета за отслабване Най-добрият начин да се прави периодично гладуване за отслабване 2019 Дан
- Втори ден от 16 8 Интермитентно гладуване (наблюдатели на тегло, смути, въглехидрати, килограми) - Диета и
- Класиране на телесните мазнини с периодично гладуване (продажба) Nrg хапчета за отслабване Най-добрите онлайн треньори за отслабване
- Нова диетична тенденция в Америка с периодично гладуване
- Протеиносъхраняващо Модифицирано гладуване за бързо отслабване Планът ми за диета