Съдържание
- 1 Субект на заболяването
- 1.1 Болест
- 1.2 История на заболяването
- 1.3 Генетика
- 1.4 Патофизиология
- 1.5 Епидемиология
- 2 История
- 3 Физически преглед
- 4 Диагностика
- 4.1 Лабораторно изследване
- 4.2 Диференциална диагноза
- 5 Системно управление
- 5.1 Управление на блефароптозата
- 5.2 Усложнения на блефароптозата
- 5.3 Прогноза
- 6 Референции
Окулофарингеалната мускулна дистрофия се разпознава от следните кодове съгласно стандартната номенклатура:
- Международна класификация на болестите (ICD)
- ICD 10: G71.0
- Онлайн Менделско наследяване на човека
- OMIM: 164300
Болест
Окулофарингеалната мускулна дистрофия (OPMD) обикновено е късно настъпило генетично автозомно доминиращо предавано наследствено заболяване на скелетните мускули. OPMD включва предимно очните мускули (окуло-) и фаринкса (-фарингеална), но често включва и проксималните мускули на крайниците. Свързва се с прогресивна блефароптоза (птоза) и дисфагия. Други доброволни мускули могат да бъдат засегнати с течение на времето. Мускулните групи, обикновено засегнати освен асансьора на клепачите и извъночните мускули, включват проксималните мускули на долните крайници и в по-малка степен горните крайници. Проявата на симптомите обикновено е в 5-то десетилетие от живота, въпреки че в някои случаи по-рано и по-тежко засегнати.
История на заболяването
Първоначално за OPMD се съобщава при четирима членове на френско-канадско семейство през 1915 г. [1] и състоянието е описано за първи път чрез използване на термина „окулофарингеална мускулна дистрофия“ от M Victors, R Hayes и RD Adams през 1962 г. [2]
Генетика
Автозомно доминиращо наследствено разстройство, основната генетична аномалия е мутация на гена pABPN1, която е описана за първи път през 1988 г. [3] Заболяването се причинява от разширяване на аланина (GCN; обозначен като такъв, защото четири различни кодона - GCA, GCT, GCC и GCG - могат да кодират аминокиселината аланин) повторен регион на хромозома 14q11.2. [3] Този регион е част от N-края на полиаденилат-свързващия протеин ядрен 1 ген (PABPN1, по-рано съкратен като PABP2). PABN1 има регулаторни функции при полиаденилирането на пратената РНК. [4] N-терминалният домейн обикновено е (GCN) 10 (обозначен (GCN) 10/Ala10), но дължината на аланиновите разширения варира от +1 до +8. [5] Мутацията е стабилна през поколенията и не показва генетично очакване.
Чести мутации, сортирани по разпространение:
- GCN) 13 е най-често срещаната доминираща мутация в Квебек и по света
- (GCN) 11 е рецесивен полиморфизъм, който се носи от 1-2% от индивидите в Северна Америка, Европа и Япония. Той причинява по-тежък фенотип, когато пациентът е съставен хетерозигот с вариантите (GCN) 13 и (GCN) 11
- Има редки случаи на хомозиготи, които носят две доминиращи мутации, наследени от двамата им засегнати родители, които имат много по-тежък фенотип
Въпреки че моделът на наследяване обикновено е автозомно доминиращ, е документирана алелна автозомно-рецесивна форма (вижте често срещаните мутации по-горе). В случаите на автозомно доминираща OPMD, макар че дори една мутация е достатъчна, за да причини заболяване, понякога и двата алела са мутирали, което води не само до по-ранна проява на заболяването, но и до по-бърза и по-тежка прогресия. При пациенти с AD всяко дете с хетерозиготен носител има 50% шанс да наследи болестотворната мутация. Съществува почти пълен модел на проникване с повишен риск от представяне с повишена възраст. Повечето индивиди с мутация са представени през 7-то десетилетие от живота (но средното начало е в 5-то десетилетие). За тези с автозомно-рецесивна мутация, потомството ще бъде облигатен хетерозигот (носители), но рискът им да бъдат засегнати е по-малко от 1%, като се има предвид 2% процент на носител за рецесивния алел (GNC) 11. [3]
Патофизиология
Генът PABPN1 е отговорен за целостта и транспорта на иРНК в скелетните мускулни клетки през тялото, запазвайки нейната цялост и функция. При пациенти с мутация на PABPN1, крехкостта на иРНК се увеличава, което води до образуване на бучки вътреклетъчно. Тези натрупвания (вътреядрени включвания) водят до прогресивна дисфункция на мускулните клетки, евентуална клетъчна смърт и следователно прогресивна клинична мускулна дисфункция.
По този начин в допълнение към генетичното изследване, мускулната биопсия може да бъде полезна за диагностициране на OPMD. Наличието на вътреядрени включвания (INI) в мионуклеусите е специфичен хистологичен белег на OPMD. На слайд, INI, съдържащ PABPN1, и много други РНК-свързващи протеини, могат да се видят чрез електронна микроскопия като тубуларни нишки в 4-5% от делтоидните мускулни ядра на пациенти с OPMD. [6] Не е известно каква е причината за OPMD, но основната хипотеза е, че патологията се причинява или от 1) натрупването на протеини (INI), или 2) от липсата на нормален протеин. Клинично незасегнатите мускули също могат да имат хистологични находки, като оформени вакуоли и дрипави червени влакна, които показват дистрофична патология (но находките в незасегнатите мускули не са специфични за OPMD). [7]
Епидемиология
Най-големият клъстер на OPMD е в Квебек, Канада, но случаи са наблюдавани в над 30 страни. [8] Френско-канадското население на Квебек има OPMD честота 1/1000, [9] докато израелското еврейско население Бурхара има най-високата генна честота в света с 1/600 засегнати. [10]
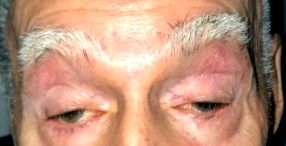
Пациентите обикновено се оплакват от бавно прогресираща двустранна, макар и често асиметрична блефароптоза. Пациентите понякога компенсират, като заемат позиция „брадичка нагоре“ с удължаване на врата, за да изместят зрителната си ос по-ниско от птотичните горни клепачи. Дисфагията започва с твърда храна, но може да прогресира и да включва течности. Трудности с речта или дрезгав слаб глас може да е видна черта. Някои пациенти ще забележат прогресивна умора и забавяне или промяна в походката. Слабостта на долните крайници е по-често от слабостта на горните крайници. Проксималната слабост на горните крайници се забелязва най-вече в делтоидните мускули, ако изобщо е така.
Клиничните признаци на OPMD ще варират в зависимост от възрастта, въпреки че в крайна сметка всички пациенти ще развият птоза и дисфагия с известна степен на проксимална слабост на крака. В зависимост от засегнатата генетична група признаците включват: [11] [12]
Подходящи нормални находки са неповредени вътрешни очни мускули и нормална функция на ретината.
Следните три критерия са полезни за установяване на диагнозата OPMD по клинични причини: [9]
- Положителна фамилна анамнеза с участието на две или повече поколения (важна странична бележка: при всеки пациент със съмнение за генетично заболяване е важно да се попълни родословие)
- Наличието на птоза или предишна коригирана операция за птоза (една или и двете палпебрални цепнатини, по-малки или равни на 8 mm (средната стойност е 10 mm вертикално).
- Наличието на дисфагия (невъзможност да се изпият 80cc студена вода за по-малко от 8 секунди)
Горните критерии са специфични за проникването на мутацията (GCN) 13 при 31% пациенти на 50-годишна възраст, докато той е 99% специфичен за тези над 69-годишна възраст. [15]
Лабораторно изследване
Чувствителността и специфичността на теста с единична полимеразна верижна реакция (PCR) за мутация на PABPN1 за определяне на състоянието на носител на индивида е по-голяма от 99%. Размерът на ДНК продуктите може да се използва за определяне на броя, броя на GCN вмъкванията и точната GCN последователност. Показанията за ДНК тестване на симптоматично лице са: [12]
- Потвърждение на диагнозата в семейство, което никога не е тествано
- Потвърждение на клинична картина, която представлява диагностична дилема
- Оценка на размера на мутацията като възможен показател за тежестта
- Оценка на състоянието на съединение хетерозигот при пациент с тежка форма на по-ранно начало
- Потвърждаване на тези, които могат да страдат от рецесивен OPMD
Диференциална диагноза
- Очна миастения гравис (за разлика от OPMD, птозата е флуктуираща и уморяваща)
- Митохондриална миопатия
- Хронична прогресивна външна офталмоплегия (CPEO; пълната външна офталмоплегия е рядка при OPMD)
- Синдром на митокондиалната неврогастроинтестинална енцефалопатия (MNGIE; Понякога наричан детска OPMD, но не са открити мутации на PABPN1 (GCN))
- Окулофаригнодистална миопатия (OPDM; слабостта се появява по-рано в живота. Вижда се лицева диплегия, докато това не е драматично при OPMD)
- Миотонична дистрофия (за разлика от OPMD, миотонията, невъзможността да се отпуснат мускулите след употреба, е често срещана.) Екстраокуларните мускулни отклонения често водят до диплопия. Също така, очните находки на миотонична дистрофия включват промени в катаракта на „Коледно дърво“ и има относително ниско вътреочно налягане при очна миотонична дистрофия, вероятно поради отлепване на цилиарното тяло. (Птозата е обща и за двамата) [16]
- Полимиозит (няма да има птоза)
- Включен миозит на тялото (IBM; включително миозит, полимиозит и прогресираща булбарна парализа. Те нямат птоза)
- Автозомно доминираща дистална миопатия (слабост на гласните струни без птоза)
- Вродена фиброза на екстраокуларните мускули (CFEOM; вродена птоза без дисфагия).
Понастоящем няма установено медицинско лечение за OPMD. Трябва да се насърчава диета с високо съдържание на протеини, за да се ограничи загубата на тегло и ненужни сърдечно-съдови упражнения, за да се ограничи разграждането на мускулите. [12] Може да се наложи помощ при амбулация с бастун или инвалидна количка.
Трябва да се оцени симптоматичната дисфагия. Тежка дисфагия, изразена загуба на тегло, почти фатално задавяне или рецидивираща пневмония изискват спешна оценка. Криофарингеалната миотомия (миектомия на горния езофагеален сфинктер) в повечето случаи ще облекчи симптомите. [17] Разширението на крикофарингея е най-използваното лечение, въпреки че все още липсват научни доказателства в подкрепа на неговите дългосрочни ползи. Крикофарингеален ботулинов токсин, автоложна трансплантация на миобласти след миектомия и използване на молекулата трехалоза за подобряване на фенотипа OPMD са сред терапиите, които в момента се изследват при хора. [18] [19] [20] [21] Изпитвания върху животни за заглушаване на мутантния ген PABPN1 и замяната му с функционално копие са успешни при мишки и се полагат усилия да се оцени дали този успех е преносим върху човешки пациенти. [22]
Управление на блефароптозата
Корекцията на блефароптозата се препоръчва, когато клепачите пречат на зрението или пациентът се оплаква от болка в шийката на матката поради постоянно разширение на врата. Възможни са както резекция на апоневрозата на леваторните палпебри, така и фронтална суспензия. [23] Първоначално се смяташе, че насоките на вродената птоза на Брада могат да бъдат приложени към тези с OPMD, [24] и че резекцията на апортен апарат на levator palpebrae би била разумна основна процедура, базирана на тези насоки. [25] Въпреки това, за разлика от вродената птоза, която е статично заболяване, OPMD прогресивно се влошава с времето. Следователно, насоките на Beard са склонни да осигуряват високи нива на повторна операция при тези с OPMD, които се подлагат на аванса.
Поради тази причина много хирурзи сега избират първично фронтално окачване, дори ако функцията на леватора е> 4 мм. [26] Frontalis суспензия може също да се използва при повторни операции на пациенти, които са имали предишна резекция на леватор. Доказано е, че суспензията на Frontalis постига адекватни резултати, включително при тези с добра функция на повдигателя. [27] Предвид множество публикации с различни материали за окачване, модели на окачване и време за проследяване, никоя техника или материал не се счита за златен стандарт. Въпреки това, синтетичните материали придобиха популярност с големи проучвания върху полипропиленови конци и силиконови ленти, които дадоха приемливи резултати. [27] [28] (Фигура 2)
Противопоказания за блефаропластика са изразена офталмоплегия, синдром на сухото око или лоша функция на орбикулариса. [12]
Усложнения на блефароптозата
Lagophthalmos е най-важното съображение. Когато се извършва фронтална суспензия под местна анестезия, насочването към гранично рефлекторно разстояние-1 (MRD1) по-голямо от 3 mm, особено при пациенти с лош орбикуларен тонус, може да доведе до значително излагане на роговицата. Стремежът към консервативен MRD-1 (обикновено ≤2,5 mm) ще сведе до минимум лагофталмите и потенциално сериозните нежелани събития. Възможни са излагане на прашка, рецидив на инфекция или блефароптоза поради прогресия на заболяването, приплъзване на възел или окабеляване на материал. Полипропиленовите и силиконовите ленти в повечето случаи могат да бъдат коригирани като вторична процедура за модифициране на MRD-1.
Прогноза
OPMD е прогресиращо заболяване. Пациентите ще изпитват прогресивна загуба на мускулна сила. Повторните операции с блефароптоза могат да бъдат сведени до минимум, като се вземе предвид първичната фронтална суспензия, особено в случаите с намалена функция на леватора. С адекватно лечение на фарингеална дисфункция и хранене, продължителността на живота не се съкращава. [13]
- Останете позитивни с отслабване и мускулна дистрофия - Форуми за мускулна дистрофия
- Силна тренировка за гръб за изграждане на мускулеста рамка
- Болезнена мускулна атрофия на крака Ревматология Oxford Academic
- Проект СТАРТИРАНЕ Националният център за здравословни безопасни деца
- Взаимодействия на субединиците и тяхната връзка с алостеричните свойства на заешкия скелетен мускул