Резюме
Заден план
Болест на Niemann-Pick тип С (NP-C) е наследствено невродегенеративно заболяване (1 на 100 000 новородени), причинено от увреждане на NPC протеини, което води до нестерифицирано натрупване на холестерол в късни ендозомни/лизозомни отделения. Към днешна дата NP-C диагностиката обикновено се основава на откриване на холестерол във фибробласти, използвайки инвазивно и отнемащо време оцветяване на Filipin и се нуждаем от повече аргументи за широко въвеждане на оксистеролите като биомаркери в NP-C.
Методи
Доколкото NP-C представлява около 8% от всички холестази за кърмачета, в това проспективно наблюдателно проучване ние се опитахме да преоценим специфичността на плазмения оксистерол и хитотриозидазата като биохимични скринингови маркери на NP-C при деца със синдром на холестаза с неизвестен произход. За 108 пациенти (на възраст от 2 седмици до 7 години) са измерени нивата на холестан-3β, 5α, 6β-триол (C-триол) и хитотриозидаза (ChT). За пациенти с повишен C-триол и/или ChT NPC1 и NPC2 гените са секвенирани по Сангер и 47 допълнителни гена (от потребителския панел за увреждане на черния дроб) са NGS-секвенирани.
Резултати
Повишено ниво на C-триол (> 50 ng/ml) е установено при 4 (от 108) бебета със синдром на холестаза с неизвестен произход, с последваща молекулярно-генетична NP-C диагноза за един пациент. Плазменият холестерол значително корелира със С-триол (стр
Заден план
Болестта на Niemann-Pick тип С (NP-C) е рядко прогресиращо невродегенеративно заболяване с честота на едно на 89 000–150 000 живородени сред западноевропейското население [1, 2]. Приблизително 95% от случаите на NP-C са причинени от мутации в NPC1 ген (локус 18q11-q12), с приблизително 5%, причинени от мутации в NPC2 ген (локус 14q24.3). Патологичните мутации в тези гени водят до нарушен вътреклетъчен транспорт на холестерол и последващо натрупване на свободен холестерол и липиди в ендозомите и лизозомите [2].
Клиничните симптоми на NP-C са силно променливи и могат да бъдат разделени в три категории: висцерални, неврологични и психиатрични [3]. Проявите са променливи по отношение на възрастта, варираща от неонаталния период (45–65%) до седмото десетилетие от живота [4,5,6].
Най-ранните клинични симптоми на NP-C сред всички пациенти са синдром на неонатална холестаза, изолирана спленомегалия и хепатоспленомегалия [1, 3, 7]. Съобщени са и някои случаи на неимунен хидропс и асцит [8, 9]. В повечето случаи признаците на свързана с NP-C холестаза намаляват спонтанно до 6-8-ия месец от живота, докато уголемяването на черния дроб и/или далака продължава дълго време [10].
Технически трудното и отнемащо време оцветяване с филипин беше основният диагностичен метод през предишните десетилетия [11]. Тъй като съвременните NGS методи все още не са разглеждани като скринингов подход (особено по отношение на високата честота на неонатална холестаза при 1 на 2500 новородени) [3, 11, 12], новите биохимични маркери са силно търсени за NP-C скрининг.
Хитотриозидазата (ChT) е свързаният с макрофагите активационен плазмен ензим, който се използва като биомаркер за лизозомни заболявания на съхранение (LSD), включително болест на Гоше (GD) и NP-C [13]. Специфичността на NP-C на този маркер обаче не е достатъчна, тъй като е положителна при различни състояния, включително холестаза и системни автоимунни възпалителни заболявания. Също така ChT не е информативен при значителна част от индивидите поради честата загуба на функция, която води до дефицитна активност при хомозиготни индивиди и възможни фалшиво отрицателни при хетерозиготни случаи. Наскоро реактивните окислителни видове (ROS), холестан-3β, 5α, 6β-триол (C-триол) и 7-кетохолестерол (7-KC), са установени като надеждни и удобни диагностични биомаркери за NP-C [14,15, 16,17,18,19,20,21]. Данните (възрастни пациенти) показват, че C-триолът има добра чувствителност и специфичност за скрининг на NP-C, докато 7-KC има ограничена специфичност [11, 22].
Последните проучвания за профилиране на оксистерол показват сравнително ниска специфичност на оксистеролите като NP-C биомаркер при бебета със синдром на холестаза [23]. Доколкото NP-C представлява около 8% от всички холестази на бебета [24], ние се опитахме да преоценим специфичността на плазменото откриване на C-триол и ChT сред кърмачета със синдром на холестаза за скрининг на NP-C.
Методи
Етика и съгласие
Това проспективно наблюдателно кохортно проучване е проведено в съответствие с Етичния кодекс на Световната медицинска асоциация (Декларация от Хелзинки) и протоколът на изследването е разгледан и одобрен от Комитета по етика на Националния медицински център по акушерство, гинекология и перинатология Кулаков ( Протокол № 13 от 06 декември 2013 г.). Всички участници (родители на деца) предоставиха писмено информирано съгласие.
Пациенти и дизайн на проучването
Кръвните проби са получени от 108 бебета (на възраст от 2 седмици до 7 години) със синдром на холестаза с неизвестен произход (документиран през първите месеци от живота) в Националния медицински център по акушерство, гинекология и перинатология Кулаков (Москва, Русия) и Изследователски център за медицинска генетика (Москва, Русия) между януари 2014 г. и май 2017 г. Кръвните проби се събират в епруветки от 4 ml BD Vacutainer K3EDTA, центрофугират се за 5 минути при 3000 об/мин и плазмата се замразява при - 80 ° C до анализ.
Пациентите бяха разделени на две групи въз основа на наличието или отсъствието на клинични и лабораторни признаци на холестаза в момента на включване: Група 1 - бебета с клинични и лабораторни симптоми на холестаза чрез анализ на C-триол и ChT и; Група 2 - бебета без клинични или лабораторни симптоми на холестаза/синдром на цитолиза по време на измерване на оксистерол, но които са имали преходна холестаза през първите месеци от живота си.
Група 1 включваше 80 деца (средна възраст 3,0 месеца, SD 1,7 месеца, диапазон 0,5–10 месеца). 65 деца (81%) от група 1 са имали увеличен черен дроб по време на измерване на оксистерол и ChT (средно 4,3 cm, SD 1,6 cm, диапазон 2,5–8,0 cm) под нивото на ребрата по средната ключична линия и 71 ( 89%) са имали спленомегалия (средно 2,5 cm, SD 1,6 cm, диапазон 0,5–6,0 cm). Повишени биохимични маркери на холестаза и синдром на цитолиза са наблюдавани за всички деца в група 1 (Таблица 1).
Група 2 включва 28 деца (средна възраст 31,8 месеца, SD 28,0 месеца, диапазон 5–84 месеца) с подробности за предишна неонатална холестаза от анамнезата. Всички деца от група 2 са имали анамнеза за жълтеница и хепатомегалия през първите месеци от живота. Двадесет пациенти са имали анамнеза за предишна спленомегалия и епизоди на алкохолно изпражнение. Прекратяването на жълтеница означава средна възраст 3,7 месеца, SD 1,8 месеца (с едновременно нормализиране на цвета на изпражненията, нивата на билирубина, активността на GGT и нивата на холестерола). По време на изследването не е открита холестаза, но седем деца разкриват хепатоспленомегалия.
По време на периода на наблюдение в група 1 или 2 не са открити признаци на чернодробна недостатъчност и портална хипертония.
Клинично описание на потвърдения случай на NP-C: детето (XY) е родено на 39 седмици. При раждане: тегло 3670 g, височина 50 cm, Apgar 7/8, черен дроб + 2–2,5 cm, далак 2 cm. Ден 2: появи се жълтеница. Ден 4: черен дроб + 4–4,5 см, далак 3,5–4 см, общо 124 mkM/L, дир. 33 mkM/L, Alp 700 mkM/L, ALТ 173 U/L, AST 118 U/L, TORCH отрицателен, без признаци на портална хипертония. Жълтеницата отзвучава с 4 седмици, черният дроб намалява с 6 месеца (но далакът постепенно се увеличава до 5–5,5 cm). Мускулна хипотония се забелязва на 8 седмици. 12 месеца: известно забавяне на психо-моторното развитие. На възраст от 2,5 години (когато пациентът е имал първоначални неврологични признаци на заболяването) терапията с Miglustat е започнала с положителен ефект. Семейна анамнеза без особености (братя - здраво момиче на 7 години).
Клиничен преглед и общо лабораторни изследвания
Прегледът включваше: наличие на жълтеница, цвят на изпражненията, пруритус, размер на далака и размер на черния дроб (см под дясното крайбрежно ниво и по дясната средна ключична линия). Лабораторните тестове бяха: общи и директни нива на билирубин, ензимни активности на гама глутамил транспептидаза (GGT) и алкална фосфатаза (ALP), серумен холестерол и триглицериди, повишени трансаминази (аланин аминотрансфераза [ALT] и аспартат аминотрансфераза [AST]) и тестове за чернодробна функция (албумин, холинестераза [CE], фибриноген, протромбиново време и INR).
Анализ на С-триол
EDTA-плазменият С-триол е определен за всички пациенти като диметиламинобутират естери чрез анализ на течна хроматография в тандемна масспектрометрия (LC-MS/MS), с малки модификации [25]. Хроматографското разделяне се извършва на колона Phenomenex Gold C18 (2.1 × 100 mm, 5 μm), като се използва линеен градиент от 5 mM амониев формиат и ацетонитрил върху LC20 HPLC система (Shimadzu, Япония). Това беше последвано от детекция на Sciex 3200 QTrap масспектрометър (ABSciex, САЩ). D7-C-триолът се използва като вътрешен стандарт. Анализът е линеен в диапазон на концентрация от 0,5-200 ng/mL. Вътрешно- и междудневната проба варира съответно между 2,3–9,6% и 3,8–11,8% (% CV). Границите на количествено определяне (LOQ) и откриване (LOD) са съответно 0,5 ng/ml и 0,05 ng/ml. Нормалните стойности на С-триол са 0-50 ng/mL [18, 26].
Активност на лизозомни ензими
Анализ на хитотриозидаза
ChT активността беше измерена въз основа на изсъхнали кръвни петна, приготвени върху филтърни карти от проби EDTA. Използван е стандартен флуорометричен метод, както е описано [27]. Нормалният диапазон на стойностите на ChT е 2,5–100 nM/h/ml.
Бета-глюкозидазна и сфингомиелиназна активност
Бета-глюкозидазната и сфингомиелиназната активност бяха определени като част от мултиплексния анализ съгласно публикуван протокол с някои модификации [28]. Масспектрометрията беше извършена на тандемен масспектрометър API 3200 QTrap (ABSciex, САЩ) в режим на мониторинг с множество реакции (MRM). Измерванията бяха стандартизирани спрямо контролни проби с известни ензимни активности, получени от Центъра за контрол на заболяванията (CDC; Атланта, САЩ).
Молекулярно-генетичен анализ
Мутационен анализ беше извършен с помощта на ДНК от кръвни проби на пациентите. Екзони и флангови региони на NPC1 и NPC2 гените бяха PCR амплифицирани с помощта на оригинални PCR праймери (Таблица 2) и секвенирани в генетичния анализатор ABI PRISM 3500xL (Applied Biosystems, САЩ) със стандартна BigDye химия.
Екзони и флангови области на гени, включени в персонализирания Ion AmpliSeq ДНК панел (ABCB11, ABCB4, ABCD3, AGL, AKR1D1, ALAD, ALDOB, ATP7B, ATP8B1, C10orf2, CYP7B1, DGUOK, FAH, FBP1, G6PC, GAA, GALE, GALT, GBE1, GYS2, HADHA, JAG1, LIPA OTC, PFKM, PGAM2, PGM1, PHKA2, PHKB, PHKG2, POLG1, PYGL, SERPINA1, SLC25A13, SLC37A4, TALDO1, TJP2, BCS1L, NBAS, SERAC1, TRMU, SCO1, LARS, SMPD1, и GBA) бяха усилени от Ion AmpliSeq ™ Library Kit 2.0 и секвенирани в системата Ion Torrent PGM ™ (Thermo Fisher Scientific, САЩ). Подравняването с референтния геном и търсенето на разлики беше извършено с помощта на сървъра Torrent Suite, плъгин Variant Caller.
Анализ на данни
Statistica (версия 10, StatSoft Inc., САЩ) и RStudio Desktop (версия 1.2.1335, RStudio, САЩ) бяха използвани за статистически анализ. Резултатите се представят, като се използват описателни статистически данни (аритметични средни ± стандартни отклонения, диапазони (минимум-максимум) и квартили, където е подходящо). Използвани са корелационни методи на Pearson и Spearman за корелация на плазмения С-триол и холестерола. Предполага се статистическа значимост за r стойности на двустранно ниво от 5%.
Резултати
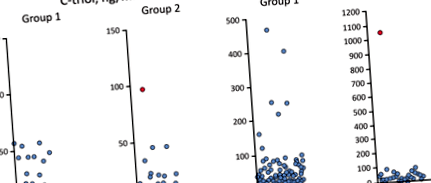
Както се наблюдава в таблица 3, C-триолът е повишен при трима пациенти, а ChT - при седем пациенти от група 1 (един пациент демонстрира както C-triol, така и ChT) (фиг. 1). За група 2 се наблюдава повишен C-триол и ChT при един пациент, който впоследствие е диагностициран с NP-C чрез молекулярно генетично тестване.
Разпределение на концентрацията на С-триол и ChT активността. Бележка под линия: Червената сенчеста точка за данни означава пациент с NP-C
Всички 9 пациенти с повишен плазмен C-триол и/или ChT от група 1 и един от група 2 са анализирани за мутации в NPC1, NPC2 и 47 допълнителни панелни гени за увреждане на черния дроб (вж. по-горе). За 4 (от 10) пациенти са открити клинично значими мутации, включително нови хетерозиготни JAG1 мутация от предполагаем арменски произход (Таблица 3). За пациенти №3 и №10 хетерозиготността на съединението е потвърдена от последователността на предците.
Всички пациенти с повишени нива на ChT показват нормален диапазон на лизозомна киселинна липаза, бета-глюкозидаза и сфингомиелиназа в изсъхнали кръвни петна (данните не са показани). Линейният регресионен анализ показва статистически значима положителна корелация между нивата на холестерола и С-триола в група 1 (r = 0,69, стр 0,05) (фиг. 2). Корелацията между нивата на холестерола и С-триола в група 1 е потвърдена с помощта на непараметричен корелационен тест на Spearman (ρ = 0,586, стр Фиг. 2
Корелационен анализ между нивата на С-триол и холестерола в кръвта. Бележка под линия: Плътните червени линии са регресионните линии с най-малък квадрат; пунктираните червени линии представляват 95% доверителен интервал
Дискусия
С-триолът е окислително производно на холестерола, което потенциално може да бъде повишено поради хиперхолестеролемия с различни етиологии (включително синдром на холестаза).
В предишно проспективно кохортно проучване Polo et al. оценява специфичността на С-триол и 7-КС при новородени с тежка холестаза и съмнение за NP-C [23]. Нивата на двата оксистеролови маркера са значително по-високи при 6/7 пациенти в сравнение със здрави контроли, но генетичната диагноза на NP-C е потвърдена само при 1/6 пациент. Билиарна атрезия е диагностицирана при останалите пет пациенти с високи нива на оксистерол, а един пациент с най-ниските измерени нива на оксистерол е с преходна неонатална холестаза. Не е имало корелация между нивата на оксистерол и директния билирубин сред изследваните субекти. Допълнителна контролна група възрастни с холестатични чернодробни заболявания показва високи нива на оксистерол в 5/15 случая, а нивата значително надвишават нормалните граници в два случая. Заключението беше, че сред новородените с холестаза, при които NP-С не е потвърдено, повишените нива на оксистерол са свързани с оксидативен стрес, свързан с холестазата, но не са специфични за NP-C. Тази хипотеза е в съответствие с по-ранни проучвания, при които нивата на оксистерол са измервани при възрастни с хепатит С вирусна инфекция [29, 30].
В това проучване новородените и кърмачетата от Група 1 показват силна корелация между нивата на С-триол и холестерола. По време на измерването при 9 (11,3%) пациенти със синдром на холестаза са открити фалшиво положителни резултати от измервания на C-триол или ChT (група 1). Във всеки случай такива открития са свързани с вродени и/или наследствени чернодробни заболявания, свързани с холестаза с различна тежест. Увеличение на C-триол и ChT е установено само при едно дете от група 2, при което нивото на холестерола е нормално и впоследствие е диагностицирано с NP-C. Други вродени заболявания са потвърдени при редица други пациенти с повишени нива на тези биомаркери. По този начин комбинираната оценка на плазмените оксистероли и ChT (вероятно заедно с другите биомаркери, като лизосфинголипиди и специфични жлъчни киселини [31]), особено в случаите, когато холестеролът не е повишен, може да служи като полезен скринингов подход за идентифициране на нови NP-C случаи и може да помогне за откриването на кандидати за молекулярно генетични тестове.
Заключение
Както при редица наследствени невродегенеративни заболявания, ранното идентифициране на нови случаи е особено важно при NP-C, тъй като сега съществуват целенасочени терапии, способни да забавят неврологичното влошаване. Комбинираният анализ на ChT активността и нивата на C-триол може да бъде ефективен метод за идентифициране на NP-C, но положителната прогностична стойност в контекста на неонаталната холестаза е ниска. Основното ограничение на нашето проучване е, че само един пациент с диагноза NP-C (в група 2, пациенти с предишна неонатална холестаза).
- Селективна и чувствителна сонда, базирана в нанопорест алуминиев оксид, покрит с олигонуклеотид, за бързо
- Растение въз основа на бюджетно предизвикателство - Семейство от 4 души - Седмица 1 - Растение на база бюджет
- Отслабване на растителна основа, ден 6 - Тина Редър - Истинска храна
- Затлъстяването и диабет тип 2 при младите хора Въпросът е от национално значение AJMC
- Затлъстяването, свързано с почти 6-кратно повишен риск от развитие на диабет тип 2, с генетика и