Inserm U547, Institut Pasteur de Lille, Лил, Франция
Първите двама автори допринесоха еднакво за това изследване
Inserm U547, Institut Pasteur de Lille, Лил, Франция
Катедра по молекулярна поведенческа биология, Институт по биология в Осака, Осака, Япония
Unité Mixte de Recherche (UMR) 8525, CNRS, Биологичен институт в Лил, Лил, Франция
Inserm U547, Institut Pasteur de Lille, Лил, Франция
Медицински факултет, университет в Киото, Киото, Япония
Inserm U547, Institut Pasteur de Lille, Лил, Франция
Катедра по молекулярна поведенческа биология, Институт по биология в Осака, Осака, Япония
Inserm U547, Institut Pasteur de Lille, Лил, Франция
Inserm U547, Institut Pasteur de Lille, Лил, Франция
Inserm U547, Institut Pasteur de Lille, Лил, Франция
Unité INSERM 547, Institut Pasteur, 1 rue du Pr. A. Calmette, F ‐ 59019 Лил, Франция Факс: + 33‐3‐2087‐7888 Търсене на още статии от този автор
Inserm U547, Institut Pasteur de Lille, Лил, Франция
Първите двама автори допринесоха еднакво за това изследване
Inserm U547, Institut Pasteur de Lille, Лил, Франция
Катедра по молекулярна поведенческа биология, Институт по биология в Осака, Осака, Япония
Unité Mixte de Recherche (UMR) 8525, CNRS, Биологичен институт в Лил, Лил, Франция
Inserm U547, Institut Pasteur de Lille, Лил, Франция
Медицински факултет, университет в Киото, Киото, Япония
Inserm U547, Institut Pasteur de Lille, Лил, Франция
Катедра по молекулярна поведенческа биология, Институт по биология в Осака, Осака, Япония
Inserm U547, Institut Pasteur de Lille, Лил, Франция
Inserm U547, Institut Pasteur de Lille, Лил, Франция
Inserm U547, Institut Pasteur de Lille, Лил, Франция
Unité INSERM 547, Institut Pasteur, 1 rue du Pr. A. Calmette, F ‐ 59019 Лил, Франция Факс: + 33‐3‐2087‐7888 Търсене на още статии от този автор
Резюме
Съкращения:
D простаноиден рецептор
Изтичащ лимфен възел
28 ‐ ка GST от S. mansoni
Разтворим шистозомулум Ag
Разтворим възрастен червей Ag
1. Въведение
PGD2, основен метаболит на арахидоновата киселина, има различни физиологични активности при бозайниците като промоция на съня, функция на нервните клетки, освобождаване на хормони, бронхоконстрикция и вазодилатация 1, 2. В допълнение, PGD2 притежава и ефекторни функции по време на възпаление. Например, производството на PGD2 от активирани от алерген мастоцити и евентуално от предизвикани от Ag Th2 лимфоцити участва в алергични реакции, които се развиват в белите дробове 3 - 5. От друга страна, изглежда, че PGD2 посредничи на регулаторните функции по време на възпаление, например чрез регулиране надолу на карагенин-индуциран плеврит и колит при плъхове 6 - 8. Тези биологични роли за PGD2 се осъществяват чрез два рецептора, свързани с G-протеин на плазмената мембрана, D простаноидния рецептор 1 (Gαs протеин, свързан, наречен DP1) 9 и наскоро идентифицираната хемоаттрактантна рецепторна хомоложна молекула, експресирана върху Th2 клетки (CRTH2), еозинофили и базофили (Gαi протеин, свързан, DP2) 10, 11. Заедно с техните функции при възпаление се подозира ролята на DP2 и по-специално на DP1 в резултата от имунния отговор. Всъщност, скорошно проучване предполага, че DP1 благоприятства развитието на локалния Th2 цитокинов отговор в модел на миша хиперреактивност на белите дробове 12 .
2 Резултати
2.1 Sm28GST притежава PGDS активност инвитро
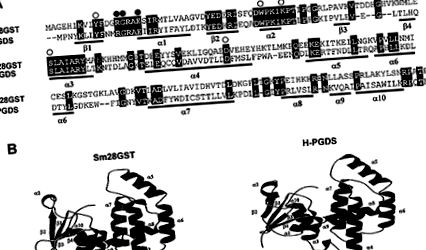
Хомологии между Sm28GST и H-PGDS на плъхове. (А) Сравнение на Sm28GST и аминокиселинни последователности H-PGDS от плъхове. Пропуските са представени с тирета (-). Остатъците, участващи в свързването на GSH и PGD2, са посочени над подравняването съответно с бели и черни кръгове. Показани са вторични структурни елементи (β-нишки и α-спирали). (B) Моделиране с лента на Sm28GST и H-PGDS мономери, генерирани с помощта на комбинация от Molscript и Raster3D 26, 27 .
Специфична активност на PGDS (μmol/min/mg)
2.2 Sm28GST инхибира миграцията на LC от епидермиса към DLN
По време на миша шистозомоза, получените от паразити ейкозаноиди могат да играят важна роля в кожния имунен отговор 15, 28. Имуномаркирането с високо специфичен Ab показва, че Sm28GST се екскретира масово в епидермиса на заразени мишки (фиг. 2А). Това ни подтикна да изследваме ефекта на Sm28GST върху миграцията на епидермален LC. rSm28GST беше инжектиран i.d. 1 час преди TNF-α, молекула, за която е известно, че предизвиква силно напускане на LC от епидермиса 29. Поразително е, че инжектирането на rSm28GST значително намалява (с 44%) индуцираната от TNF-α миграция на епидермален LC, ефект, който не се наблюдава при мутиралия rSm28GST (фиг. 2В). Тези данни категорично показват, че чрез своята PGDS ензимна активност Sm28GST анулира TNF-α-задействаната миграция на LC. За да потвърдим това и да определим количествено броя на емигриращите DC в DLN, използвахме друг модел на LC миграция, предизвикан от локалното приложение на хаптен FITC. След като провери, че в този модел Sm28GST също инхибира LC заминаването (не е показано), броят на заредените с FITC DC в DLN е количествено определен чрез поточна цитометрия. Както се вижда на фиг. 2C, Sm28GST значително предотвратява (с 51%) натрупването на CD11c +/FITC + клетки в DLN на 24 часа след сенсибилизация.
Роля на Sm28GST в инхибирането на LC миграция. (A) Sm28GST имуномаркиране при перкутанно проникване на S. mansoni. Епидермални листове бяха приготвени от S. mansoni‐заразени мишки (1 час след инфекцията) и Sm28GST беше открит чрез имуномаркиране със заешки анти-Sm28GST Ab. Стрелките показват призрака на паразита. Заешки IgG бяха използвани като отрицателна контрола (вложка) (увеличение: × 200). (B) Ефект на rSm28GST върху TNF-α-индуцираната LC миграция. Мишките бяха инжектирани i.d. с 50 μl ензимно активен или мутирал rSm28GST (1 mg/ml) 1 час преди лечение с TNF-α. Един час по-късно ушите бяха премахнати и бяха подготвени епидермални листове, за да се определи броят на LC/mm2 (оцветяване срещу MHC клас II). Резултатите са изразени като средни стойности ± SD и са представителни за три независими експеримента (н= 5). (C) Ефект на Sm28GST върху натрупването на FITC + DC в DLN. Мишките бяха инжектирани i.d. с 50 ng rSm28GST 1 час преди FITC боядисване и броят на CD11c +/FITC + клетки в DLN се определя 24 часа след приложението на FITC.
2.3 Sm28GST засяга LC миграцията чрез активиране на DP1
Тъй като DP1 активирането изглежда важно за контрола на LC подвижността in vivo 15, WT или DP1 KO мишки бяха i.d. инжектиран с rSm28GST преди третиране с TNF-α и беше определена LC плътност (Фиг. 3А). Както се очаква, rSm28GST, и по-специално DP1 агонистът BW245C, инхибира отклоняването на LC от епидермиса при WT мишки. В остър контраст, rSm28GST и BW245C са неефективни при блокиране на LC миграция при мишки DP1 KO. След това оценихме ефекта от дефицита на DP1 върху миграцията на LC по време на инфекция. WT или DP1 KO мишки бяха заразени с S. mansoni и LC плътността беше определена на 6 и 24 часа след инфекцията. Както е показано на фиг. 3В, броят на LC/mm2 в епидермалните листове е значително намален при DP1 KO, но не и при WT мишки, независимо от времето след инфекцията. Като цяло тези резултати показват, че активирането на DP1 от PGD2, получен от паразита, води до инхибиране на LC миграцията по време на S. mansoni инфекция и че този ефект вероятно се дължи на PGDS активността на Sm28GST.
Роля на DP1 в задържането на LC в кожата. (A) Ефект на rSm28GST и BW245C върху TNF-α-индуцираната LC миграция при WT и DP1 KO мишки. Мишките бяха инжектирани i.d. с 50 μl rSm28GST (1 mg/ml) или BW245C (10 μM) 1 час или 15 минути преди третиране с TNF-α, съответно. LC плътността се определя количествено 1 h след третиране с TNFa. (Б) Ефект от S. mansoni инфекция при миграцията на епидермален LC при WT и DP1 KO мишки. LC плътността се определя 6 или 24 часа след инфекцията. Резултатите са изразени като средни стойности ± SD и са представителни за три независими експеримента (н= 5).
2.4 Дефицитът на DP1 засяга имунния отговор по време на инфекция
Анализ на имунния отговор при инфектирани с WT и DP1 KO мишки. (А) Пролиферативен отговор и производство на цитокини на кожни DLN клетки от S. mansoniИнфектирани мишки WT и DP1 KO, 7 дни след заразяването. Кожните DLN се събират и клетките се култивират с различни дози SSA (показано е 5 μg/ml). Производството и пролиферацията на цитокини са измерени съответно след 3 и 4 дни култивиране. Резултатите представляват средната стойност на трикратни култури ± SD (н= 5). Показан е един представителен експеримент от три. (Б) Специфични за SWAP и SEA отговори на изотипа Ab в S. mansoniИнфектирани мишки WT и DP1 KO (49 дни след заразяване). Резултатите се изразяват като IgG1 и IgG2a титри за всяка мишка (н= 7). Показан е един представителен експеримент от три. Статистическата значимост е обозначена със * (стр
2.5 мишки с дефицит на DP1 са частично защитени срещу шистозоми
Контролът на патологията на шистозомиазата включва сложен имунен отговор Th1/Th2, който в дългосрочен план води до развитие на хронифициране, свързано с патологично медииран Th2-предубеден имунен отговор 30. В сравнение със заразените WT мишки, анализът на паразитологичните параметри изненадващо разкрива значително намаляване на тежестта на червеите (32%), както и намален брой яйцеклетки, отложени в тъканите (37%) при заразени DP1 KO мишки (фиг. 5А) . Това показва, че дефицитът на DP1 силно влияе върху оцеляването на паразитите. Поразително е, че изследването на черния дроб и червата показва, че тези органи са по-малко повредени при DP1 KO мишки в сравнение с WT мишки, по-специално червата, които показват силно намалени хеморагични лезии (фиг. 5В). И в двете групи животни обаче размерите на грануломите около яйцата, както и степента на отлагане на колаген в черния дроб не са били статистически модифицирани при DP1 KO мишки (данните не са показани).
Ефект на дефицита на DP1 върху глистовата тежест и върху патологията в S. mansoniЗаразени мишки. (А) Паразитологични параметри при WT и DP1 KO мишки, 49 след инфекция. Резултатите се изразяват като средства ± SD и са представителни за три независими експеримента (н= 7). Посочена е значителна разлика (*стр
3 Дискусия
В обобщение, нашите данни разкриват ключова роля за Sm28GST и за DP1 в инхибирането на миграцията на LC по време на инфекция и демонстрират, че производството на PGD2 благоприятства чрез активиране на DP1 общата патология по време на миши шистозомоза. И накрая, това проучване дава важна представа за ролята на DP1 в регулирането на имунния отговор и при възпалението като цяло.
4 Материали и методи
4.1 Подравняване на аминокиселините и структурни хомологии на Sm28GST и PGDS
Аминокиселинните последователности на Sm28GST и на H-PGDS на плъхове бяха подравнени чрез визуално редактиране въз основа на резултата от програмата за двойно подравняване BestFit (пакет GCG, пакет от Уисконсин) и на структурни характеристики като вторични структури и стойности на двуъгълния гръбнак. Започвайки с подравняването, автоматизираната програма Modeller6 беше използвана за изграждане на триизмерната структура на Sm28GST въз основа на рентгеновата кристалографска структура на PGDS (протеинов код: 1PGD2). Стереохимичното качество на модела беше оценено с програмата Procheck-NMR 39 .
4.2 Приготвяне на рекомбинантния Sm28GST и PGDS ензимен анализ
КДНК с пълна дължина на Sm28GST е субклониран в pET-24d (+) (Novagen) и Е. coli Клетките BL21 (DE3) се трансформират с този експресионен вектор. Пречистването на рекомбинантен Sm28GST (rSm28GST) беше както беше описано по-рано 40. Накратко, rSm28GST се пречиства по афинитет върху GSH конюгирани сефарозни зърна, използвайки 50 mM глицин (pH 10) и след това се диализира в PBS (pH 7.4) плюс 1 mM дитиотреитрол, преминава през колони от полимиксин и се концентрира до 1 mg/ml. Липсата на ендотоксин в препарата се проверява чрез тест на Limulus. Мутацията Tyr към Phe (позиция 10) се генерира в pET ‐ 24d: Sm28GST, като се използва насочен към сайта мутагенезисен комплект Quickchange TM (Stratagene, La Jolla, CA) с праймерите 5′-GGTTATCTTTTTCAACGGACG ‑ 3 ′ и 5 ′ GCGTCCGTTGAAAAAGATAACC ‐ 3 ′ (Life Technologies, Cergy ‑ Pontoise, Франция) и мутацията е потвърдена чрез секвениране на ДНК. RH-PGDS при плъхове се пречиства и активността на PGDS се измерва с rSm28GST или rH-PGDS (50 μg/ml), както е описано по-горе 41. Накратко реакцията започна чрез добавяне на 40 μM [1-14 C] PGH2 и се проведе при 25 ° C за 1 min. Образуването на PG се изчислява от съотношението на радиоактивността във всеки отделен PG към общата радиоактивност след тънкослойна хроматография.
4.3 Подготовка на Ag, мишки и протокол за инфекция
Приготвянето на SSA, SWAP и SEA се извършва, както е описано 42. Млади възрастни мишки WT C57Bl/6 (на възраст 6-8 седмици) са закупени от Iffa Credo (l'Arbesle, Франция). C57BL/6 DP1 KO мишки са получени, както се съобщава по-рано 12. Мишките бяха упоени и изложени на 250 церкарии чрез потапяне на ушите за 25 минути или на 50 церкарии към обръснатата коремна кожа.
4.4 Имунохистохимия и анализ на LC плътност
За имуномаркиране на Sm28GST епидермалните листове се фиксират в 2% PFA, след това се поставят в PBS-3% H2O2 за инхибиране на ендогенна пероксидаза. Листовете се инкубират в продължение на 30 минути в PBS-1% блокиращ реагент (Boehringer) и след това се инкубират в продължение на 2 часа с пречистен заешки афинитет анти-Sm28GST Ab (5 μg/ml) с 1% блокиращ реагент. Добавени са конюгирани с биотин кози анти-заешки Ab (1: 2 000) и са разработени листове с 3-амино 9-етил карбазол и монтирани върху стъклени пързалки в Immunomount за имунохистохимичен анализ. За да се предизвика LC емиграция, мишките се инжектират i.d. в ушите с 50 ng TNF-α (R&D системи, Abingdon, GB) и епидермални листове са анализирани 1 час след инжектирането, за да се определи LC плътност. Накратко, епидермалните листове бяха инкубирани с анти-I-A d/I-E d mAb (клон M5/114, плъх IgG2b), предоставен от д-р А. Ager (NIMR, Лондон, Великобритания) и LC бяха изброени на десет произволни полета чрез преброяване на MHC клас II + клетки на всеки лист. Клетъчната честота беше преобразувана в LC/mm2 и резултатите бяха изразени като средна стойност ± SD. За FITC-индуцирана LC миграция, мишките са сенсибилизирани чрез боядисване на 10 μl от 0,5% разтвор на FITC, приготвен в ацетон/дибутилфталат (1: 1, обем/обем; носител) върху общата повърхност на всяко ухо. В някои случаи се инжектира rSm28GST (50 μg/ml) i.d. 1 час преди лечение с TNF-α или FITC. За да се определи броят на мигриращите FITC + DC в кожния DLN, едноклетъчни суспензии бяха приготвени от аурикуларен LN и DC бяха обогатени чрез центрофугиране с 14,5% (тегл./Об.) Градиент на метризамид. След това DC бяха оцветени с конюгиран с биотин анти-CD11c mAb (PharMingen, Сан Диего, Калифорния), последван от фикоеритрин-стрептавидин. Процентът на CD11c +/FITC + DLN клетки се определя на поточен цитометър FACSCalibur TM (Becton Dickinson). Данните бяха анализирани с помощта на софтуера CellQuest TM.
4.5 Анализ на имунния отговор при S. mansoniЗаразени мишки
4.6 Анализ на паразитологични и патологични параметри
Червената тежест се измерва чрез чернодробна перфузия 49 дни след инфекцията 42. По време на перфузията тънките черва и черният дроб също бяха събрани за измерване на броя на яйцата в тези органи. Тъканите се усвояват в 4% KOH, както е описано по-рано 43. Записите за теглото на органите позволяват изчисляването на общите тъканни яйца на орган. Патологията, свързана с яйцата, беше анализирана в черния дроб на заразени мишки, както е описано 44 .
4.7 Статистически анализ
Статистическата значимост на разликите между експериментални групи е изчислена с помощта на Student т тест.
Благодарности
Благодарим на A. Ager (NIMR, Лондон, Великобритания) за дарението на анти-I-Ad/I-Ed mAb. J. Fontaine е признат за техническа помощ и M. Bracher за критичното четене на ръкописа. Тази работа получи финансова подкрепа от Institut Pasteur de Lille и от Institut National de la Santé et de la Recherche Médicale. М.Х. и В.А. бяха подкрепени от Ministère de l'Education Nationale, de la Recherche et de la Technologie. G. Riveau и F. Trottein са членове на Centre National de la Recherche Scientifique.
- WILEY-VCH
- WILEY-VCH
- WILEY-VCH
- WILEY-VCH
- WILEY-VCH
- Паразитни факти Humaworm
- Самочувствие, състояние на теглото и опит за отслабване по време на младостта. Ролите на секса и
- На звездата на „Pretty Little Liars“ Ашли Бенсън й се казва; с; твърде дебел; за роли - въпреки че тя; s a
- Rho-киназата регулира енергийния баланс чрез насочване към хипоталамусния лептинов рецептор, сигнализиращ към природата
- 350-калорична диета на Шайлин Удли и 5 други актьори, отслабнали за филмови роли