Антителата на париеталните клетки реагират специфично с β субединиците на стомашната Н +/К + АТРаза [2, 3].
Свързани термини:
- Серум (кръв)
- Гастрит
- Атрофичен гастрит
- Автоантитела
- Моноспецифично антитяло
- Автоимунно заболяване
- Бета верига
- Лигавица на стомаха
- Пилор
- Стомашна париетална клетка
Изтеглете като PDF
За тази страница
ПАРИЕТАЛНИ КЛЕТКИ И ИНТРИНЗИЧНИ ФАКТОРНИ АВТОМАТИЧНИ ТЕЛА
BAN-HOCK TOH, ФРАНК АЛДЕРУЧИО, в Автоантитела (Второ издание), 2007
Определение
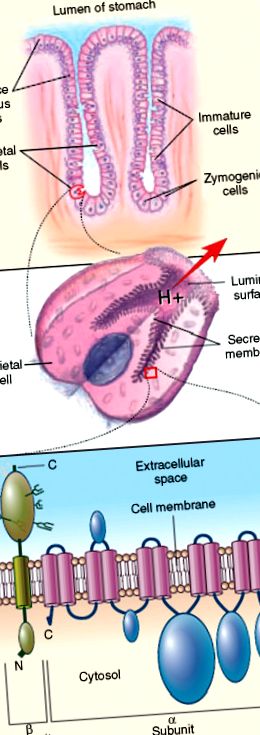
Антителата на париеталните клетки реагират специфично с β субединиците на стомашната Н +/К + АТРаза [2, 3] (виж Фигура 60.1 в раздела Цветни плаки в края на книгата). Реактивността на антителата към α субединицата включва епитоп от цитозолната страна на секреторната мембрана. Реактивността на антителата с β субединицата изисква антигенът да бъде дисулфидно свързан и гликозилиран, което предполага, че автоепитопите са разположени в луминалния домейн на гликопротеина. N-гликаните на β субединицата носят полилактозаминови последователности, позволяващи пречистване на стомашната Н +/К + АТРаза чрез афинитетна хроматография на доктивен лектин.
ФИГУРА 60.1 . Стомашно-клетъчна H/K ATP-аза като молекулна цел при автоимунен гастрит, свързан с пернициозна анемия. Горният панел представлява стомашна жлеза, показваща местоположението на париеталните клетки спрямо зимогенните клетки, незрелите клетки и повърхностните лигави клетки. Средният панел представлява стимулирани стомашни клетки на стомаха, показващи лигавичната мембрана на секреторния канал, върху който е разположена стомашната Н/К АТФаза. Долният панел представлява каталитичните α и гликопротеинови β субединици на стомашната H/K ATP-аза, показващи тяхната ориентация в лигавичната мембрана на секреторния канал на париеталната клетка. N означава N-терминална част, а C С-терминална част.
Инфекция с хеликобактер пилори и стомашен автоимунитет
Фабиола Ачени,. Пиеркарло Сарзи-Путини, в Инфекция и автоимунитет (Второ издание), 2015
8.1 Париетални клетъчни антитела
Целевият антиген на PCA е стомашният ензим H +/K + ATPase, който се състои от каталитична 100-kDa α субединица и 60–90-kDa β субединица. Той е основният протеин на секреторните канали на стомашните париетални клетки и произвежда киселина чрез секреция на H + йони в замяна на K + йони. 15-18 PCA са чести при автоимунен гастрит, особено в ранните стадии на заболяването, и те се свързват както с α, така и с β субединиците на стомашната H +/K + ATP-аза. Реактивността на антителата към α субединицата включва епитопи от цитозолната страна на секреторната мембрана, докато реактивността на антителата към β субединицата изисква антигенът да бъде в дисулфидна връзка и гликозилиран, което предполага, че автоепитопите са разположени в луминалния домейн на гликопротеина . 17, 18 Циркулиращите PCA са изотипи IgG, IgA и IgM, въпреки че изотипите на антителата в стомашните сокове са предимно IgA и IgG. 27 В по-късните стадии на заболяването честотата на PCA намалява поради прогресирането на автоимунния гастрит и загубата на стомашно-париетална клетъчна маса. Въпреки това, PCA не са специфични и може да се открият рядко при пациенти с други автоимунни заболявания като тиреоидит на Хашимото или диабет тип 1. 1
Гастрит и пернициозна анемия
Имунологични диагностични маркери
Две циркулиращи автоантитела, париетални клетъчни антитела, насочени към стомашна Н +/К + АТРаза и автоантитела към вътрешен фактор, обикновено се откриват при пациенти с автоимунен гастрит или с автоимунен гастрит и пернициозна анемия.
ФИГУРА 39.4. Индиректно имунофлуоресцентно оцветяване на стомашни париетални клетки в миши стомах, реактивен със серум от пациент с автоимунен гастрит. × 400.
ТАБЛИЦА 39.2. Честота на стомашните автоантитела при заболявания в автоимунния клъстер в сравнение с контролните популации
| Група заболявания (тестван брой) | |||
| Тиреотоксикоза (302) | 24 | 3.0 | Ървайн (1965) |
| Тиреоидит на Хашимото (120) | NT * | 5.0 | Ървайн (1975) |
| Първичен хипотиреоидизъм (297) | NT | 6.7 | Ървайн (1975) |
| Инсулинозависим захарен диабет | |||
| На възраст Унгар и сътр. (1968) | |||
| Първична болест на Адисън (261) | 31,0 | 8.4 | Ървайн и Барнс (1975) |
| Първична яйчникова недостатъчност (5) | 40,0 | 40,0 | Irvine и сътр. (1968) |
| Първичен хипопаратиреоидизъм (68) | 22,0 | NT | Blizzard et al. (1966) |
| Витилиго (80) | 21,0 | NT | Brostoff et al. (1969) |
| Синдром на Ламбърт – Итън (46) | 26,0 | 11.4 | Lennon et al. (1982) |
| Контрол (тестван номер) | |||
| Хроничен атрофичен гастрит, тип В (непернициозна анемия) (13) | |||
| 0 | 0 | Whittingham et al. (1969) | |
| Язва на дванадесетопръстника (200) | 5.0 | 0 | Ungar et al. (1976) |
| Австралийско население (34 922) | 4.8 | 0 | Hooper et al. (1972) |
| На възраст 21-30 години (551) | 2.2 | NT | |
| На възраст 61-65 години (317) | 6.3 | NT | |
| Австралийски кръводарители (500) | NT | 0 | Ungar et al. (1968) |
| Донори на шотландска кръв, жени на възраст 40-60 години (141) | 9.0 | 0 | Ървайн (1965) |
Автоантитела, Тестове за
Стомашни париетални клетки
Недостиг на витамин В12 при възрастни хора
Злокачествена анемия
Участието на храносмилането в системни автоимунни заболявания
3.1 Хроничен гастрит
Въпреки че по-ранните доклади описват хронично стомашно възпаление с атрофия на лигавицата при почти 80% от пациентите със SS [27–29], разпространението на хроничния гастрит не е оценено в последните проучвания. В клиничната практика пациентите често се оплакват от стомашна болка, въпреки че гастроскопските проучвания често показват само леки стомашни аномалии.
Някои проучвания анализират разпространението и клиничното значение на стомашно-чревните антитела срещу париетални клетки (анти-PCA) в първичната SS. Nardi et al. [30] откриха положителни антитела срещу PCA при 90 (27%) от 335 пациенти. Тези пациенти показват по-високо разпространение на тиреоидит и автоимунно чернодробно засягане, но без стомашно-чревно засягане. El Miedany et al. [31] откриха антитела срещу PCA при една трета от пациентите със СС и контролите. Въпреки това, всички пациенти с SS с антитела срещу PCA са имали Helicobacter pylori инфекция, в сравнение с по-малко от половината от положителните автоантитела контроли. По същия начин само 22% от положителните за автоантитела контроли имат атрофични промени в стомашната лигавица в сравнение с 86% от тези с SS. Това проучване установява тясна връзка между антитела срещу PCA и инфекция с H. pylori, което предполага, че тази бактерия може да индуцира локален хиперреактивен/автоимунен отговор, който може да улесни индуцирането на автоантитела срещу стомашната лигавица на пациенти със SS.
Въпреки че антителата срещу PCA са свързани с хроничен атрофичен гастрит и пернициозна анемия, двата процеса са рядко описани при пациенти с първична SS. Два случая са описани в неотдавнашен преглед на хематологични прояви в кохорта от 380 пациенти с SS [32], като са докладвани само четири допълнителни случая [33–35], което предполага, че хроничният атрофичен гастрит и пернициозната анемия са много редки при първичните SS.
Тиабендазол
Черен дроб
Паренхимно чернодробно увреждане може да възникне при пациенти, приемащи тиабендазол и са документирани анормални чернодробни функционални тестове [10]. Увреждането на жлъчните пътища може да доведе до микронодуларна цироза [11] и различни форми на чернодробно разстройство, включително дуктопения, за които може да се окаже необходима трансплантация на черен дроб [12, 13].
Устойчива холестаза може да се появи при пациенти, приемащи тиабендазол [14].
27-годишен пациент от Суринам с бета-таласемия е приемал тиабендазол 1250 mg дневно в продължение на 2 дни за стронгилоидоза [15]. Една седмица по-късно тя стана иктерична, с повишен общ и конюгиран билирубин, алкална фосфатаза, гама-глутамилтрансфераза и аминотрансферази. Тестовете за антинуклеарни антитела, антитела на париеталните клетки, антитела на гладката мускулатура, митохондриални антитела, хепатит А, В, С, цитомегаловирус, вирус на Епщайн-Бар, паротит и морбили са отрицателни. Ултрасонографията показва нормални интрахепатални и екстрахепатални жлъчни пътища. Биопсията на черния дроб показва интрахепатална холестаза и леко увеличен инфилтрат в порталните области. Една седмица по-късно тя разви генерализиран уртикариален обрив. Тя е имала леко анормални чернодробни изследвания през следващите 7 години, като по това време чернодробна биопсия показва лек лимфен инфилтрат в порталните полета, без признаци на цироза, хроничен хепатит или първична билиарна цироза.
42-годишна жена, също от Суринам, с бета-таласемия и неинсулинозависим захарен диабет, приема тиабендазол 1250 mg дневно в продължение на 2 дни за стронгилоидоза [13]. Пет седмици по-късно тя развива общо неразположение, анорексия, загуба на тегло, иктер и нежен черен дроб. Беше повишила общия и директен билирубин, гама-глутамилтрансфераза и алкална фосфатаза, но само незначително повишени трансаминази. Тестовете за хепатит А, В и С, цитомегаловирус и шистосомоза са отрицателни. Тестовете за антинуклеарни антитела и антитела срещу чернодробните клетъчни мембрани, гладката мускулатура и митохондриите са отрицателни, но има антитела от париетални клетки. Ултрасонографията и ERCP показват нормални интрахепатални и екстрахепатални жлъчни пътища. Биопсията на черния дроб показа тежка централно локализирана холестаза. Година по-късно всички клинични и лабораторни отклонения бяха изчезнали.
С оглед на тези и предишни случаи на тежка холестаза след тиабендазол и наличието на по-малко токсични еднакво ефективни лекарства (албендазол или за предпочитане ивермектин), тиабендазолът трябва да се счита за остарял при лечението на стронгилоидоза.
Анемия, пагубна
Животински модели на автоимунен гастрит
Спонтанно възникващ автоимунен гастрит
Няма животински модел, при който основното заболяване да е автоимунен гастрит, въпреки че атипични форми на автоимунен гастрит са налице при част от животните, чието първично автоимунно заболяване е едно от заболяванията, свързани с автоимунен гастрит. Например BB/W плъхове, чието основно заболяване е инсулинозависим захарен диабет, могат да имат стомашно-париетални клетъчни антитела и хистологични данни за лек до умерен гастрит. Те обаче не намаляват секрецията на киселина или намаляват нивото на витамин В12. Друг пример, моделът на затлъстелите щамове на тиреоидит на Хашимото може също да има антитела към стомашните париетални клетки, но пилето предоставя лош модел на човешкия гастрит.
Експериментално индуциран автоимунен гастрит
Опитите за разработване на модели на автоимунен гастрит при резус маймуни, кучета и плъхове чрез инжектиране на стомашна лигавица с имунологични адюванти са постигнали само частичен успех и когато се предизвика възпалителен гастрит, той не продължава и прогресира като човешкото заболяване. Моделът, който най-добре отразява човешката болест, е този, който се развива при мишки BALB/c след четири инжекции миши H +, K + -ATPase, емулгирани в пълния адювант на Freund. Въпреки че лезията е обратима след прекратяване на имунизацията, отговорът на имунизацията е флориден гастрит с разрушаване на теменните и главните клетки и развитие на GPCA. Алтернативен модел при мишка BALB/c е гастритът, който следва тимектомия, извършена в рамките на 2–4 дни след раждането на мишка BALB/c или тимектомия и еднократна доза циклофосфамид при възрастна мишка. Два критерия са важни при разработването на тези тимектомизирани модели. Единият е времето на тимектомия при новороденото, което трябва да се извърши в рамките на 2–4 дни след раждането, а второто е необходимостта от комбинирано лечение при възрастен, тъй като нито тимектомията самостоятелно, нито само циклофосфамидът ще доведат до гастрит.
Анализът на клетките в ранната стомашна лезия в моделите BALB/c показва, че преобладават В клетки, CD4 Т клетки и макрофаги. Прехвърлянето на далачни лимфоцити от засегнатите животни към имунокомпрометирани миши гостоприемници води до автоимунен гастрит в гостоприемниците, като клетката, отговорна за прехвърлянето, е CD4 Т-клетката и неговата мишена е β-субединицата на стомашната H +, K + -ATPase.
Жена с периферна невропатия и чести падания
Д-р Тулио Е. Берторини, Невромускулни казуси, 2008 г.
КАКВО ЩЕ НАПРАВИШ НАПРЕД?
Въпреки че нормалният B12 на пациента беше против диагнозата пернициозна анемия (PA), високият MCV предизвика измерването на нивата на хомоцистеин и метилмалонова киселина. Хомоцистеинът е 29,5 μM/L (нормално, титрите на париеталните клетки са 54 (нормални,
Направен е тест на Шилинг и екскрецията на кобаламин в етап 1 е 0 (норма,> 10%). Етап 2 показва екскреция само на 1% от приложената доза, което също показва необичайна чревна абсорбция на В12 от продължителен дефицит на кобаламин, причинен от хронична БА. Това може да се случи при няколко условия (Таблица 46-1), докато някои други могат да причинят подвеждащи нива (Таблица 46-2). Най-вероятно тя е имала ПА и принадлежи към групата пациенти, които имат нормално ниво на В12 при стандартни тестове. Съобщава се, че около 5% до 10% от пациентите с БА имат нива между 200 и 300, а по-малко от 1% могат да имат нива над 300. 3
Синдром на твърдо лице и варианти
Разследване
Каре 3 съдържа списък на потенциалните диференциални диагнози на SPS и неговите варианти, повечето от които могат да бъдат изключени или чрез задълбочена анамнеза и изследване, или чрез рутинни лабораторни или радиологични изследвания. Ако се подозира SPS, серумът трябва да бъде изследван за антитела срещу GAD (по-специално антитела срещу GAD65), антитела срещу GABARAP (ако са налични) и паранеопластични антитела (анти-Ri, анти-амфифизин, анти-гефирин) и други тъканно специфични авто-антитела (напр. антигастриални антитела на париеталните клетки, антитиреоидни микрозомни антитела). Титрите на серумни анти-GAD65 антитела обикновено са високи (> 20 nmol l -1). Електромиографията трябва да демонстрира данни за CMUA в поне един аксиален мускул (вж Фигура 1 ), с нормална морфология на двигателната единица (вж Фигура 4 ), който отзвучава с интравенозни бензодиазепини и абнормни екстероцептивни рефлекси (вж. Каре 2 ). CSF е ненормален при до 60% от класическия SPS (или протеин> 0,6 g l -1 и/или WBC> 5 и/или олигоклонални ленти (OCB) и/или CSF анти-GAD антитела). Магнитно-резонансното изобразяване на невраксиса е нормално при SPS.
Фигура 1 . (а) Неректифицирана ЕМГ, записана с игленен електрод от лумбален параспинален мускул при пациент със SPS, показващ непрекъсната активност на двигателната единица (CMUA) в покой. Записите са правени, докато пациентът лежи легнал и неподвижен на диван за преглед. Стрелката показва времето, в което е бил доставен слухов стимул. Обърнете внимание, че фоновата честота на стрелба на многоединичния запис се увеличава след слуховия стимул и остава повишена (времевата база е 20 s на деление и амплитудата е 2 mV на деление). (b) Същият запис, както е илюстриран в (а), но се показва на разширена времева база (10 s на разделение).
Фигура 4. Усреднени потенциали за действие на двигател, генерирани с помощта на програмата Multimap ™, от записа, илюстриран в Фигура 1 . Обърнете внимание на нормалната продължителност, амплитуда и форма на осреднените потенциали на двигател (времева база 50 ms и амплитуда 2 mV, както е показано с хоризонтални и вертикални ленти).
| Диагностични характеристики | Бележки |
| CMUA | В поне един аксиален мускул (вж Фигура 1 ) |
| Кутаномускулни (екстероцептивни) рефлекси | Широко разпространени, непривикващи, нископрагови реакции на стимулация на тибиалния нерв, с едновременно съкращение на антагонисти |
| Допълнителни функции | |
| Непривикващ акустичен рефлекс | ЕМГ, записана от аксиални и мускули на краката |
| Повишена възбудимост на кората | Периодът на безшумност намалява с 20% в сравнение с контролите, увеличава ICF и намалява SICI и LICI |
| Спазматичен рефлекс (проприоспинален) миоклонус | Последователност от 1–3 синхронни миоклонични EMG изблици в мускулите на багажника 60–70 ms след стимулация на медианния нерв |
| Мигащ рефлекс | R2 EMG компонентът на мигащия рефлекс не потиска след стимулиране на стимула, докато в контролите R2 компонентът потиска до 1 s |
| Рефлекс за прибиране на главата | Стимулирането на тригеминалния нерв предизвиква 12,5–20 ms отговор и 44–70 ms отговор при трапец, който не привиква |
Ако паранеопластичните антитела или туморните маркери са положителни (или обратно, ако авто-антителата, анти-GAD65 и паранеопластичните антитела са отрицателни), следващите изследвания трябва да включват КТ на гърдите, корема и таза, мамография и PET, тъй като лечението на свързано злокачествено заболяване може или стабилизира или обръща характеристиките на SPS. При PERM рискът от основно злокачествено заболяване е ∼20% и следователно всички пациенти трябва да бъдат изследвани, независимо от серологията.
- Skin Turgor - общ преглед на ScienceDirect теми
- РНК свързващ протеин FUS - общ преглед на ScienceDirect теми
- Protein Sparing - общ преглед на ScienceDirect теми
- Непоносимост към протеини - общ преглед на ScienceDirect теми
- Плесени (гъби) - общ преглед на ScienceDirect теми