Нил Шах
Болница „Свети Франциск“, The Heart Center ®, Център за усъвършенствана сърдечна терапия, Рослин, Ню Йорк, САЩ
Раф Мадание
Болница „Свети Франциск“, The Heart Center ®, Център за усъвършенствана сърдечна терапия, Рослин, Ню Йорк, САЩ
Мехмет Алкан
Университет Браун, Колеж за изкуства и науки, Провидънс, РИ, САЩ
Мохамед У. Догар
Болница „Свети Франциск“, The Heart Center ®, Център за усъвършенствана сърдечна терапия, Рослин, Ню Йорк, САЩ
Константин Е. Косма
Училище по медицина Icahn, болничен център Mount Sinai, Ню Йорк, Ню Йорк, САЩ
Тимъти Дж. Виторио
Болница Сейнт Франсис, The Heart Center ®, Център за усъвършенствана сърдечна терапия, булевард 100 Порт Вашингтон, Рослин, Ню Йорк 11576-1348, САЩ
Резюме
Хроничната застойна сърдечна недостатъчност (CHF) е сложно разстройство, характеризиращо се с неспособност на сърцето да отговори на изискванията към него, последвано от прогресивна недостатъчност на помпата и натрупване на течности. Въпреки че бримковите диуретици се използват широко при пациенти със сърдечна недостатъчност (СН), се смята, че както фармакодинамичните, така и фармакокинетичните изменения са отговорни за диуретичната резистентност при тези пациенти. Стратегиите за преодоляване на диуретичната резистентност включват ограничаване на приема на натрий, промени в дозата на диуретици и начин на приложение и последователна терапия с нефрон диуретик. В този преглед обсъждаме определението, разпространението, механизма на развитие и стратегиите за управление на диуретичната резистентност при пациенти със СН.
Въведение
Примковите диуретици често се използват при много пациенти с хронична застойна сърдечна недостатъчност (СНС) поради тяхната безспорна ефикасност при облекчаване на конгестивните симптоми. С прости думи, диуретичната резистентност при пациенти със сърдечна недостатъчност (СН) може да се обясни като неуспех на диуретиците да контролират задържането на сол и вода, дори когато се използват в подходящи дози. 1 Това може да се случи поради намаляване на бъбречната функция, което води до фармакокинетични аномалии като намаляване или забавяне на пиковите концентрации на бримкови диуретици в бъбречната тубулна течност. 1 Това обаче може да се случи и при липса на такива фармакокинетични аномалии.
Определение и разпространение на диуретичната резистентност
Терминът „диуретична резистентност“ остава неадекватно дефиниран въпреки нарастващата честота. Тя може просто да бъде дефинирана като загуба на отговор или намаляване на отговора на диуретици на веригата. 2 Може да се развие при всеки трети пациент със СН. 3 По принцип неуспехът да се намали обемът на извънклетъчната течност, въпреки използването на диуретици по подходящ начин, може да се нарече „диуретична резистентност“. По-точно, диуретичната резистентност може да се изрази като фракционна екскреция на натрий (FENa +) от 4
Epstein и негови колеги проведоха проучване, за да очертаят ефикасността на режима на метолазон-фуроземид при пациенти с диуретичен рефрактерен оток. 5 Изследователите са изследвали 24 пациенти, които първоначално се считат за неподатливи на големи дози конвенционални контурни диуретици през период от 18 месеца. Сред тези 24 пациенти се предполага, че 8 имат рефрактерен оток и по този начин са влезли в проучването. В един от критериите за изследване те споменават диуретичната резистентност като невъзможност за екскреция на натрий (най-малко 90 mmol) в рамките на 72 часа след даване на перорален фуроземид (160 mg) два пъти дневно. 5 Само трима от осемте пациенти, които са участвали в проучването, отговарят на критериите за изследване за диуретичен рефрактерен оток.
Диуретичната резистентност се среща по-рядко при пациенти с лека ХСН и запазена бъбречна функция, в сравнение с пациенти с умерена и тежка ХСН. 6,7 Междувременно в друго проучване се съобщава, че 38% от пациентите с ХСН имат бъбречно увреждане и по този начин те са изложени на повишен риск от развитие на диуретична резистентност. 8 Няколко проучвания показват, че СН често се придружава от намаляване на очакваната скорост на гломерулна филтрация (eGFR) и разпространението на умерено до тежко бъбречно увреждане е приблизително 30–60% при пациенти с СН. 9–13 Базата данни на Националния регистър за остра декомпенсирана сърдечна недостатъчност (ADHERE) отчита данни за над 100 000 пациенти с СН, изискващи хоспитализация и приблизително 30% от тези пациенти са имали диагноза хронично бъбречно заболяване, докато само 9% са имали нормален eGFR. 10,11
Механизми на диуретична резистентност при сърдечна недостатъчност
Има няколко теории, които могат да обяснят механизма на развитие на диуретична резистентност. Няколко физиологични промени в CHF могат да доведат до промени във фармакокинетиката на лекарствата, като промени в абсорбцията, разпределението, метаболизма и елиминирането на контурните диуретици. Въпреки това, диуретичната резистентност при пациенти със СНС не може да бъде напълно обяснена само с тези фармакокинетични промени, защото ако само промени във фармакокинетиката са отговорни, тогава диуретичната резистентност трябва да бъде преодоляна чрез увеличаване на дозата или промяна на начина на приложение. 3 Вместо това, диуретичната резистентност може да се обясни по-добре с паралелни промени във фармакодинамиката на лекарствата и фармакокинетиката, засягащи времето на доставката на лекарството. 14 В сравнение със здрави доброволци, пациентите с СНС имат намалена скорост на абсорбция на лекарството, което води до забавяне на времето за постигане на прагова доза, с последващо развитие на диуретична резистентност. 15,16 Бионаличността на диуретиците обаче остава непроменена, поради което тези промени могат да бъдат обяснени по-добре с наличието на стомашно-чревен оток при пациенти с активна СН. 17
Обикновено фуроземидът достига до тръбната течност чрез секрецията си от органичния анионен транспортер, разположен в проксималния канал. 18 При пациенти с ХСН бъбречната недостатъчност води до диуретична резистентност поради недостатъчна интратубуларна концентрация на диуретици, което може да се обясни с намален бъбречен кръвоток и нарушена секреция от проксималната извита тубула (РСТ). 17,19 Секрецията на бримкови диуретици е намалена поради натрупването на ендогенни органични аниони, които се конкурират с бримкови диуретици за свързване на рецепторното място на органичен анионен транспортер. 20 Това конкурентно инхибиране може да бъде преодоляно чрез увеличаване на дозата на бримкови диуретици и това обяснява необходимостта от по-високи диуретични контурни дози за постигане на терапевтична концентрация в урината при пациенти с CHF с бъбречно увреждане.
Друга важна теория зад диуретичната резистентност са взаимодействията лекарство-лекарство, като нестероидни противовъзпалителни средства (НСПВС), които могат да повлияят на диуретичното действие, като инхибират простагландините и по този начин намаляват бъбречната перфузия. 17,21 –23 При тежка СН, простагландините са жизненоважни за поддържане на бъбречната перфузия и за насърчаване на екскрецията на натрий и вода. Следователно инхибирането на простагландини с аспирин или други НСПВС може в крайна сметка да отслаби диуретичната ефикасност чрез инхибиране на екскрецията на натрий и вода. 23 Съобщава се, че след прекратяване на приема на 100 mg аспирин при пациенти с терминална, интравенозна (IV) катехоламин-зависима СН, има значително подобрение, стабилизиране и намаляване на хипонатриемията с впечатляващо намаляване на диуретичните нужди. 24 В животински модел е показано, че приложението на простагландин Е2 при лекувани с индометацин плъхове възстановява натриуретичния отговор на фуроземид и по този начин моделът благоприятства факта, че използването на НСПВС е една от основните причини за очевидна диуретична резистентност. 25
Като цяло, острото приложение на бримкови диуретици при здрави пациенти може да предизвика рефлекторно активиране на системата ренин-ангиотензин-алдостерон (RAAS), което допълнително увеличава задържането на натрий и вода и по този начин намалява диуретичния ефект. 26 Това не трябва да се забелязва при тежка ХСН, тъй като такива пациенти вече имат активиран RAAS и по този начин контурните диуретици не могат допълнително да активират RAAS или да увеличат освобождаването на неврохормони. 3 Освен това повечето пациенти с ХСН получават RAAS инхибитори, така че това трябва да противодейства на по-нататъшното активиране на RAAS след остро прилагане на диуретици. 27 Haller и колеги съобщават за случай на 29-годишен пациент с разширена кардиомиопатия, рефрактерна на високи дози фуроземид, и стигат до заключението, че диуретичната резистентност се дължи на комбинацията от сърдечна недостатъчност на помпата, диетична недискретност и хипералдостеронизъм. 28 Поради това не е необичайно пациент със СНС да има множество механизми, отговорни за развитието на диуретична резистентност.
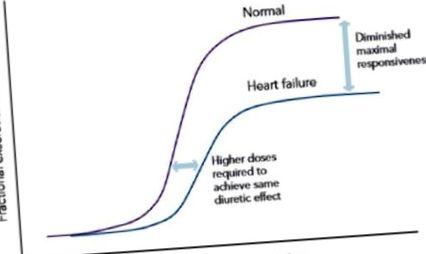
Високият прием на натрий може да прикрие диуретичните ефекти и по този начин може да създаде трудности на клинициста при определяне на диуретичната резистентност. Несъответствието с диетите не е действителна форма на диуретична резистентност, но може да доведе до диуретична недостатъчност. При пациенти с диетична несъобразителност, диуретиците с цикъл водят до изразена натриуреза първоначално, но това може да бъде последвано от запалена реабсорбция на натрий след диуреза, като по този начин причинява диуретична недостатъчност. 29 пациенти с CHF обикновено са подложени на дългосрочно лечение с диуретици, което може да бъде свързано с фармакологични промени в нефрона, което води до влошен отговор на приема на натрий. 3 Данни от пациенти с хипертония и експериментални проучвания върху животни показват, че хроничното инхибиране на реабсорбцията на натрий в контура на Henle поради хронично приложение на контурни диуретици, води до доставяне на натрий в по-големи количества в ранната дистална извита тубула (DCT) клетъчна хипертрофия и по този начин увеличена реабсорбция на натрий, което в крайна сметка доведе до намалена натриуреза с изместване на кривата доза-отговор надолу и надясно (виж фигура 1). Този намален натриуретичен ефект поради хроничното приложение на бримкови диуретици е известен като „феномен на спиране“. 18,26,30 –32
Крива доза-отговор при пациенти с ХСН на диуретици с хронична верига.
Управление на диуретичната резистентност
Несъответствие
Първата стъпка, която трябва да се предприеме, когато се срещне диуретична резистентност, е да се изключи несъответствие нито с приема на лекарства, нито с ограничението на натрий (приемът на натрий трябва да бъде 1 Както е обсъдено по-горе, когато приемът на натрий надвишава 100 mmol/ден, загубата на натрий чрез диуреза може да бъде напълно компенсирана от постдиуретично запалено задържане на натрий.34 Приемът на натрий обикновено се оценява чрез измерване на екскрецията на натрий в урина за 24 часа в стационарно състояние. Междувременно, спазването на лекарството (диуретик) може да бъде оценено чрез измерване на количеството диуретик, екскретирано с урината, въпреки че тази оценка би се оказала полезна само в много малко случаи.
Регулиране на дозата
Както е показано на Фигура 1, концентрациите на лекарства в урината, необходими за постигане на адекватна диуреза при здрави индивиди, може да не са в състояние да постигнат очакваната диуреза при пациенти със СНС. Това означава, че често се изисква да се увеличи контурната диуретична доза, дори без никакви отклонения във фармакокинетиката на лекарството. Буметанидът и торсемидът имат по-добра бионаличност от фуроземид и поради това някои лекари ги смятат за по-ефективни от фуроземид при пациенти със СНС. 1 По принцип бионаличността на фуроземид показва значителна вариабилност между пациентите/пациентите и варира от 10–100%. 37 За разлика от тях, биметанидът и торсемидът имат бионаличност съответно 80% и 80-100%. 15 Както фуроземидът, така и буметанидът бяха установени еднакво ефективни, когато се прилагат еквипотентни дози, въпреки че буметанидът е 40 пъти по-мощен от фуроземид на база тегло. 38,39
IV болусна инжекция или непрекъсната инфузия на бримков диуретик
Непрекъснатото IV вливане на бримков диуретик може да се окаже ефективно, когато други стратегии за управление на диуретичната резистентност са неуспешни. 1 Установено е, че е безопасна и ефективна терапия при пациенти със СНС, които не са устойчиви на перорално лечение с високи дози, както и на IV диуретична терапия, а също така предотвратява задържането на постдиуретична сол изцяло. 1 Няколко проучвания сравняват ефикасността на непрекъснатата инфузия с интермитентно IV болусно приложение на бримков диуретик при пациенти с напреднала СН. 45–47 Дозата на фуроземид за продължителни инфузии варира от 3–200 mg/h, като повечето пациенти получават 10–20 mg/h, докато буметанид се прилага като болус от 0,5 mg, последван от непрекъсната инфузия с 0,5 mg/h. Съобщава се, че подобната дневна доза бримкови диуретици, когато се прилага като непрекъсната инфузия, причинява отделяне на по-големи количества урина и електролити. Освен това рискът от ототоксичност е нисък, тъй като максималната плазмена концентрация на фуроземид е значително по-ниска. 45 –48
Комбинирана диуретична терапия (последователна нефронова блокада)
Много тиазидоподобни диуретици са изследвани за комбинирана терапия с бримкови диуретици. Всички комбинации са показали сходни резултати като цяло и по този начин можем да кажем, че никой подобен на тиазид диуретик не е по-добър от друг. При пациенти с напреднала бъбречна недостатъчност метолазонът се счита за превъзхождащ другите тиазид-подобни диуретици, но други тиазид-подобни диуретици също подобряват отговора на диуретици с контур при подобен тип пациенти. Неотдавнашно малко ретроспективно едноцентрово кохортно проучване, при сравнение на двата най-често използвани тиазидоподобни диуретици, а именно перорален метолазон и IV хлоротиазид като добавка към контурните диуретици, не откри статистически значими разлики в безопасността или ефикасността. 55
Спиронолактон е минералокортикоиден антагонист и калий-съхраняващ диуретик. Той действа главно чрез конкурентно свързване към зависимите от алдостерон места за обмен на натрий-калий, разположени в DCT и събирателен канал. Малко проучване съобщава за успешен отговор на въвеждането на спиронолактон при 13 от 16 пациенти с СН, резистентни на диуретик с висока доза. 56 Въпреки това, един пациент е развил обратима хиперкалиемия и азотемия поради дехидратация, но заслужава да се спомене, че използваната доза от спиронолактон (100 mg/ден) в проучването е много по-висока от средната доза (25 mg/ден), която води до оцеляване полза в проучването RALES. 57 Препоръчително е да се следи състоянието на хидратация и серумните нива на калий, когато се прилага тази висока доза. Тази висока доза трябва да бъде последвана от поддържаща доза от 25 mg, след като цялата излишна течност бъде отстранена. 1 Използването на спиронолактон за лечение на диуретична резистентност при пациенти със СНС обикновено не се препоръчва, тъй като доказателствата в полза на спиронолактон са ограничени. 1
Заключение
Претоварването с течности, устойчиво на диуретична терапия с конвенционални дози, е често срещан проблем при пациенти с ХСН. От горната дискусия заключаваме, че високото разпространение на бъбречно увреждане при пациенти със СНС е свързано с по-висок риск от диуретична резистентност. В допълнение към бъбречното увреждане, лошата диуретична абсорбция, лекарствено-лекарствените взаимодействия, хроничното приложение на диуретици и високият прием на натрий са други потенциални фактори зад развитието на диуретична резистентност при СН. Диуретичната резистентност може да бъде преодоляна, като се управлява поетапно, като например да се изключи несъответствие с лекарството, да се увеличи дозата на диуретика, да се промени начинът на приложение от орално на IV и накрая да се използва комбинирана диуретична терапия. Този поетапен подход при лечението на диуретична резистентност може да доведе до по-бързо облекчаване на симптомите и потенциално до намаляване на продължителността на престоя при пациенти, хоспитализирани за декомпенсирана СН. След като диуретичната резистентност бъде лекувана успешно, лечението на ХСН трябва да бъде оптимизирано, за да се намали допълнителната заболеваемост и смъртност.
Благодарности
Тимоти Дж. Виторио замисля с идея за това произведение и одобрява окончателния ръкопис; Нийл Шах беше отговорен за прегледа на литературите и изследванията, изготвянето на очертанията и основния ръкопис, както и редактирането на основния ръкопис; Raef Madanieh, Mehmet Alkan, Muhammad U. Dogar и Constantine E. Kosmas бяха отговорни за критичния преглед на ръкописа за интелектуално съдържание, прегледа на литературите и редактирането на основния ръкопис.
Бележки под линия
Финансиране: Това изследване не е получило конкретна безвъзмездна помощ от която и да е агенция за финансиране в публичния, търговския или нестопанския сектор.
Изявление за конфликт на интереси: Авторите заявяват, че няма конфликт на интереси.
Информация за сътрудника
Niel Shah, болница Сейнт Франсис, The Heart Center ®, Център за усъвършенствана сърдечна терапия, Рослин, Ню Йорк, САЩ.
Raef Madanieh, болница Сейнт Франсис, The Heart Center ®, Център за усъвършенствана сърдечна терапия, Рослин, Ню Йорк, САЩ.
Мехмет Алкан, Университет Браун, Колеж за изкуства и науки, Провидънс, РИ, САЩ.
Мохамад У. Догар, болница "Сейнт Франсис", Сърдечен център ®, Център за модерна сърдечна терапия, Рослин, Ню Йорк, САЩ.
Константин Е. Космас, Медицинско училище Icahn, болничен център Mount Sinai, Ню Йорк, Ню Йорк, САЩ.
Тимъти Дж. Виторио, болница „Сейнт Франсис“, The Heart Center ®, Център за усъвършенствана сърдечна терапия, 100 Port Washington Boulevard, Roslyn, NY 11576-1348, САЩ.
- 7 сърдечни ползи от упражненията Johns Hopkins Medicine
- 10 най-добри упражнения за съпротивителни ленти за силни, тонизирани крака през 2020 г.
- 7 впечатляващи предимства на семената от кориандър укрепват здравето на сърцето, лекуват диабет и др
- 7 Упражнения за съпротивителна лента за изгаряне на мазнини и изграждане на мускули
- 7 чая, които могат да помогнат или да навредят на вашето сърце за ежедневието