Мартин Пур
1 Експериментална урология, Катедра по урология, Медицински университет в Инсбрук, Инсбрук, Австрия
Джулия Хуфер
1 Експериментална урология, Катедра по урология, Медицински университет в Инсбрук, Инсбрук, Австрия
Ханес Нойвирт
2 Катедра по вътрешни болести IV (Нефрология и хипертония), Медицински университет в Инсбрук, Инсбрук, Австрия
Ирис Е. Едер
1 Експериментална урология, Катедра по урология, Медицински университет в Инсбрук, Инсбрук, Австрия
Йохан Керн
3 Онкотиролова лаборатория за туморна биология и ангиогенеза, Инсбрук, Австрия
Георг Шефер
1 Експериментална урология, Катедра по урология, Медицински университет в Инсбрук, Инсбрук, Австрия
Стефан Гейли
4 Отдел по молекулярна патофизиология, Инсбрук Биоцентър, Медицински университет в Инсбрук, Инсбрук, Австрия
Изабел Хайдегер
1 Експериментална урология, Катедра по урология, Медицински университет в Инсбрук, Инсбрук, Австрия
Хелмут Клокър
1 Експериментална урология, Катедра по урология, Медицински университет в Инсбрук, Инсбрук, Австрия
Зоран Кулиг
1 Експериментална урология, Катедра по урология, Медицински университет в Инсбрук, Инсбрук, Австрия
Свързани данни
Резюме
ВЪВЕДЕНИЕ
За лечение на резистентен на кастрация рак на простатата (CRPC) през последните години е разработена системна химиотерапия [1–3]. Химиотерапевтичното лекарство доцетаксел (Taxotere®) се дава на пациенти след неуспех на терапията с андрогенна депривация (ADT) въз основа на подобрена обща преживяемост, намаляване на болката, специфичен за простатата антигенен отговор и качество на живот [3]. Въпреки това, в много случаи приложението му е ограничено поради появата на присъща или придобита резистентност на доцетаксел [4]. Ползата за преживяемост при пациентите с CRPC е умерена само след няколко месеца [5].
Известно е, че протеиновите инхибитори на активиран сигнален преобразувател и активатор на транскрипционни (STAT) фактори (PIAS) протеини, които включват семейство от 4 мултифункционални членове, наречени PIAS1 до 4, играят роля в модулацията на цитокиновата сигнализация чрез инхибиране на активността на STATs [23–25]. PIAS1 и PIAS3 са особено индуцирани от интерлевкин-6 (IL-6), за който вече се съобщава, че оказва влияние върху резистентността към химиотерапия [26, 27]. Освен способността за свързване на ДНК и протеини, която се медиира от запазения SAP домейн, PIAS протеините съдържат и пръстен-подобен на цинк свързващ домейн (RLD), както и мотив за взаимодействие SUMO (SIM), като по този начин функционират като SUMO-E3 лигази. Наскоро беше демонстрирано, че опосредстваното от PIAS1 SUMOylation е от съществено значение за възстановяването на ДНК [28, 29]. Освен това, PIAS1 е важен регулатор на клетъчния цикъл, който насърчава клетъчната пролиферация чрез задействано от SUMOylation инхибиране на p73 и p53 [30–32]. Тъй като силно пролиферативното поведение и потискането на апоптотичните стимули са основните характерни черти на резистентни на доцетаксел клетки, гореспоменатите наблюдения правят PIAS1 интересен целеви протеин за по-нататъшно изследване.
За да отговорим на въпроса дали насочването към PIAS1 може да се използва за подобрена терапия с PCa, ние анализирахме експресията на PIAS1 при първични тумори от всички етапи, при метастатични лезии, в тъкан на пациенти след химиотерапия с доцетаксел и в резистентни на доцетаксел клетъчни линии. Нашите данни за пациентите бяха допълнени от функционални експерименти след преходен и стабилен нокдаун на PIAS1 in vitro, както и от анализи на пилешки хориоалантоисни мембрани (CAM) и експерименти с миши ксенографт in vivo.
В това проучване ние потвърждаваме повишена експресия на PIAS1 в PCa и демонстрираме за първи път, че PIAS1 освен това е значително индуциран след лечение с доцетаксел при пациенти, както и в резистентни на доцетаксел клетки in vitro. Освен това, нокдаунът PIAS1 води до повишена експресия на инхибитора на клетъчния цикъл p21 и до намалени нива на Mcl1, като по този начин води до индуцирана апоптоза на родителски и доцетакселоустойчиви туморни клетки.
РЕЗУЛТАТИ
Експресията на PIAS1 е повишена при първични тумори, при метастатични лезии и при пациенти с PCa след химиотерапия с доцетаксел
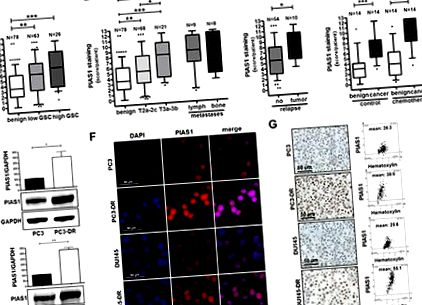
Експресията на PIAS1 се анализира в проби от PCa тъкан чрез имунохистохимия. Показан е статистически анализ за експресия на PIAS1 в 78 доброкачествени и 89 туморни проби от проби с радикална простатектомия (A – C), както и при 17 метастатични лезии (Б), и в проби от доброкачествени и туморни тъкани от 14 пациенти, получили химиотерапия преди радикална простатектомия, в сравнение с 14 съвпадащи контролни пациенти без предварителна химиотерапия (Д). Графиките на Box-Whiskers представляват средни стойности, 10–90 процентили (*, p (Фиг. 1E). 1E). Имунофлуоресценцията и имунохистохимичното оцветяване потвърждават резултатите от Western blot (Фиг. 1F, G). Регулирането на PIAS1 в клетките, третирани с доцетаксел, изглежда е ограничено до развитието на резистентност. Краткосрочното лечение на нерезистентни клетки с доцетаксел предизвика инхибиторен ефект върху експресията на PIAS1 (допълнителна фигура S2A). Като се има предвид, че самият PIAS1 може да се регулира чрез прогресия на клетъчния цикъл [31], наблюдаваният ефект може да се дължи на пролиферативното спиране на родителските клетки в отговор на медикаментозно лечение. Повишаването на регулацията на PIAS1 в резистентни клетки следователно е дългосрочен ефект. Следователно, ние наблюдавахме повишени нива на NFκB-p100 и двама членове на семейството STAT, а именно STAT3 и STAT5 (допълнителна фигура S2B) в DU145, устойчиви на доцетаксел, в сравнение с техните родителски колеги, сочейки и към превключване в STAT сигнализация. Взети заедно, заключаваме от тези констатации, че i) PIAS1 е свръхекспресиран в локален и метастатичен PCa; ii) Експресията на PIAS1 се индуцира допълнително при тумори на простатата след химиотерапевтично лечение с доцетаксел; и iii) PCa клетките, които оцеляват при лечение с доцетаксел, имат значително повишени нива на PIAS1 in vitro, като по този начин се предполага съществена роля за PIAS1 по време на прогресията на PCa и терапевтичната резистентност.
Нокдаунът PIAS1 води до намалена клетъчна пролиферация чрез регулиране на p21 нагоре
(А) Делът на апоптотичните клетки се измерва след 6 дни чрез поточна цитометрия след PI оцветяване. Данните представляват средно + SEM от 3 независими експеримента (*, p (Фиг. 3C). 3C). Нокдаунът на PIAS1 също намалява експресията на антиапоптотичния протеин Mcl1 (фиг. Mcl1 (фиг. 3C). 3C). За да разкрием йерархичната връзка между PIAS1 и Mcl1, извършихме нокдаун на siRNA и последващо Western blot за двата протеина. Наблюдавахме, че нокдаунът PIAS1 влияе върху експресията на Mcl1; Изчерпването на Mcl1, от друга страна, не е оказало влияние върху нивата на PIAS1 в резистентни на доцетаксел клетки, което показва, че PIAS1 е над Mcl1 (фиг. (Фиг. 3D). 3D). Попитахме също дали регулирането на PIAS1 влияе върху експресията на други членове на семейството Bcl-2 и установихме, че експресията нито на Bcl-2, нито на Bcl-xL постоянно се променя и в двете клетъчни линии след нокаута на PIAS1 (допълнителна фигура S2C). За да проверим дали намалените нива на Mcl1 след изчерпване на PIAS1 може наистина да са достатъчни за индуциране на апоптоза, измерихме процента на суб-G1 клетки след нокдаун на Mcl1. Изчерпването на Mcl1 причинява значително увеличение на апоптозата, което е сходно при родителските и резистентните клетки, но ефектът е по-изразен след понижаване на регулацията на PIAS1 (допълнителна фигура S3A-C).
Като цяло тези данни предполагат, че експресията на PIAS1 е от решаващо значение за оцеляването на родителски и резистентни на доцетаксел клетки, тъй като нокдаунът на PIAS1 води до намалена клетъчна пролиферация и повишена апоптоза.
Експресията на протеин Mcl1 е повишена при резистентни на доцетаксел клетъчни линии, при първични PCa тумори, при метастатични лезии и при пациенти след химиотерапия с доцетаксел
Като се има предвид наблюдаваната връзка между PIAS1 и Mcl1, както е описано на Фигура Фигура 3 3, и известната важна роля на Mcl1 по време на прогресията на PCa поради неговите антиапоптотични ефекти, ние изследвахме експресията на Mcl1 в резистентни на доцетаксел клетки и в тъкан на пациенти, лекувани с доцетаксел. Western blot анализът разкрива значително повишена експресия на Mcl1 в PC3-DR и DU145-DR клетки (средно 2,5 пъти увеличение) в сравнение с техните родителски аналози (Фиг. (Фиг. 4А). 4А). Имунофлуоресценцията и имунохистохимичното оцветяване на всички скринирани клетъчни линии потвърждават нашите Western blot резултати (Фиг. 4В, С). Освен това разделянето на цитоплазматични и ядрени фракции на PC3 и PC3-DR клетки разкрива повишена експресия на Mcl1 и в двете клетъчни отделения на PC3-DR клетките (Фиг. (Фиг. 4D 4D).
(А) Експресията на протеин Mcl1 се увеличава в клетките PC3-DR и DU145-DR в сравнение с техните родителски аналози. Данните представляват средна стойност + SD от 3 независими експеримента (*, p (Фиг. 4E). 4E). Освен това, експресията на Mcl1 е значително повишена в злокачествени области на тумори, получени от пациенти, лекувани с доцетаксел преди операцията, в сравнение със съответната доброкачествена тъкан. Лечението с доцетаксел няма влияние върху експресията на Mcl1 в доброкачествени проби. Поразително обаче, Mcl1 протеинът е значително индуциран в злокачествени зони от групата на химиотерапията в сравнение с контролната група (Фиг. 4Е, F). И накрая, имунохистохимичният анализ на метастази в лимфните възли и костите разкрива значително увеличено оцветяване на Mcl1 в метастатични лезии в сравнение с доброкачествени проби (фиг. 4Е, F). Следователно заключаваме, че протеинът Mcl1, подобен на PIAS1, е свръхекспресиран в първичен и метастатичен PCa и също е допълнително повишен след лечение с доцетаксел.
Нокдаунът PIAS1 влияе върху растежа на тумори на PC3 и PC3-DR CAM на растенията
След като показахме, че нокдаунът PIAS1 води до повишена апоптоза in vitro, следващата ни цел е да потвърдим своите открития in vivo. Поради това изследвахме последиците от регулирането на PIAS1 надолу върху растежа на тумори PC3 и PC3-DR при CAM анализ. За тази цел установихме PC3 и PC3-DR подлинии, съдържащи индуцируем с доксициклин GFP маркиран shRNA вектор, насочен към PIAS1 (shPIAS1-1, shPIAS1-3) или контролен вектор, съдържащ shRNA срещу луцифераза (shLuc). В контролните експерименти са изключени възможните токсични странични ефекти на доксициклин. Доксициклин до концентрация от 4 μg/ml не е оказал влияние върху клетъчната пролиферация в клетки PC3shLuc и PC3-DRshLuc in vitro (допълнителна фигура S4). И двете PIAS1 shRNA последователности значително намаляват експресията на PIAS1 протеин в PC3 и PC3-DR подклетъчни линии, което води до намалена клетъчна пролиферация. Въпреки това, shPIAS1-3 последователността имаше по-изразен анти-пролиферативен ефект и в двете тествани клетъчни линии. Активирането на индуцируемата система с 1 μg/ml доксициклин беше достатъчно за намаляване на експресията на PIAS1 и вследствие на това пролиферация (допълнителна фигура S5A-D).
Поразително е, че нокаудът на PIAS1 за 6 дни, използвайки последователността shPIAS1-3 и 1 μg/ml доксициклин, доведе до значително намаляване на клетъчната пролиферация и туморния обем на PC3 (фиг. 5А, С) и PC3-DR (фиг. 5В, D) onplants в CAM експеримента. Тези открития са потвърдени от значително намален брой Ki67 положителни клетки във всички shPIAS1-3 на растенията и от намалена имунореактивност на PIAS1, Ki67 и Mcl1 в PC3, както и в PC3-DR клетки от специфичната група за лечение shPIAS1-3 (Фиг. 5А, Б).
(A – B) Представителни изображения на ярко поле и флуоресценция на цели тумори, както и представителни снимки, направени след оцветяване на имунохистохимични Ki67, PIAS1 и Mcl1 на туморни сечения. (C, D) Статистически анализ на туморната област и Ki67 положителни клетки (клетки/cm 2 туморно напречно сечение) на PC3 и PC3-DR тумори. Данните представляват средна стойност + SD от 5 насаждения/лечение, направено в 2 независими експеримента (***, p 6A, B). Още повече, 3 от 7 мишки в PC3 ксенографта и 5 от 7 мишки в PC3-DR ксенографта не са имали откриваема туморна маса в края на проучването, демонстрирайки пълна регресия на тумора при нокаута на PIAS1. Определянето на обема и теглото на тумора в края на експеримента разкрива значително намаляване и на двата параметъра при тумори, възникнали от клетки, където PIAS1 е изчерпан (Фигура 6C, D). Последващо имунохистохимично оцветяване на тумори потвърждава нокдаун на PIAS1 в специфичната група за лечение и освен това разкрива намалена експресия на Mcl1, Ki67 и повишена р21 в сравнение с тумори от контролните групи (фиг. 6Е, F; допълнителна фиг. S6).
Специфичен нокдаун PIAS1 чрез активиране на индуцируемата доксиклин система води до значително намаляване на обема на тумора (A, B) и тегло на тумора (C, D) в групата за лечение shPIAS1-3 + dox в сравнение с контролните групи (*, p 2 комплект от първа верига (Qiagen). qRT-PCR се извършва, както е описано другаде [48]. TATA-Box свързващ протеин (TBP) е избран като ендогенен експресионен стандарт (напред 5′-CACGAACCACGGCACTGATT-3 ′; обратен 5′-TTTTCTGCTGCCAGTCTGGAC-3 ′; сонда 5′-FAM-TCTTCACTCTTGGCTCCTGTGCACA-TAMRA-3 ′). от Applied Biosystems, са използвани съгласно протокола на производителя.
Уестърн петно
Уестърн блот се извършва, както е описано по-рано [48]. Използвани са следните антитела: анти-GAPDH (1: 100000; Chemicon, Виена), анти-Mcl1 (1: 500; Санта Круз), анти-cPARP (1: 1000; Promega, Madison, WI), анти-PIAS1 ( 1: 500; Клетъчна сигнализация, Данвърс, Масачузетс, анти-p21 CIP1/WAF1 (1: 500; Клетъчна сигнализация), анти-р100 (1: 500; Клетъчна сигнализация), анти-STAT3 (1: 1000; Санта Круз), анти-STAT5, (1: 1000; Санта Круз), анти-Bcl-2 (1: 500; клетъчна сигнализация) и анти-Bcl-xL (1: 500; клетъчна сигнализация).
[3Н] включване на тимидин, WST анализ и измерване на апоптозата
За включване на [3Н] тимидин и WST анализи, клетките се посяват с плътност 2.5 × 10 3/гнездо в три екземпляра върху отделни 96-гнездови плаки. За измерване на апоптозата, клетките се посяват с плътност 1,5 × 10 5/ямка върху 6-ямкови плаки. Клетките се трансфектират два пъти за период от 6 дни. Индуцируеми доксициклин подклетъчни линии се култивират в присъствието или отсъствието на доксициклин. Включването на тимидин се измерва, както е описано по-горе [48]. Като индекс на клетъчна пролиферация и жизнеспособност беше извършен WST анализ (Roche) съгласно протокола на производителя. Процентът на апоптотичните клетки е оценен, както е описано по-горе [33].
Установяване на индуцируеми доксициклин shRNA конструкции
РС-3 и PC3-DR клетки са стабилно заразени с доксициклин-индуцируем shRNA contructs срещу PIAS1 или луцифераза [(shPIAS1-1, 5'-GATCCCC AAGGTCATTCTAGAGCTTTA TTCAAGAGA TAAAGCTCTAGAATGACCTT TTTTTGGAAA-3 '; shPIAS1-3, 5'-GATCCCC CGAATGAACTTGGCAGAAA TTCAAGAGA TTTCTGCCAAGTTCATTCG TTTTTGGAAA- 3 ′ или shLuc, 5′-GATCCCC CTTACGCTGAGTACTTCGA TTCAAGAGA TCGAAGTACTCAGCGTAAG TTTTTGGAAA-3 ′]. Генерирането и трансфекцията на конструкции се извършват, както е описано по-горе [49].
CAM анализ
CAM анализът е извършен, както е описано другаде [50] с леки модификации. За подготовка на присаждане, нативният, непепсинизиран колаген от опашка от плъх тип I (BD Bioscience, Bedford, MA) беше неутрализиран с 0.2 М разтвор на NaOH и смесен с 10 × DMEM среда. 5 × 105 PC3 или PC3-DR клетки бяха добавени към 50 μL от този разтвор. Колаген върху растения със или без доксициклин (1 μg/ml) се прилага върху CAM и се инкубира в продължение на 5 дни. Ксенотрансплантатите бяха анализирани под стереомикроскоп с цифров фотоапарат (Olympus SZX10, Olympus E410, Виена). За хистологичен анализ насажденията се изрязват от CAM, фиксират се в 4% параформалдехид и се обработват за парафиново секциониране и IHC. Използвани са следните антитела: anti-PIAS1 (1: 400; Abcam), anti-Mcl1 (1: 200; Santa Cruz) и anti-Ki67 (1: 100; DAKO, Glostrup, Дания).
Установяване и лечение на ксенотрансплантати на тумор на простата при голи мишки
Статистически анализ
За статистически анализ са използвани SPSS (V15.0) и GraphPad Prism 5. За всички експерименти Гаусовото разпределение се определя с помощта на теста на Колмогоров-Смирнов. Различията между лечебните групи бяха анализирани с помощта на t-тест на Student или U-тест на Mann-Whitney. Стойностите на Р под 0,05 се считат за значими. Обемът/времето на тумора се коригира за многократно тестване, използвайки метода на Bonferroni във всички експерименти in vivo с ксенотрансплантация. Всички разлики, подчертани със звездички, са статистически значими, както са кодирани в легенди за фигури (* P (4.5M, pdf)
Благодарности
Тази работа беше подкрепена от програмата за вътрешно финансиране на Медицинския университет в Инсбрук за млади учени MUI-START, Проект 2010012007 и безвъзмездни средства от FWF P 25639-B19 (за MP) и W1101 (за ZC).
Авторите благодарят на Irma Sottsas, Karin Unterberger и Andrea Eigentler за приготвянето на ТМА, вграждането на парафин и имунохистохимичното оцветяване, Mag. Еберхард Щайнер за подбор на пациенти и статистически анализ, д-р Уолтър Парсън за удостоверяване на клетъчната линия, д-р Ярон Галанти (Университет в Кеймбридж) за щедро споделяне на конструкции на PIAS1, Корнелия Хайс за IHC оцветяване на CAM тумори и Вероника Раух за помощ при вирусни инфекции . Авторите също така благодарят на д-р Бетина Шлик за помощ при количественото определяне на оцветените клетки, както и на д-р Натали Сампсън, д-р Холгер Ерб и д-р Петра Масонер за полезни дискусии.
Бележки под линия
Конфликт на интереси
Авторите не декларират конфликт на интереси.
Авторски приноси
MP установи проекта и постулира хипотезата. Той беше отговорен за всички експерименти и написа ръкописа. JH извърши имунофлуоресцентно оцветяване и помогна за извършването на анализи за пролиферация и жизнеспособност. HN и IE бяха отговорни заедно с MP за изпълнението на експериментите in vivo. GS беше отговорен за установяването на TMA и анализира заедно с MP оцветените ядра на пациента. JK извърши и анализира CAM анализите. SG и IH помогнаха за установяването на индуцируеми доксициклин подклетъчни линии. HK контролира създаването на TMA. ZC помогна за координацията на експериментите. Освен това всички съавтори помогнаха с писането, подобриха ръкописа и одобриха окончателната му версия.
- Признаци и симптоми на рак на простатата
- Питър Фачинели разкрива отслабване с 30 кг, позира без риза за рак на простатата
- Затлъстяване и рак на простатата Какво да знаете Cedars-Sinai
- Затлъстяване и оцеляване от рак на гърдата Разговор с Ан Мактьернан - Американски институт за рак
- Оцеляване при рак на гърдата