Субекти
Резюме
PyroGlu-Leu присъства в някои хранителни протеинови хидролизати и традиционни японски ферментирали храни. Нашето предишно проучване показа, че пероралното приложение на pyroGlu-Leu (0,1 mg/kg телесно тегло) отслабва дисбиозата при мишки с експериментален колит. Целта на това проучване беше да се изясни защо толкова ниска доза pyroGlu-Leu отслабва дисбиозата при различни животински модели. Диетата с високо съдържание на мазнини значително увеличи съотношението на Firmicutes/Bacteroidetes в изпражненията на плъхове в сравнение с контролната диета. Пероралното приложение на pyroGlu-Leu (1 mg/kg телесно тегло) значително отслабва дисбиозата, предизвикана от диети с високо съдържание на мазнини. Като се фокусираме върху производството на чревни антимикробни пептиди, открихме, че pyroGlu-Leu значително повишава нивото на 4962 Da пептиди, които се идентифицират като пропептид на ратузин или дефензин алфа 9, в илеума. Също така наблюдавахме повишени пептиди на триптичен фрагмент от ратузин в лумена. Тук съобщаваме, че перорално приложеният pyroGlu-Leu отслабва дисбиозата чрез увеличаване на антимикробния пептид гостоприемник, ратузин.
Въведение
Тези открития предполагат, че прилагането на ниски дози pyroGlu-Leu може да отслаби дисбиозата чрез засилване на производството на приемни антимикробни пептиди. Настоящото проучване има за цел да изясни ефектите на pyroGlu-Leu върху производството на чревни антимикробни пептиди, използвайки плъхове с дисбиоза, предизвикана от диета с високо съдържание на мазнини.
Резултати
Ефект на pyroGlu-Leu върху дисбиоза, предизвикана от диета с високо съдържание на мазнини
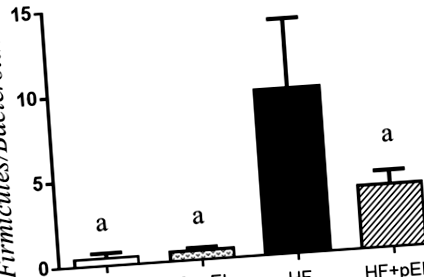
Както е показано на фиг. 1, плъховете на диета с високо съдържание на мазнини (HF) без приложение на pyroGlu-Leu показват повишено Firmicutes/Bacteroidetes съотношение във фекалиите им в сравнение с плъховете в контролните диетични групи (C и C + pEL; стр = 0,003 по тест на Tukey’s, н = 3), което показва, че дисбиозата е предизвикана от диета с високо съдържание на мазнини. Прилагането на pyroGlu-Leu (1,0 mg/kg телесно тегло) значително отслабва дисбиозата, предизвикана от диета с високо съдържание на мазнини (HF + pEL; стр = 0,035 по тест на Tukey’s, н = 3). Администрирането на pyroGlu-Leu не е повлияло на Firmicutes/Bacteroidetes съотношение в контролните диетични групи (C и C + pEL; стр > 0,99 по тест на Tukey, н = 3). Приложението на pyroGlu-Leu обаче не повлиява значително наддаването на телесно тегло и биохимичните показатели на кръвта (ALT, AST, TCHO, TG, HDL и LDL) при плъхове в групите с високо съдържание на мазнини (стр > 0,05 от теста на Tukey, н = 3: Данните не са показани).
Изчерпателен анализ на пептиди в 30% екстракти от оцетна киселина
Пептидите, екстрахирани с помощта на 30% оцетна киселина от илеумите на плъхове (н = 3) от 4 експериментални групи (C, C + pEL, HF и HF + pEL) бяха фракционирани, използвайки хроматография за изключване на размера (SEC). Пептидите във SEC фракциите бяха разделени чрез обърната фаза-HPLC (RP-HPLC). Елуирането на пептиди чрез RP-HPLC се наблюдава чрез масова спектрометрия с йонизационно електронно разпръскване (ESI-MS) в режим на общо наблюдение на йони (TIM). Шестдесет и девет пика бяха наблюдавани в общите йонни хроматограми на RP-HPLC на SEC фракциите от плъховете (н = 3) във всяка група (допълнителна фиг. 1а – г). Таблица 1 обобщава времето на задържане и наблюдаваното съотношение маса-заряд (m/z). Първият пик (пик 1) се появи съответно във SEC фракции 14–26 и 30–35. Пептидите в първата и последната SEC фракции показват същото време на задържане и модел на спектъра на масата в RP-HPLC-MS, което предполага, че пептидът в пик 1 в бившата SEC фракция образува олигомер чрез нековалентно свързване. Базиран на m/z от многовалентните йони са изчислени молекулните тегла на 57 пептида (Таблица 1).
Откриване на пептиди, получени от активната форма на ратузин и дефензин алфа 9
За да се открие секрецията на активната форма на тези антимикробни пептиди от лумена, пептидите от вътрешното съдържание на тънките черва бяха подложени на SEC и RP-HPLC-MS, както е описано в раздела Методи. RP-HPLC-MS показва големи широки пикове и анализът на масспектрите разкрива присъствието на множество съединения в тези пикове. Поради това беше трудно да се идентифицират пептидите в толкова сложна матрица въз основа на анализ на последователността. Алтернативно, пептидите, които потенциално се освобождават от активната форма на ратузин и дефензин алфа 9 чрез смилане на трипсин, се откриват от LC-MS/MS в режим на мониторинг на множество реакции (MRM). Установено е, че нивата на свързани с ратузин пептиди, LR, VR и LSR, са по-високи след приложение на pyroGlu-Leu в групите с високо съдържание на мазнини (Фиг. 3, панели а и b), докато това не е случаят с дефензин алфа 9-свързани пептиди, LEIR и WPWK, както в контролната, така и в диетичната група с високо съдържание на мазнини (фиг. 3, панели а и в).
Дискусия
Въпреки че пропептидът на ратузин, чието молекулно тегло е 4962 Da, може да бъде открит в 30% екстракта от оцетна киселина от илеума чрез директно инжектиране в LC-MS в режим SIM, беше трудно да се открие активната форма на ратузин. Следователно, пропептидът на ратузин (4962 Da) може да се използва за наблюдение на активирането на ратузин при плъхове, за да се открият хранителни компоненти, които могат да подобрят производството на ратузин. За тази цел могат да се използват LC-MS и ELISA с антитялото срещу пропептида на ратузин.
Механизмът, лежащ в основата на усилването на активирането на ратузин от pyroGlu-Leu, остава да бъде изяснен. Известно е, че чревните α-дефензини се произвеждат от клетките на Панет в илеума. 24 Предполага се също така, че ратузин, който принадлежи към подсемейство на дефензин, се произвежда от клетки на Paneth. 25 Установено е, че нивото на ратузин пропептид в илеума е по-високо от това в дванадесетопръстника и дебелото черво (Допълнителна фигура 4). Следователно, pyroGlu-Leu може да взаимодейства директно с клетките на Paneth в илеума, за да произведе ратузин. Съществува обаче възможност pyroGlu-Leu да взаимодейства и с други клетки, като макрофаги и неутрофили, за да подобри или потисне определени активни вещества, които засягат клетките на Paneth. За да се реши този проблем, в момента се разработва система за клетъчна култура за клетки на Paneth на плъхове и система за чревна култура на органи, която произвежда ратузин.
Методи
Реактиви
н-(трет-Бутоксикарбонил) -L-пироглутаминова киселина (Boc-Pyr-OH), L-левцин трет-бутилов естер хидрохлорид (H-Leu-OtBu ・ HCl) и ацетониторил (HPLC клас) са получени от Wako Pure Chemical Industries (Осака, Япония). н-α- (9-флуоренилметоксикарбонил)-н-ω- (2,2,4,6,7-пентаметилдихидробензофуран-5-сулфонил) -L-аргинин стр-метоксибензилов алкохол смола (Fmoc-Arg (Pbf) -Alko смола), Fmoc-L-Leu-OH, Fmoc-L-Val-OH, Fmoc-O- (т-бутил) -L-серин (Fmoc-Ser (тBu) -OH), Fmoc-L-Ile-OH и Fmoc-L-Trp-OH са получени от Watanabe Chemical Industries (Хирошима, Япония). Fmoc-н-ω- (т-бутилоксикарбонил) -L-лизин (Fmoc-Lsy (Boc) -Смола), Fmoc-L-Pro-OH и Fmoc-L-глутаминова киселина γ-т-бутилов естер (Fmoc-Glu (OtBu) -OH) са получени от HiPep Laboratories (Киото, Япония).
Синтез на пептиди
PyroGlu-Leu (pEL) се синтезира, използвайки ръчен метод на липидна фаза, както е описано по-горе. 8 Триптично усвоени пептиди, потенциално освободени от активната форма на ратузин (Leu-Arg, Val-Arg и Leu-Ser-Arg) и дефензин алфа 9 (Leu-Glu-Ile-Arg и Trp-Pro-Trp-Lys), с изключение на цистеин-съдържащите пептиди, са синтезирани чрез Fmoc стратегията с използване на автоматичен пептиден синтезатор (PSSM-8, Shimadzu, Киото, Япония). Синтезираните пептиди се пречистват чрез RP-HPLC, използвайки Cosmosil MS-II (10 mm i.d. × 250 mm; Nacalai Tesque, Киото, Япония). Пептидите се елуират с двоичен градиент от 0,1% мравчена киселина (разтворител А) и 0,1% мравчена киселина, съдържаща 80% ацетонитрил (разтворител В) при скорост на потока 2,0 ml/min. Програмата за градиент беше както следва: 0–20 минути; В 0-50%, 20-30 минути; В 50–100%, 30–35 минути; В 100%, 35–35,1 минути; В 100–0%, 35,1–45 минути; B 0%. Колоната се поддържа при 40 ° С.
Експерименти с животни
Анализ на микробиота
Копията на двата основни типа на микробиота на плъхове, Фиксира и Бактероидети, бяха оценени чрез qPCR, както е описано по-горе. 9 Накратко, ДНК беше извлечена от 0,5 g от всяко изпражнения с помощта на QIAmp DNA StoolMini Kit (Qiagen, Venlo, Холандия), съгласно инструкциите на производителя. qPCR анализът е възложен на първичната клетъчна дивизия на Cosmo Bio (Сапоро, Япония).
Екстракция на пептиди от червата
Дуоденумът, илеумът и дебелото черво бяха нарязани на малки парчета с помощта на ножици. Парчетата (100 mg) се хомогенизират със 100 μL PBS в BioMasher II (Nippi, Токио, Япония). По-нататък хомогенатите се смесват с 200 μL 60% оцетна киселина и се хомогенизират отново. Тези хомогенати се центрофугират при 13 000 х ж за 10 минути и супернатантите се събират. Този разтворител (30% оцетна киселина) се използва за преференциално извличане на животински антимикробни пептиди. 23.
Хроматография за изключване на размера (SEC)
Екстрактите от 30% оцетна киселина на илеумите се пречистват чрез преминаването им през Ultrafree-MC (размер на порите 5 µm; Merck, Дармщат, Германия), пълен със Sephadex G-25 (фин клас; GE Healthcare, Бъкингамшир, Англия). Пробите се елуират чрез предене на колоната при 815 × ж за 1 мин. Избистрените проби (200 uL) се подлагат на SEC, като се използва пептид Superdex 10/300 GL (GE Healthcare), уравновесен с 0,1% мравчена киселина, съдържаща 10% ацетонитрил при скорост на потока 0,5 ml/min. Фракциите се събират на всеки 1 min.
Масова спектрометрия с течна хроматография (LC-MS)
Масови хроматограми на RP-HPLC-MS на SEC Fr. 32 от HF + pEL групата и мас спектрите на пика, маркиран със стрелка. Режим на общо наблюдение на йони а и избрани (m/z = 710,0, 828,1, 993,5) режим на йонно наблюдение б, съответно. Пептидите, чието молекулно тегло може да бъде оценено, бяха открити чрез LC-MS в SIM режим за най-високите 2 или 3 многовалентни йона. The Y. оста представлява йонна интензивност
Пептидна последователност
Аминокиселинните последователности на пречистените пептиди бяха оценени чрез разграждане на Edman, използвайки PPSQ-21 (Shimadzu). Аминокиселинните последователности бяха разпределени към протеина с помощта на Basic Local Alignment Search Tool (BLAST).
Откриване на триптични пептиди на ратузин и дефензин алфа 9
Статистически анализ
Всички анализи бяха извършени за всеки плъх (н = 3). Резултатите бяха представени като средно ± стандартни отклонения (SD). За анализ на микробиота, наддаване на телесно тегло, кръвни параметри и сравнение на ефекта на pyroGlu-Leu върху ратузинов пропептид между дванадесетопръстника, илеума и дебелото черво, значителните разлики между групите бяха оценени чрез теста на Tukey’s. За други анализи значителните разлики между всяка диета (C срещу C + pEL или HF срещу HF + pEL) са оценени от Student’s т-тест. Разлики от стр
Наличност на данни
Всички съответни данни са достъпни от съответния автор при поискване.
Препратки
Сато, К. Структура, съдържание и биоактивност на пептиди, получени от храна в тялото. J. Agric. Храна Chem. 66, 3082–3085 (2018).
Nwachukwu, I. D. & Aluko, R. E. Структурни и функционални свойства на антиоксидантните пептиди, получени от хранителни протеини. J. Food Biochem. 43, e12761 (2019).
Hartmann, R. & Meisel, H. Пептиди, получени от храни с биологична активност: от изследвания до хранителни приложения. Curr. Становище. Биотехнол. 18., 163–169 (2007).
Möller, N. P., Scholz-Ahrens, K. E., Roos, N. & Schrezenmeir, J. Биоактивни пептиди и протеини от храни: индикация за ефекти върху здравето. Евро. J. Nutr. 47, 171–182 (2008).
Sato, K. et al. Поява на несмилаеми пироглутамилови пептиди в ензимен хидролизат на пшеничен глутен, приготвен в промишлен мащаб. J. Agric. Храна Chem. 46, 3403–3405 (1998).
Kiyono, T. et al. Идентифициране на пироглутамилови пептиди в японско оризово вино (саке): наличие на хепатопротективен пироГлу-Леу. J. Agric. Храна Chem. 61, 11660–11667 (2013).
Ejima, A., Nakamura, M., Suzuki, Y. A. & Sato, K. Идентифициране на пептиди, получени от храна в човешката кръв след поглъщане на хидролизати на царевица и пшеничен глутен. J. Food Bioact. 2, 104–111 (2018).
Sato, K. et al. Идентифициране на хепатопротективен пептид в хидролизат на пшеничен глутен срещу остър хепатит, индуциран от D-галактозамин при плъхове. J. Agric. Храна Chem. 61, 6304–6310 (2013).
Wada, S. et al. Поглъщането на ниска доза пироглутамил левцин подобрява индуцирания от декстран сулфат натрий колит и чревната микробиота при мишки. J. Agric. Храна Chem. 61, 8807–8813 (2013).
Yamamoto, Y. et al. Антидепресант-подобен ефект на получените от храната пироглутамилови пептиди при мишки. Невропептиди 51, 25–29 (2015).
Kiyono, T. et al. Идентифициране на пироглутамил пептиди с антиколитна активност в японско оризово вино, саке, чрез орално приложение в модел на мишка. J. Функция. Храни 27, 612–621 (2016).
Hirai, S. et al. Противовъзпалителен ефект на пироглутамил-левцин върху стимулирани с липополизахарид RAW 264.7 макрофаги. Life Sci. 117, 1–6 (2014).
Oishi, М. и сътр. PyroGlu-Leu инхибира индукцията на индуцируема синтаза на азотен оксид в стимулирани с интерлевкин-1β първично култивирани хепатоцити на плъхове. Азотен оксид. 44, 81–87 (2015).
Matsuoka, K. & Kanai, T. Чревната микробиота и възпалително заболяване на червата. Семин. Имунопатол. 37, 47–55 (2015).
Сато, К. и Кийоно, Т. Модифицирани пептиди в храни: структура и функция на пироглутамил пептидите. FFI J. 222, 216–222 (2017).
Huang, H., Krishnan, H. B., Pham, Q., Yu, L. L. & Wang, T. T. Y. Соя и чревна микробиота: взаимодействие и последици за човешкото здраве. J. Agric. Храна Chem. 64, 8695–8709 (2016).
Danneskiold-Samsøe, N. B. et al. Взаимодействие между храната и чревната микробиота в здравето и болестите. Хранителна Рез. Международна. 115, 23–31 (2019).
Wen, Y. et al. Може да се наложи непокътната чревна микробиота за имуномодулация, управлявана от лактоферин при плъхове. J. Функция. Храни 39, 268–278 (2017).
Mukherjee, S. & Hooper, L. V. Антимикробна защита на червата. Имунитет 42, 28–39 (2015).
Guo, X. et al. Диетата с високо съдържание на мазнини променя чревната микробиота и експресията на антимикробни пептиди на клетките на Paneth, предшестващи промени в циркулиращите възпалителни цитокини. Посредници Възпаление. 2017 г., 9474896 (2017).
Hodin, C. M. et al. Намалените нива на антимикробен протеин на Paneth клетки корелират с активирането на разгънатия протеинов отговор в червата на затлъстели индивиди. J. Pathol. 225, 276–284 (2011).
Hayase, Е. et al. R-Spondin1 разширява клетките на Paneth и предотвратява дисбиоза, индуцирана от заболяване присадка срещу гостоприемник. J. Exp. Med. 214, 3507–3518 (2017).
Ayabe, T. et al. Активиране на а-дефензини на клетъчни клетки на Paneth в тънките черва на мишки. J. Biol. Chem. 277, 5219–5228 (2002).
Ayabe, T. et al. Секреция на микробицидни а-дефензини от чревни клетки на Панет в отговор на бактерии. Нат. Имунол. 1, 113–118 (2000).
Patil, A. A., Ouellette, A. J., Lu, W. & Zhang, G. Rattusin, свързан с чревния α-дефензин пептид при плъхове с уникален модел на разстояния между цистеините и нечувствителни към сол антибактериални действия. Антимикроб. Агенти Chemother. 57, 1823–1831 (2013).
Kanai, T., Matsuoka, K., Naganuma, M., Hayashi, A. & Hisamatsu, T. Диета, микробиота и възпалителни заболявания на червата: уроци от японски храни. Корейски J. Intern. Med. 29, 409–415 (2014).
Благодарности
Бихме искали да благодарим на Интегрирания център за биоанализ на Киото, който ни позволи да използваме техните MALDI-TOFMS (AXIMA Performance). Също така бихме искали да благодарим на Editage (www.editage.jp) за редактиране на английски език. Това проучване беше подкрепено от Интегрираните изследвания за земеделие и интердисциплинарни области, Министерство на земеделието, рибарството и горите, Япония (номер на безвъзмездна помощ 14532022).
Информация за автора
Принадлежности
Отдел за приложни биологични науки, Висше училище по земеделие, Университет Киото, Киташиракава Ойваке-Чо, Киото, 606 8502, Япония
Саки Ширако, Юми Коджима и Кенджи Сато
Общински институт по индустриални технологии и култура в Киото, 91 Chudouji Awata-cho, Киото, 600 8813, Япония
Катедра по японска хранителна култура, Префектурен университет в Киото, Shimogamo-Hangi-cho, Киото, 606 8522, Япония
Отдел по агрономия и градинарство, Висше училище по земеделие, Университет Киото, Гокашо, Уджи, Киото, 611 0011, Япония
Катедра по диабет, ендокринология и хранене, Медицински факултет, Университет Киото, 54 Shogoin Kawahara-cho, Киото, 606 8507, Япония
Каори Икеда и Нобуя Инагаки
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Вноски
S.S., Y.M., K.I., N.I. и К.С. проектира експериментите. С.С. и К.С. написа вестника. S.S., Y.K., N.T. и Y.N. извърши експериментите.
Автора за кореспонденция
Етични декларации
Конкуриращи се интереси
Авторите не декларират конкуриращи се интереси.
Допълнителна информация
Бележка на издателя: Springer Nature остава неутрален по отношение на юрисдикционните претенции в публикувани карти и институционални принадлежности.
- Микробни заблуди Ферментирали храни; Food Insight
- Пробиотици във ферментирали храни; Как да ги добавите към вашата диета Институт по кулинарно образование
- Киселото зеле е още по-добро Изследователят иска ферментирали храни, добавени към ръководството за храни
- Oshi Health трябва да ядете ферментирали храни за IBD
- Reddit - vegan1200isplenty - Вашите любими вегански болни храни