Субекти
Резюме
Въведение
Х-свързани вродени малки мозъчни атаксии
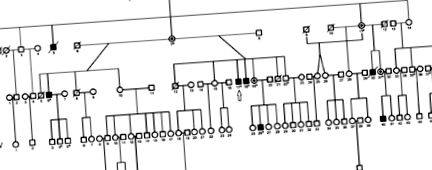
Генеалогия на фамилията Бурят. Последователността на целия геном беше извършена за пациента, посочен със стрелка; плътни символи означават засегнатите лица; пунктирани кръгове - облигирани хетерозиготни женски носители; отворени символи - незасегнати лица; нарязани символи - починали субекти; звездички - индивиди, които са били използвани за генотипиране. 6
Клинично описание
Магнитно-резонансната томография (ЯМР) разкрива хипоплазия на малки полукълба на малкия мозък и вермис при засегнати мъже от родословието на Бурят. Общите неврологични симптоми за всички засегнати членове на семейството са забавяне на развитието, затруднения в говора и координацията, атаксия на крайниците и тръбите и дизартрия (допълнителна таблица 1). Изследваните пациенти не са могли да седят без подкрепа по всяко време преди 15-месечна възраст или да ходят самостоятелно преди 7-годишна възраст и да говорят първите си думи преди 4-годишна възраст. При по-голямата част от пациентите са наблюдавани нистагъм, офталмоплегия и повишени сухожилни рефлекси. Няма признаци на памет или когнитивно увреждане при всички пациенти от това родословие. 6
Характеристики на сидеробластична анемия или разстройство на медта не са открити. Хематологичните тестове, проведени за пациент (III-18) с X-свързана атаксия от родословието на Бурят, не показват аномалии на еритропоетичните клетки или натрупване на железни гранули. Стойностите на хемоглобина са средно 149 g/l (нормален диапазон, 130–180 g/l), цветният индекс е средно 1,0 (нормален диапазон, 0,80–1,05), тестът за утаяване на еритроцитите е средно 3 mm/h (нормален диапазон, 0–15 mm/з) и броят на белите кръвни клетки обикновено е нормален. Всички биохимични тестове бяха нормални, с изключение на леко повишено ниво на билирубин, 14,5 mg/l (нормален диапазон, 5–12 mg/l), а анализът на урината беше незабележим. 6
Материали и методи
Кръвни проби от всички субекти бяха събрани преди това с подходящо информирано съгласие и тези данни вече са докладвани. 6 В родословието не е установено кръвно родство (Фигура 1). Направена е геномна библиотека от 2 μg ДНК проба на пациент III-17, следвайки протокола за сдвоен краен ДНК пробен комплект за подготовка (Illumina, Сан Диего, Калифорния, САЩ). Последователността на генома с висока производителност беше извършена на платформата Illumina HiSeq 2000 с поне 14-кратна дълбочина на покритие на генома GRCh37. Анализът на генома беше извършен с помощта на софтуера „ngs-pipeline“, проектиран от нашата група http://rogaevlab.ru/ngs-pipeline. Идентифицираните редки варианти бяха предоставени на NCBI ClinVar и са достъпни на www.ncbi.nlm.nih.gov/clinvar/?LinkName=orgtrack_clinvar&from_uid=505407.
Бащинството се определя чрез STR (кратък тандем повторение) анализ, като се използват самоделни STR маркери и PowerPlex 16 System (Promega, Madison, WI, USA).
Резултати
Последователност на целия геном
Идентифициране на варианти в ABCB7 и ATP7A гени. Представяне на геномна област, съдържаща мутации с помощта на IGV (Integrative Genomics Viewer) инструменти: (а) екзон 16 от ABCB7 ген (hg19 chrX: g.742734204C> T), (б) 41.4 kb изтрит регион на ATP7A ген (hg19 chrX: g.77190006_77231471del), включително екзон 2; вертикални стрелки в (а) и (б) посочи хромозомните локуси за ABCB7 и ATP7A гени. (° С) Проверка на последователността на кандидат-мутации в екзон 16 от ABCB7 ген. (д) Праймери схема за валидиране на изтриване в ATP7A ген. (д) Проверка на последователността чрез последователност на Sanger на изтриване в ATP7A ген при пациентите. (е) PCR продукти на ATP7A генно изтрит регион: М, ДНК стълба; R, нагоре по веригата ‘дясно’, фланкиращо с регион за заличаване; В, вътрешно изтриване на регион; L, надолу по веригата „ляв“ фланкиращ с делеционна област (R, In, L - продукти присъстват, ако делецията липсва; Del - продуктът присъства, ако има делеция в ДНК проба).
ABCB7 ген
Несинонимен вариант на миссен hg19 chrX: g.74273420C> T в екзон 16 (AF241887) от ABCB7 ген (ID на гена: 22) води до заместване на глицин със серин в позиция 682 на ATP-свързващ касетен член 7 протеин (NP_001258625, UniProt O75027) (Фигури 2а и в). Тъй като идентифицираният вариант е локализиран в близост до място на акцепторно снаждане в рамките на първия кодиращ триплет на екзон 16, ние изследвахме дали заместването може да доведе до образуването на ново силно място на сплайсинг. Биоинформационните инструменти, тестващи предполагаемите места за сплайсинг на базата на честоти на нуклеотиди във всяка позиция на сайта (от -20 до +3) за конститутивни, касетни, вътрешни акцептори и външни акцептори, не предвиждат промени в сплайсинга за мутантния алел 18, 19 (допълнителна таблица 5).
Известни са няколко преписа на ABCB7 ген, кодиращ протеинови изоформи, а идентифицираният вариант засяга всички предсказани протеинови изоформи. Структурата и функцията на ABCB7 протеиновите домейни не са напълно изяснени. Мутацията се намира в нуклеотидно свързващия домен (NBD) на ABCB7 протеин (NP_001258625, UniProt O75027) и нарушаването на тази област в ортолога на дрожди ATM1 води до загуба на протеинова функция и натрупване на желязо вътре в митохондрията (Допълнителна фигура 3А) . 20 Изследвахме структурни промени в мутантния серинов вариант на ABCB7, носещ протеин, използвайки програмата за биоинформатика Phyre2. 21 Сравнителен анализ на
1000 паралогични и ортологични аминокиселинни последователности на суперсемейства ABC транспортни протеини показва силно консервиран глицинов вариант в позиция 682 (Фигура 3). Заместването на серин води до ротация в неподвижна протеинова страна. Бяха извършени допълнителни биоинформативни прогнози за тази мутация. Мутантният вариант в ABCB7 генът е оценен като вреден от SIFT 22 и вероятно увреждащ (0,996) от PolyPhen. Към днешна дата са открити четири други мутации в ABCB7 ген, свързан със сидеробластична анемия и церебеларна атаксия (допълнителна фигура 3А).
Еволюционен анализ на мутационната област. Мутация на миссенс в ABCB7 и изтриване в ATP7A гените променят аминокиселинните последователности, които са силно запазени при гръбначните животни. Ниво на еволюционно запазване на аминокиселините, илюстрирано чрез засенчване от бяло за неконсервирано до тъмно сиво за силно консервирано. Подравняванията бяха получени от UCSC Genome Browser (Multiz Alignments of 100 гръбначни животни), 48 ClustalW. 49
ATPase, Cu 2+ транспортиращ, алфа полипептид (ATP7A) ген
Мутации в ATP7A гените са свързани с дефицит на мед/болест на Menkes (MD; OMIM: 309400), характеризираща се с тежка умствена изостаналост, гърчове, забавяне на растежа, хипотермия, копривна или стоманена коса, отпуснатост на кожата и ставите и смъртност в ранна възраст. По-лекият синдром на тилната рога (OHS) също е свързан с мутации в ATP7A ген (OMIM: 304150). И все пак, нито една от клиничните характеристики на тези заболявания не е открита при пациенти в Бурят, които нямат втория екзон на ATP7A ген. Предположихме, че заличаването може да има относително скромен, ако има такъв, ефект върху клиничния фенотип при тези пациенти, който не е свързан с описаните по-рано клинични симптоми, свързани с мутации в ATP7A ген.
PGAM4 ген
Генетична хетерогенност
Открихме мутацията/изтриването в ABCB7 и ATP7A гени и при четирите изследвани засегнати мъжки роднини от това семейство Бурят със същата диагноза и при четири асимптоматични женски роднини със засегнатите синове (допълнителна таблица 6). Мутацията/делецията е била в хемизиготично състояние при всички изследвани засегнати мъже и при всеки женски носител е била хетерозиготна. И четиримата изследвани здрави мъже от едно и също родословие са били хемизиготни за алели от див тип.
Освен това тествахме четири несвързани семейства пациенти с много подобна клинична проява и с диагноза вродена непрогресивна атаксия, срещаща се изключително при мъжете (допълнителна таблица 7). Анализът на всички екзони на ABCB7 ген чрез директно секвениране (допълнителна таблица 8) не показва никакви разлики в сравнение с човешки референтни геномни последователности. По същия начин не открихме изтриване на екзон 2 от ATP7A ген и ретроген PGAM4 при засегнатите мъже в тези семейства. Генотипизирането на тези семейства за мутация NM_001001344.2: c.3321G> A (p.Gly1107Asp) в ATP2B3 ген, който преди това беше описан в случаите на атаксия на малкия мозък, 4 също не разкрива разлика от референтния алел от див тип.
Дискусия
Общата характеристика на непрогресивните атаксии е забележимо забавяне в ранното двигателно развитие и нарушение на двигателната координация през живота в резултат на церебеларна хипоплазия/атрофия. Тук съобщаваме за нова мутация в ABCB7 това е причинителен фактор за церебеларна хипоплазия/атрофия и непрогресивна атаксия, като по този начин допълнително разширява списъка с мутации в този ген, свързани с церебеларната атаксия. Преди това бяха открити четири различни мутации в ABCB7 са свързани с мозъчна патология със сидеробластична анемия. При сидеробластичната анемия желязото не се включва в хемоглобина, тъй като е необходимо да се произвеждат здрави еритроцити от костния мозък. Забележителната черта на нашия случай обаче е, че пациентите имат непрогресивна атаксия без класическите симптоми на сидеробластична анемия. Изкушаващо е да се предположи, че това се дължи на уникалното местоположение на мутацията в ABCB7. Алтернативно, заличаването на N-крайната част на ATP7A може потенциално да има роля в модифицирането на генетичния фактор.
ABCB7 протеинът се състои от шест трансмембранни домена и две интрамитохондриални области, образуващи NBD (допълнителна фигура 3А). Локализира се във вътрешната митохондриална мембрана, както и върху цитоплазмената мембрана и в цитоплазмата. 30 ABCB7 има важна роля в съзряването на цитозолни и митохондриални Fe-S клъстерни протеини, засягащи функцията на цитохрома ° С, NADH дехидрогеназа (никотинамид аденин динуклеотид, намалената форма) и сукцинат дехидрогеназа. Той участва в възстановяването на ДНК и възстановяването на ексцизия на нуклеотиди, в възстановяването на окислителни увреждания на ДНК, в биогенезата на рибозомите и тиомодификацията на тРНК. 31 Мутацията на ABCB7 протеин при нашите пациенти се намира в домейна, обърнат към вътрешното митохондриално пространство. Всички други описани до момента мутации, причиняващи рефрактерна анемия и атаксия, се локализират близо или в трансмембранните домейни. 20, 32, 33, 34, 35, 36 Като такава, тази мутация може да повлияе на нейната активност или свързване с други ко-фактори, тъй като ABCB7 контролира митохондриалния транспорт на желязо и свързването на протопорфирин по време на синтеза на хемоглобина. 20,32,33,36
Психичните и неврологичните симптоми са различни при пациенти с описани мутации в ABCB7 ген. Депресията, когнитивният спад или интелектуалните увреждания и дори шизофренията са описани за някои пациенти (допълнителна таблица 9). Неврологичните прояви в засегнатите членове на семейство Бурят демонстрират някои общи черти с ABCB7 свързани с мутация симптоми в други случаи, като церебеларна атаксия, липса на мускулна слабост и дефицит на усещане (допълнителна таблица 9). Както се вижда от ЯМР в случая със семейство Бурят, мозъчната атрофия е локализирана най-вече в малките полукълба на малкия мозък и вермисите. Въпреки това не успяхме да открием аномалии в други региони, включително пон и медула, показани в други случаи. 34
15% от пациентите с МД. 39 По този начин е изкушаващо да се предположи, че при мъжете, носещи ATP7A заличаването на първия MBD, останалите пет медни свързващи домена ефективно се използват, за да запазят функцията на ATP7A.
Не можем да изключим, че дисфункцията в ABCB7 и умерено модифицираната активност на ATP7A могат взаимно да повлияят на хомеостазата в някои тъканни клетки, тъй като нарушаването на ABCB7 може да причини натрупване на железни йони в митохондриите, докато мутация на ATP7A транспортер може да повлияе на нивата на медни йони в клетъчната цитоплазма. Недостигът на желязо увеличава чревната експресия на ATP7A 40 и нивата на мозъка в мозъка. 41 Известно е, че медта регулира използването на желязо в костния мозък и синтеза на хемоглобин. 42, 43, 44, 45 Важно е и двете ABCB7 и ATP7A гените се експресират в костния мозък 26, 46 и в различни тъкани (Illumina Human Body Map 2.0), 26, 46, 47 (допълнителна фигура 5). Като се има предвид взаимното регулаторно влияние на поглъщането на мед и желязо, клиничният фенотип, описан при пациентите от Бурят, може да зависи от предполагаемото взаимодействие на генетични дефекти в два гена за MBP в някои тъканни клетки, интересен случай на синдром, наследен като Х-свързан моногенна черта. Ние обаче твърдим, че основната причина за церебеларна хипоплазия и клиничният фенотип на атаксия при тези пациенти е причинена от тази нова мутация в ABCB7 ген.
- Анализът на транскриптом идентифицира стабилна програма за генна експресия в чревния тракт на мишката
- Диетата за кръвна група е развенчана или има генна храна
- Какво е йога за динамично секвениране
- Съветският роман История като ритуал - PDF безплатно изтегляне
- Ефективност при загуба на тегло на нова мобилна платформа за доставка на програма за профилактика на диабета с хора