Ксиронг Женг
център за молекулярно моделиране и биофармацевтика, Фармацевтичен колеж, Университет в Кентъки, 789 South Limestone Street, Lexington, KY 40536
b Катедра по фармацевтични науки, Фармацевтичен колеж, Университет в Кентъки, 789 South Limestone Street, Lexington, KY 40536
Джин Денг
център за молекулярно моделиране и биофармацевтика, Фармацевтичен колеж, Университет в Кентъки, 789 South Limestone Street, Lexington, KY 40536
b Катедра по фармацевтични науки, Фармацевтичен колеж, Университет в Кентъки, 789 South Limestone Street, Lexington, KY 40536
Тинг Джанг
център за молекулярно моделиране и биофармацевтика, Фармацевтичен колеж, Университет в Кентъки, 789 South Limestone Street, Lexington, KY 40536
b Катедра по фармацевтични науки, Фармацевтичен колеж, Университет в Кентъки, 789 South Limestone Street, Lexington, KY 40536
Jianzhuang Yao
център за молекулярно моделиране и биофармацевтика, Фармацевтичен колеж, Университет в Кентъки, 789 South Limestone Street, Lexington, KY 40536
b Катедра по фармацевтични науки, Фармацевтичен колеж, Университет в Кентъки, 789 South Limestone Street, Lexington, KY 40536
Fang Zheng
център за молекулярно моделиране и биофармацевтика, Фармацевтичен колеж, Университет в Кентъки, 789 South Limestone Street, Lexington, KY 40536
b Катедра по фармацевтични науки, Фармацевтичен колеж, Университет в Кентъки, 789 South Limestone Street, Lexington, KY 40536
Чан-Го Жан
център за молекулярно моделиране и биофармацевтика, Фармацевтичен колеж, Университет в Кентъки, 789 South Limestone Street, Lexington, KY 40536
b Катедра по фармацевтични науки, Фармацевтичен колеж, Университет в Кентъки, 789 South Limestone Street, Lexington, KY 40536
Свързани данни
Резюме
В това проучване е тествана дългодействаща кокаинова хидролаза, известна като CocH3-Fc (M3), създадена от човешка бутирилхолинестераза (BChE), за потенциалните й ефекти срещу затлъстяването. Мишките с високо съдържание на мазнини получават значително по-малко телесно тегло, когато се третират седмично с 1 mg/kg CocH3-Fc (M3) в сравнение с контролните мишки, въпреки че приемът на храна е сходен. Няма връзка между средното телесно тегло и средния прием на храна, което е в съответствие с наблюдаваното по-рано наблюдение при нокаутиращи мишки BChE. В допълнение беше проведено молекулярно моделиране, за да се разбере как грелинът се свързва с CocH3, показвайки, че грелинът се свързва с CocH3 в подобен режим като свързването на грелин с див тип човешки BChE. Подобният режим на свързваща структура обяснява защо CocH3 има подобна каталитична активност срещу грелин.
Въведение
Грелин, стомашен пептиден хормон, известен като „хормон на глада“, открит през 1999 г. [10], е пептид с 28 аминокиселини (GSSFLSPEHQKAQQRKESKKPPAKLQPR) със Ser3 странична верига, ацилирана от мастна киселина (н-октанова киселина). И така, грелинът е н-октаноилиран пептид. 28-аминокиселинният пептид без ацилиране (n-октаноилиране) е известен като дезацил-грелин [11]. Тази реакция на ацилиране, катализирана от ензим, известен като грелин О-ацилтрансфераза (GOAT), е от съществено значение за физиологичната активност на грелин с рецептори на секретагога на растежния хормон (GHSRs) в централната нервна система, които медиират хиперфагия и затлъстяване [12]. Смята се, че грелинът се произвежда в стомаха и се освобождава предимно от клетките в стомаха и пътува до мозъка чрез кръвообращението. В мозъка грелинът взаимодейства както с хипоталамуса (физиологичен център за хранене), така и с центровете за удоволствие на мозъка, за да събуди глад [13]. Досега грелинът е единственият известен хормон, стимулиращ глада и приема на храна [1], който ви казва кога да ядете. Освен това нивото на грелин естествено се променя драстично през деня. По-специално, нивото на грелин се повишава рязко с гладуване или преди хранене и намалява след хранене [13]. Следователно грелинът се очертава като нова, потенциално атрактивна цел за борба със затлъстяването [7].
Усилията за откриване на наркотици, централизирани върху грелина, имат за цел да намалят апетита на хората с наднормено тегло чрез различни подходи, включително регулиране на освобождаването на грелин, антагонизъм на грелин рецептора и намаляване на активното производство на грелин чрез инхибиране на GOAT [14–18]. Тези усилия обаче все още не са генерирали клинично полезно лекарство досега.
В светлината на гореспоменатите физиологични и биологични механизми на грелин, идеалният терапевтичен подход би директно инактивирал самия грелин и би превърнал грелина в пептидна форма (дезацил-грелин), която е лишена от индуциращи апетита свойства чрез използване на ефективен ензим, метаболизиращ грелин. Например, инхибирането на GOAT би намалило производството на (активен) грелин, но не може да инактивира грелин, който вече е произведен в организма. Ензимът, метаболизиращ грелин, би директно инактивирал грелина, като го преобразува в дезацилгрелин и по този начин по-ефективно намалява апетита. Въпреки обширните усилия, които имат за цел да регулират нивото на грелин в организма, няма доклад за терапевтичен кандидат, който може да се използва за директно инактивиране на грелин чрез превръщане на грелин в дезацил-грелин.
Демонстрирано е също, че по-обещаващият CocH3 е способен ефективно да разгражда не само самия кокаин, но и неговите токсични метаболити (норкокаин и кокаетилен) [34, 35]. Наскоро разработихме, подготвихме и тествахме дългодействаща CocH3 форма [36], слят протеин, в който CocH3 е слят с N-края на троен мутант (т.е. A1V/D142E/L144M) от Fc региона на човешки имуноглобулин G1 (IgG1). Полученият синтетичен протеин, означен като CocH3-Fc (M3) и разглеждан като аналог на каталитично антитяло, е толкова активен, колкото и некондензираният CocH3 по отношение на каталитичната активност (тъй като Fc сливането не се очаква да промени каталитичната активност на CocH3 срещу всеки субстрат), но има значително по-дълъг биологичен полуживот (напр. t1/2 =
107 часа при плъхове) като антитяло [36]. В тестовете за поведение на животните, една доза CocH3-Fc (M3) успява да ускори метаболизма на кокаин при плъхове дори след 20 дни и по този начин блокира индуцираната от кокаин хиперактивност и токсичност за дълъг период [36].
Освен това, въз основа на обещаващите предклинични данни за лечение на злоупотреба с кокаин [36] и наскоро докладваната каталитична активност на CocH3 срещу грелин [33], бихме искали да знаем дали многократното дозиране на CocH3-Fc (M3) може да бъде ефективно за лечение на затлъстяване и защо CocH3 е активен срещу грелин. За тези цели в настоящото проучване изследвахме ефектите от седмичното дозиране на 1 mg/kg CocH3-Fc (M3) върху телесното тегло на мишки C57BL/6, хранени с диета с високо съдържание на мазнини. В допълнение, ние също така извършихме молекулярно моделиране на свързването на CocH3-грелин в сравнение със съответното свързване на човешки BChE-грелин от див тип. Получените данни показват, че CocH3-Fc (M3) наистина е обещаващ за лечение на затлъстяване и че е възможно да се разработи терапевтичен ензим, ефективен за лечение както на злоупотреба с кокаин, така и на затлъстяване.
Материали и методи
Материали
Мъжки мишки C57BL/6 (26–30 g) бяха поръчани от Harlan (Indianapolis, IN). Диета с високо съдържание на мазнини F3282 е поръчана от Bio-Serv (Flemington, NJ). Пречистеният протеин CocH3-Fc (M3), използван в това проучване, беше приготвен в предишното ни проучване [36]. Накратко, CocH3-Fc (M3) протеинът се експресира в стабилни CHO-S клетки (разработени в нашата лаборатория с помощта на метод, базиран на лентивирус), които могат стабилно да произвеждат CocH3-Fc (M3) протеин. Производството на протеин се извършва в разбъркан биореактор BioFlo/CelliGen 115 (Eppendorf, Hauppauge, NY). CocH3-Fc (M3) в хранителната среда се пречиства чрез използване на гореспоменатата афинитетна хроматография на протеин A, която се извършва върху система ÄKTA Avant 150 (GE Healthcare Life Sciences, Pittsburgh, PA). Пречистеният протеин се диализира в буфер за съхранение и се съхранява при -80 ° С преди употреба.
Тестове върху животни
Мъжки мишки C57BL/6 получиха диета с високо съдържание на мазнини F3282 и вода ad libitum и се поддържаха в 12-часов светлинен/12-часов тъмен цикъл, с включени светлини в 8:00 сутринта при стайна температура 21–22 ° C. Експериментите бяха проведени в същата стая в колонията в съответствие с Ръководството за грижа и използване на лабораторни животни, прието и обнародвано от Националните здравни институти. Мишките бяха разделени на случаен принцип в две групи. Мишките в третираната група (n = 7) се прилагат интравенозно (IV) с буферен разтвор (буфериран с фосфат физиологичен разтвор), съдържащ 1 mg/kg CocH3-Fc (3M) веднъж седмично, т.е. IV приложение на 1 mg/kg CocH3-Fc (3M) в дни 0, 7, 14, 21, 28, 35 и 42. На мишките от контролната група (n = 5) се прилага IV интравенозно със същия буферен разтвор без ензима веднъж седмично. И така, единствената разлика в инжектирания разтвор между двете групи е съществуването на 1 mg/kg CocH3-Fc (3M) за третираната група. Мишките в двете различни групи бяха поставени в клетки отделно. Теглото на тялото се записва ежедневно в продължение на 44 дни и приемът на храна се измерва чрез претегляне на сервираната храна и останалата храна във всяка клетка.
Молекулярно моделиране
Метод на стохастична гранична молекулярна динамика (MD) [44] беше използван с кислородния атом (Oγ) на страничната верига Ser198 като референтен център. Реакционната област представлява сфера с радиус (r) 20 Å, а буферната зона се простира над 20 Å ≤ r ≤ 22 Å. Всички атоми, разположени по-дълго от 22 Å от хидроксилния кислород на Ser198 страничната верига на ензима, бяха фиксирани. Всички връзки, включващи водородни атоми, бяха ограничени с помощта на алгоритъма SHAKE [45]. Първоначалната структура за цялата стохастична гранична система беше оптимизирана с помощта на методите на най-стръмното спускане (SD) и възприетите от Нютон-Рафсън (ABNR) методи. За интегриране на уравнението на движението беше използвана стъпка от 1 fs време. Солватираната система на ензимно-грелиновия комплекс постепенно се нагрява от 50,0 K до 298,15 K в MD симулация за 100 ps и след това се произвежда MD, докато траекторията на MD стане стабилна (за поне 1 ns). Последната снимка на стабилната траектория на MD беше минимизирана чрез използване на метода ABNR, за да се генерира окончателната структура на свързващия ензим-грелин комплекс за анализ на режима на свързване.
Резултати
Ефекти на CocH3-Fc (M3) върху телесното тегло и приема на храна
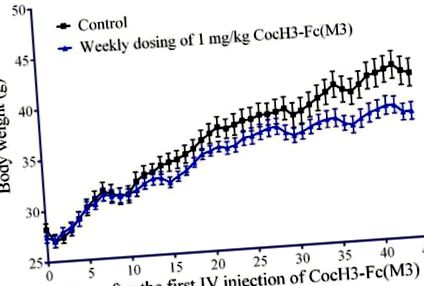
Както е показано на Фигура 1, средното телесно тегло на диети, хранени с високо съдържание на мазнини в третираната група (n = 7) не се различава значително от това в контролната група (n = 5) през първите 10 дни. След 11 дни средните телесни тегла се различават между двете групи и разликата става все по-голяма. Данните показват, че седмичното дозиране на 1 mg/kg CocH3-Fc (M3) оказва значително влияние върху телесното тегло на диети, хранени с високо съдържание на мазнини. За отбелязване е, че ензимът не е повлиял значително средното телесно тегло на диети, хранени с високо съдържание на мазнини през първите 10 дни, но ефектът на ензима върху средното телесно тегло става значителен след 11 дни.
Телесно тегло на диети, хранени с високо съдържание на мазнини. На мишките в третираната група (n = 7) се прилага (IV) с буферен разтвор, съдържащ 1 mg/kg CocH3-Fc (3М) веднъж седмично. На мишките от контролната група (п = 5) се прилага IV интравенозно със същия буферен разтвор без ензима.
Също така се опитахме да идентифицираме възможната връзка между средното телесно тегло и средния дневен прием на храна на диети, хранени с високо съдържание на мазнини. Изненадващо, няма значителна разлика в средния прием на храна между двете групи, както е показано на Фигура 2. Средният дневен прием на храна в периода на наблюдение (44 дни) винаги е бил
3,0 g на мишка за двете групи. Така че, CocH3-Fc (M3) не оказва значително влияние върху общия прием на храна на ден. Според тези резултати общият прием на храна на ден не е единственият фактор, влияещ върху телесното тегло, и няма връзка между средното телесно тегло и средния прием на храна на ден. Тези данни са в съответствие с предишното наблюдение, съобщено от Lockridge et al. [20]. Те наблюдават, че нокаутиращите мишки BChE са с наднормено тегло на диета с високо съдържание на мазнини и че нокаутиращите мишки BChE не консумират повече храна в сравнение с мишки от див тип [20]. Въз основа на наблюдението, Lockridge et al. [20] стигна до заключението, че увеличаването на теглото на нокаутиращите мишки BChE е резултат на намалено използване на мазнини, а не на увеличен прием на храна. Нашите данни за приложението на ензими в това проучване допълнително подкрепят тяхното заключение.
Среден прием на храна (g на мишка) на диети, хранени с високо съдържание на мазнини. На мишките в третираната група (n = 7) се прилага (IV) с буферен разтвор, съдържащ 1 mg/kg CocH3-Fc (3М) веднъж седмично. На мишките от контролната група (п = 5) се прилага IV интравенозно със същия буферен разтвор без ензима.
Свързване на ензим-грелин
За да се разбере защо CocH3 е подобен на човешки BChE от див тип в каталитичната ефективност срещу грелин, беше проведено молекулярно моделиране на свързване на грелин както с CocH3, така и с човешки BChE от див тип. Получените свързващи ензим-грелин структури са изобразени на фигура 3. Както е показано на Фигура 3 (А), грелинът се свързва с BChE в режим, подходящ за хидроксилен кислород (O γ) на Ser198 страничната верига на BChE, за да инициира нуклеофилна атака при карбонилния въглерод (C) върху n-октаноилираната странична верига Ser3 на грелин, като C-O γ разстоянието е
3.04 Å. Междувременно карбонилният кислород на n-октаноилираната Ser3 странична верига на грелин е в оксианионната дупка (състояща се от гръбначните NH групи на Gly116, Gly117 и Ala199 на BChE), със стабилна водородна връзка с Gly117 гръбначния NH група на BChE (с N ··· H разстояние 2.02 Å). Както е показано на Фигура 3 (Б), режимът на свързване на CocH3-грелин е много подобен на свързването на BChE-грелин, като разстоянието C-O γ е
3.26 Å (около 0.22 Å по-дълго). Карбонилният кислород на n-октаноилираната Ser3 странична верига на грелин също е в оксианионната дупка на CocH3, с малко по-слаба водородна връзка с Gly117 основна NH група на CocH3 (с N ··· H разстояние 2,20 Å) в сравнение с човешкият BChE от див тип. Подобният режим на свързване ензим-грелин ни помага да разберем защо CocH3 има подобна каталитична активност срещу грелин.
Свързващи ензим-грелин структури, получени от симулации на молекулярна динамика и минимизиране на енергията. (A) Див тип човешки BChE свързване с грелин. (B) CocH3 свързване с грелин. Изобразени на фигурата са само остатъци от ензима и грелин близо до активното място, в което голямата жълта маса представлява повърхността на ван дер Ваалс на грелин.
Дискусия
Известно е, че CocH3-Fc (M3), дългодействаща форма на CocH (човешки BChE мутант със значително подобрена каталитична ефективност срещу кокаин), е много ефективен за лечение на злоупотреба с кокаин. Настоящото проучване допълнително демонстрира потенциалния ефект на затлъстяване на CocH3-Fc (M3) за първи път. Следователно CocH3-Fc (M3) може да бъде ценен за лечение не само на злоупотреба с кокаин, но и на затлъстяване, което е добра новина за развитието на ензимна терапия, базирана на CocH (BChE мутант). От друга страна, потенциалният ефект срещу затлъстяване на CocH3-Fc (M3) може да бъде умерен поради относително ниската си каталитична ефективност срещу грелин в сравнение с тази срещу кокаина. По-нататъшното развитие на ензимна терапия, основано на CocH, трябва да бъде фокусирано върху рационалния дизайн на вариант на CocH3-Fc (M3) със значително подобрена каталитична ефективност срещу грелин, без да се намалява каталитичната ефективност срещу кокаин. Такъв вариант на CocH3-Fc (M3) може да бъде ефективен при хидролизиране както на кокаин, така и на грелин и следователно може да бъде високо ефективен за лечение както на злоупотреба с кокаин, така и на затлъстяване. Освен това получената свързваща структура на CocH3-грелин може да се използва като отправна точка за бъдещ рационален дизайн на желания вариант на CocH3-Fc (M3).
Заключения
Доказано е, че CocH3-Fc (M3) може значително да повлияе на телесното тегло на диетата с високо съдържание на мазнини, но не и на общия прием на храна на ден. Няма връзка между средното телесно тегло и средния прием на храна, което е в съответствие с наблюдаваното по-рано наблюдение при нокаутиращи мишки BChE. Освен това, в светлината на молекулярното моделиране, грелинът се свързва с CocH3 в подобен режим като свързването на грелин с див тип човешки BChE, което обяснява защо CocH3 има подобна каталитична активност срещу грелин в сравнение с човешки BChE от див тип. Полученият режим на свързване ензим-грелин може да се използва като отправна точка за бъдещо рационално проектиране и откриване на вариант CocH3-Fc (M3) със значително подобрена каталитична ефективност срещу грелин, без да се намалява каталитичната ефективност срещу кокаин.
Акценти в научните изследвания
Седмичното дозиране на CocH с продължително действие значително повлиява телесното тегло на мишките.
Седмичното дозиране на CocH с продължително действие не повлиява приема на храна от мишките.
Грелин се свързва с CocH и див тип човешки BChE в подобен режим на свързване.
CocH може да бъде ценен за лечение не само на злоупотреба с кокаин, но и на затлъстяване.
- Новият екстракт от горчив пъпеш показва метаболитни и анти-затлъстяващи ефекти Проучване
- Потенциални Gotu Kola ползи за здравето Странични ефекти - SelfHacked
- Употреба на панкреатин, странични ефекти, потенциални лекарствени взаимодействия
- Риган за здравето ползи, употреби и странични ефекти
- Комбинацията орлистат-акарбоза може да улесни загубата на тегло с по-малко GI ефекти спрямо