Магдалена Степиен
1 INRA/AgroParisTech, CNRH-IdF, UMR914 Хранителна физиология и поглъщащо поведение, Париж, Франция,
2 INRA, CNRH-IdF, UMR914 Хранителна физиология и поглъщащо поведение, Париж, Франция,
Клер Годишон
1 INRA/AgroParisTech, CNRH-IdF, UMR914 Хранителна физиология и поглъщащо поведение, Париж, Франция,
2 INRA, CNRH-IdF, UMR914 Хранителна физиология и поглъщащо поведение, Париж, Франция,
Жил Фроментин
1 INRA/AgroParisTech, CNRH-IdF, UMR914 Хранителна физиология и поглъщащо поведение, Париж, Франция,
2 INRA, CNRH-IdF, UMR914 Хранителна физиология и поглъщащо поведение, Париж, Франция,
Патрик Дори
1 INRA/AgroParisTech, CNRH-IdF, UMR914 Хранителна физиология и поглъщащо поведение, Париж, Франция,
2 INRA, CNRH-IdF, UMR914 Хранителна физиология и поглъщащо поведение, Париж, Франция,
Даниел Томе
1 INRA/AgroParisTech, CNRH-IdF, UMR914 Хранителна физиология и поглъщащо поведение, Париж, Франция,
2 INRA, CNRH-IdF, UMR914 Хранителна физиология и поглъщащо поведение, Париж, Франция,
Далила Azzout-Marniche
1 INRA/AgroParisTech, CNRH-IdF, UMR914 Хранителна физиология и поглъщащо поведение, Париж, Франция,
2 INRA, CNRH-IdF, UMR914 Хранителна физиология и поглъщащо поведение, Париж, Франция,
Замислил и проектирал експериментите: CG DAM. Изпълнени експерименти: MS CG PE DAM. Анализирани данни: GF PE DT DAM. Реактиви/материали/инструменти за анализ, допринесени: GF DT. Написа хартията: MS DT DAM.
Резюме
Въведение
Хомеостазата на хранителните вещества в тялото е под контрола на хормонални и метаболитни адаптации и включва промени в експресията на гени, чувствителни към диетичните и хранителни условия (Waterlow, 1981 FAO). Повишаването на протеините за сметка на въглехидратите е предложено като стратегия за програми за отслабване заедно с препоръки за редовни умерени упражнения. Високопротеиновите диети насърчават отслабването, като допълнително щадят чистата телесна маса [1], [2], [3], [4] и намаляват риска от сърдечно-съдови заболявания при здрави и затлъстели жени [5], [6]. Тези ефекти обикновено се дължат на високата силна сила на протеините [1], [7], но също така и на специфични адаптации на метаболитните пътища, участващи в протеиновия и енергийния метаболизъм. В резултат на това има нужда от по-добро разбиране на метаболитната адаптация, предизвикана от увеличаване на съдържанието на протеини в диетата.
Адаптацията към увеличения прием на протеини първо включва механизми, които позволяват да се справим с драстичното увеличаване на доставката на аминокиселини в тялото чрез увеличаване на пътищата, свързани с елиминирането на амоняка и поддържането на азотния баланс [8]. При плъхове и хора високият прием на протеини насърчава окисляването на протеините, намалява или не променя окисляването на въглехидратите, засилва и поддържа окисляването на липидите [9], [10], [11], [12], [13], [14], в зависимост относно състава на диетата [15]. Катаболизмът на аминокиселините се увеличава [16], [17], заедно с активирането на ензимите на урейния цикъл [18], [19], [20]. Също така беше показано, че приемът на протеини води до отрицателен мастен баланс [21], [22], намаляване на експресията на липогенни ензими [23], [24] и намаляване на изхвърлянето на глюкоза от мастните тъкани [25], [ 26], което може да възникне от намален инсулинов отговор след намалено съотношение въглехидрати и протеини. Установено е също така, че аминокиселините могат да подхранват глюконеогенезата, когато се доставят в изобилие дори в хранено състояние [27]. Поради тези причини се съобщава, че диетите с високо съдържание на протеини имат положителен ефект върху хомеостазата на глюкозата при плъхове [24], [25] и хора [28].
В настоящото проучване ние се опитахме да охарактеризираме хода на метаболитните промени, които се развиват по време на двуседмична адаптация от нормална диета с високо съдържание на протеини/високо съдържание на въглехидрати към изокалория. Изследвахме експресията на основните гени, участващи в регулирането на енергийните пътища в няколко органа, участващи в трансфера на аминокиселинни субстрати към енергийния метаболизъм, заедно с промените в панкреатичните хормони и усвояването на чернодробната глюкоза. Успоредно с това проведохме калориметрично проучване, за да потвърдим in vivo метаболитните ориентации, предложени от резултатите от генната експресия.
Резултати
Телесно тегло, гликемия, чернодробен гликоген и панкреатични хормони
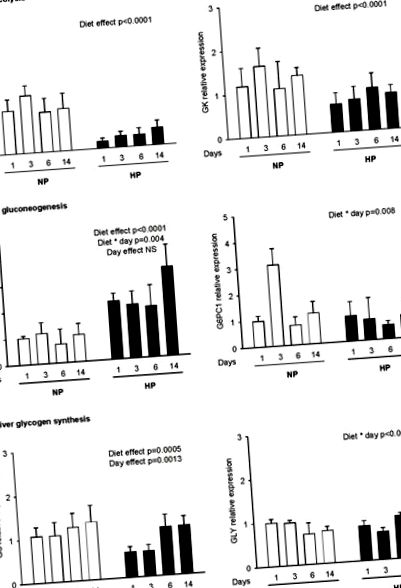
Експресията на гена беше определена за ключовите ензими, участващи в: (а) гликолиза (L-PK, GK), (б) глюконеогенеза (PEPCK, G6PC1) и (в) гликогеногенеза (гликогенин, GS) 2 часа след прием на калибрирано хранене състоящ се от 4 g NP или HP диета за плъхове, хранени преди това с нормална или високобелтъчна диета за 1, 3, 6 и 14 дни (NP1, NP3, NP6, NP14 и HP1, HP3, HP6, HP14, съответно). Нивата на тРНК бяха измерени чрез RT-PCR в реално време и изразени в сравнение с референтния ген (18S). Данните са изразени като средни стойности ± SEM спрямо NP1 (n = 5). Статистическите разлики (P фигура 1б и таблица 2 ). В бъбреците не са наблюдавани значителни промени между плъхове, хранени с NP и HP ( Таблица 2 ). В черния дроб експресията на гена PEPCK е по-висока при HP, отколкото при плъховете NP ( Фигура 1б ). На 14-ия ден експресията на гена PEPCK се увеличава четирикратно в HP14 в сравнение с плъховете NP14 (3,38 ± 0,83 срещу 1,02 ± 0,42 съответно). За разлика от това, G6PC1 тРНК не е повлияна нито от диетата, нито от продължителността на адаптацията ( Фигура 1б ), въпреки че наблюдавахме взаимодействие между диетите и деня поради преходно увеличение след 3 d при плъхове NP.
Таблица 2
| Ензимна експресия | Тъкани | NP14 | HP14 | |
| Метаболизъм на глюкозата | ||||
| Синтез на гликоген | GS1 | Коремчест мускул | 9,81 ± 0,89 | 10,53 ± 0,92 |
| Солеус | 5,22 ± 1,44 | 9,14 ± 4,09 | ||
| GYG1 | Коремчест мускул | 8,08 ± 0,74 | 8,36 ± 0,33 | |
| Солеус | 6,70 ± 2,99 | 5,95 ± 2,66 | ||
| Глюконеогенеза | PEPCK | Бъбреци | 45,16 ± 5,86 | 48,53 ± 1,66 |
| G6PC1 | Бъбреци | 2,52 ± 3,65 | 3,65 ± 0,57 | |
| Липиден метаболизъм | ||||
| Липогенеза | ACC | Епидидимална мастна тъкан | 41,1 ± 14,4 | 54,1 ± 4,8 |
| Ретроперитонеална мастна тъкан | 100,2 ± 2,9 | 104,1 ± 15,4 | ||
| FAS | Епидидимална мастна тъкан | 39,2 ± 5,7 | 30,2 ± 7,9 | |
| Ретроперитонеална мастна тъкан | 95,6 ± 15,1 | 98,10 ± 11,3 | ||
| Липолиза | HSL | Епидидимална мастна тъкан | 0,09 ± 0,02 | 0,12 ± 0,01 |
| Ретроперитонеална мастна тъкан | 0,51 ± 0,10 | 0,23 ± 0,05 * | ||
| β-окисление | CPT1b | Коремчест мускул | 18,27 ± 2,31 | 13,15 ± 2,75 |
| Солеус | 11,57 ± 2,82 | 13,69 ± 1,82 | ||
| ACOX1 | Коремчест мускул | 5,94 ± 0,89 | 4.47 ± 0.51 | |
| Солеус | 1,06 ± 0,19 | 1,61 ± 0,20 | ||
| βHAD | Коремчест мускул | 1,43 ± 0,13 | 1,33 ± 0,15 | |
| Солеус | 1,47 ± 0,25 | 1,20 ± 0,10 | ||
Профил след хранене на липидното съдържание и експресия на ген, участващ в липидния метаболизъм
За да се оценят промените в контрола на липогенезата, в черния дроб и мастната тъкан се измерва експресията на AcetylCoAcarboxylase (ACC) и и синтаза на мастни киселини (FAS). Състоянието на активиране на липолизата и ß-оксидацията се оценява чрез експресия на HSL (хормоночувствителна липаза) в мастната тъкан и експресия на CPT1, βHAD и ACOX1 в черния дроб и мускулите ( фигура 2 и таблица 2 ), съответно.
Експресията на гена беше определена за ключовите ензими, участващи в (а) липогенеза (ACC, FAS) и (б) липидно окисление (CPT1, ACOX1, HAD) 2 часа след прием на калибрирано хранене, състоящо се от 4 g NP или HP диета за плъхове, хранени с нормална или високобелтъчна диета за 1, 3, 6 и 14 дни (NP1, NP3, NP6, NP14 и HP1, HP3, HP6, HP14, съответно). Нивата на тРНК бяха измерени чрез RT-PCR в реално време и изразени в сравнение с референтния ген (18S). Данните са изразени като средни стойности ± SEM спрямо NP1. Статистическите разлики (стр Фигура 2а ). В допълнение, сравним с това, което се наблюдаваше по-рано за ген, кодиращ гликолитични ензими, експресията на ACC и FAS беше по-инхибирана в началото на хранене с НР (около 4 пъти за двата гена), отколкото след две седмици, време, в което намалението беше само 2.2 и 1.6 пъти съответно за ACC и FAS и води до същото съдържание на чернодробни триглицериди (22,9 ± 11,6 mg/g при плъхове, хранени с NP и 17,0 ± 11,6 mg/g от черен дроб при плъхове, хранени с HP, съответно). В мастната тъкан, храненето с НР не влияе на експресията на ACC и FAS ( Таблица 2 ), нито мастния триглицерид (904,4 ± 93,25 и 902,9 ± 109,8 mg/g за HP14 и NP14, съответно) и глицерол (8,9 ± 7,2 и 12,4 ± 13,3 mg/g за HP14 и NP14, съответно) съдържание.
ß-оксидация: Не се наблюдава ефект върху окисляването на мастните киселини в черния дроб. Експресията на гени за CPT1, ßHAD и ACOX1 не се различава при хранени с NP и HP животни ( Фигура 2б ). В мускулите на солеус и гастрокнемиус експресията на CPT1b, ACOX1 и βHAD също е непроменена след две седмици HP диета ( Таблица 2 ). Въпреки това, в ретроперитонеалната мастна тъкан, чувствителната към хормони липаза (HSL), генната експресия значително намалява при HP плъхове (p = 0,04), но не и в епидидималната мастна тъкан ( Таблица 2 ).
Разход на енергия, окисляване на макронутриенти и хранителен баланс
Разходът на енергия и окисляването на хранителни вещества са изследвани близо до термонеутралността (27 ° C) при плъхове, хранени с NP диета за една седмица (NP) и по време на последващото адаптиране към HP диета на 1-ви, 3-ти, 6-и и 14-ия ден.
Балансът на макроелементите се оценява през 4-часовия период за общ метаболизъм след прием на калибрирано хранене, състоящо се от 4 g адекватна диета. Балансът се изчислява като разлика между абсорбирания макронутриент и окисления макронутриент. Плъховете бяха хранени с нормална протеинова (NP) диета в продължение на една седмица и след това преминаха към HP диета за 0, 1, 3, 6 и 14 дни (NP, HP1, HP3, HP6, HP14, съответно). Данните са средни ± SEM. Значимостта се определя от еднопосочна ANOVA (P фигура 5 ). Тези адаптации се характеризират главно с увеличаване на използването на аминокиселини, което е паралелно с намаляването на използването на глюкоза. Въпреки това, с напредването на адаптацията, изхвърлянето на глюкоза в окислителните пътища постепенно се увеличава в отговор на повишената регулация на неоглюкогенните пътища и възстановяването на гликогенните пътища, както се предполага от модификациите на генната експресия. От друга страна, иРНК, кодиращи ензими, участващи в липидния метаболизъм, предполагат, че окисляването на мастните киселини не е значително модифицирано, но свързаното с глюкоза производство на новомастни киселини de novo (липогенеза) се регулира бързо и трайно надолу. Ние правим хипотезата, че това намаляване трябва да се разглежда като основен фактор за намаляването на мастната маса, отчетено при високо протеинови диети.
По-високото съдържание на протеини в диетата повишава окисляването на протеини и производството на урея. Първата регулирана стъпка на глюконеогенезата беше регулирана нагоре (PEPCK), но не и последната (G6PC1). С по-ниско съдържание на СНО в диетата, окислението на глюкоза и съдържанието на гликоген в черния дроб намаляват едновременно с експресията на гликолитични гени (GK, LPK), предизвиквайки по-ниска липогенеза (ACC, FAS). Стабилното съдържание на мазнини в диетата не е причинило промени в β-окисляването (CPT1, ACOX1, βHAD), което е било временно увеличено само след първия ден от HP диета.
Промените в метаболизма на глюкозата и аминокиселините могат да обяснят подобрената глюкозна хомеостаза след заместване на въглехидратите с протеини в диетата, както се наблюдава от други [24], [30], [41] и прегледани от Leyman и Baum [42]. В същото време регулирането на гликолизата надолу индуцира намаляване на липогенезата в черния дроб и мастната тъкан [43], [44]. Всъщност нивата на иРНК на липогенни ензими (ACC, FAS) бяха понижени чрез HP хранене веднага след първия ден в черния дроб, докато в мастните тъкани не се наблюдава промяна. От друга страна, не наблюдавахме значителни промени в генната експресия, кодираща ензимите, участващи в липидното окисление (CPT1, ACOX1 и βHAD), и няма промени в липидната окисленост, както се измерва директно чрез индиректна калориметрия. Освен това експресията на HSL, която е ензимът, отговорен за освобождаването на мастни киселини от мастната тъкан, не е променена в подкожната мастна тъкан и е намалена два пъти в ретроперитонеалната, което е в съответствие с липсата на регулиране на нагоре на иРНК, кодиращи ензими за β-окисление в черния дроб или мускулите. Съответно регулирането надолу на чернодробната липогенеза е може би основният процес, участващ в намаленото затлъстяване на плъхове, хранени с HP.
Взети заедно, нашите резултати демонстрират адаптиране на хода на енергийния метаболизъм с цел адаптиране към повишен прием на протеини за сметка на въглехидратите. Тази адаптация включва увеличен принос на аминокиселините към енергийните разходи и за ново производство на чернодробна глюкоза. Последният, заедно с намалените иРНК, кодиращи ензими, участващи в гликолизата и липогенезата, участва в адаптирането на глюкозната хомеостаза към намаленото снабдяване с хранителна глюкоза. Освен това, по-малко отрицателният въглехидратен баланс, наблюдаван след две седмици на адаптация, може да доведе до по-ниското му изхвърляне под формата на мазнини, което от своя страна, заедно с намалена експресия на липогенен ензим (ACC и FAS), докато експресията на липидното окисление на гените и енергийните разходи остават непроменени при HP диета, може да обясни по-ниския прираст на мазнини, който обикновено се наблюдава при субекти, хранени с HP диети.
Материали и методи
Животни и диети
Експерименталният протокол беше одобрен от Френския национален комитет за грижа за животните. Бяха проведени две отделни проучвания, едното посветено на профилите на генната експресия и едно на измерването на дихателния обмен. Осемдесет мъжки плъхове Wistar (Harlan, Франция), с първоначално телесно тегло 160–180 g, бяха настанени поотделно в помещение с контролирана температура (22 ° C ± 1) с 12-часов обратен цикъл светлина/тъмнина (Светва в 18: 00). Животните бяха хранени с нормална протеинова диета (NP) през първата седмица и след това бяха назначени или с високо протеинова (HP), или с нормална протеинова диета (NP) за 1, 3, 6 и 14 дни (виж по-долу). Диетите NP и HP съдържаха 14% и 50% от общия млечен протеин като енергия ( Таблица 3 ), съответно. Диетите са изготвени от “Unité de préparation des aliments”, INRA, Jouy-en-Josas, Франция, в съответствие с изискванията на AIN-93M [50]. Съдържанието на протеини в диетите се обменя изоенергетично за нишесте и захароза и съдържанието на мазнини се поддържа постоянно. Плъховете имаха непрекъснат безплатен достъп до вода, но бяха свикнали да получават храната в два периода по време на тъмната фаза: ограничено количество от 4 g от диетата от 9:00 до 9:30, което беше напълно консумирано, след това безплатен достъп до диета между 12:00 и 18:00. Теглото на тялото се измерва ежедневно в 18:00.
- ILD Nutrition Manual Увеличаване на протеина във вашата диета UCSF здраве
- Диета с високо съдържание на протеини 5 пилешки салата Рецепти, които можете да включите във вашата диета - NDTV храна
- Високопротеинов крем от гъбена супа; Добрата диета
- Диетата с високо съдържание на протеини не е толкова лоша за вас, колкото пушенето Nursing Times
- Как да си набавим достатъчно протеини, калций и желязо при растителна диета