Субекти
Резюме
Заден план:
Изследвахме връзката между промяната на теглото през годината преди радикалната простатектомия (RP) и биохимичния рецидив (BCR) и неблагоприятната патология.
Методи:
Абстрахирахме данни от 359 мъже, подложени на RP в базата данни SEARCH (Shared Equal Access Regional онкологична болница) между 2001–2007. Използвани са модели на логистична регресия и пропорционални рискове на Cox за тестване на връзката между промяната на теглото през годината преди операцията и съответно неблагоприятната патология и BCR.
Резултати:
Общо 152 (42%) мъже наддават на тегло, 193 (54%) отслабват и 14 (4%) имат същото тегло. Сред набиращите тегло средно наддаване е 2,4 кг, а сред отслабващите средно загуба е 2,7 кг. Като непрекъсната променлива, промяната на теглото не е свързана с неблагоприятна патология или BCR (всички P> 0,05). При вторичния анализ, при многовариантния анализ, мъжете, наддаващи ⩾ 2,5 kg, са били с по-висок риск от BCR (съотношение на опасностите = 1,65, 95% доверителен интервал (CI): 1,03–2,64, P= 0,04), докато загубата на тегло ⩾ 2,5 kg не е свързана с BCR (съотношение на опасностите = 0,83, 95% CI: 0,54–1,29, P= 0,41).
Заключения:
Като постоянна променлива, промяната на теглото не е свързана с резултата. При анализи, генериращи вторични хипотези, наддаването на тегло ⩾ 2,5 kg през годината преди операцията, независимо от крайния индекс на телесна маса, е свързано с повишен BCR след RP. Ако бъдат потвърдени, тези данни предполагат, че наддаването на тегло ⩾ 2,5 kg може да насърчи прогресията на рака на простатата.
Въведение
Появява се консенсус, че докато затлъстяването намалява риска от диагностициране на рак на простатата (ПК), то е свързано с по-висок риск от агресивно/фатално заболяване. 1, 2, 3, 4 Сред мъжете с PC затлъстяването е свързано с високостепенна болест и биохимичен рецидив (BCR) след радикална простатектомия (RP). 3, 5, 6, 7, 8, 9
Като се има предвид, че затлъстяването е състояние на излишно телесно тегло, не е ясно дали самото състояние на затлъстяване или енергийният дисбаланс, необходим за затлъстяване, са отговорни за по-лошите резултати. В проспективно проучване на 287 760 мъже, самоотчетеното наддаване на тегло между 18-годишна възраст и диагностиката на PC е свързано с повишена смъртност от PC. 4 В ретроспективен преглед на мъже, диагностицирани с PC, подложени на RP, мъжете със средно наддаване на тегло> 1,5 kg годишно между 25-годишна възраст и диагнозата са били с повишен риск от BCR. 3 Ефектът от промяната на теглото обаче не е значителен след контролиране на индекса на телесна маса (ИТМ). Едно проучване се опитва да отдели ефекта от промяната на теглото от затлъстяването върху риска от диагностициране с PC и агресивно заболяване. В потенциална кохорта от 86 404 мъже попитаха теглото си през 1982 г. и през 1992 г. и следвайки развитието на рака след 1992 г., мъжете, загубили £ 11 паунда през десетилетието преди 1992 г., бяха значително по-малко склонни да развият висококачествен компютър срещу мъже със стабилно тегло. 10
При животните ограничаването на калориите (т.е. загубата на тегло) инхибира растежа на PC и подобрява оцеляването. 11, 12 Хипотезите за този ефект включват повишена апоптоза и намалени нива на инсулиноподобен растежен фактор-I (IGF-I). Въпреки това, връзката между излишната енергия (т.е. наддаване на тегло) и растежа на тумора остава неясна.
Докато дългосрочен загубата на тегло може да намали риска от високостепенна болест, само едно проучване до момента е оценило въздействието на промяната на теглото в непосредствения предоперативен период. Това проучване оценява ретроспективно получената промяна на теглото при 1337 мъже, подложени на RP, като идентифицира двукратно повишен риск от BCR при мъже с наддаване на тегло> 2,2 kg през 5-те години преди операцията спрямо мъже със стабилно тегло. 13
Определихме ефекта от предоперативната промяна на теглото през годината преди RP върху неблагоприятната патология и BCR, използвайки базата данни SEARCH (Shared Equal Access Regional Cancer Hospital), която включва мъже, лекувани с RP в множество центрове за равен достъп. 14.
Материали и методи
χ 2 и тестовете на Kruskal – Wallis бяха използвани за оценка на разликите в разпределението на клиникопатологичните характеристики между пациентите, които губят, наддават или са стабилни в теглото си. Предоперативните стойности на PSA бяха изследвани като логарифмично трансформирана непрекъсната променлива. Възрастта и годината на операцията бяха третирани като непрекъснати променливи. Раса (черно, бяло, друго), ИТМ (kg/m 2; ⩾ 35), биопсия Gleason (2–6, 3 + 4, ⩾ 4 + 3), клиничен етап (T1, T2/T3), център, полета, екстракапсуларното удължаване, инвазията на семенните везикули и състоянието на лимфните възли бяха третирани като категорични променливи.
Съотношението на шансовете за патологичните резултати от високостепенна болест (⩾ 4 + 3), положителните граници, инвазията на семенните везикули, екстракапсулното разширение и състоянието на лимфните възли е оценено за промяна на теглото като непрекъсната променлива, използваща логистична регресия. При вторични анализи тествахме за разлики между категориите напълняващи спрямо отслабващите (мъже със стабилно тегло бяха изключени от тази субанализа; н= 14); тези, които качват ⩾ 2,5 кг (най-близката точка на среза на удобството до средното наддаване на тегло сред спечелилите) спрямо всички останали; и тези, които губят ⩾ 2,5 кг (най-близката точка на удобство до средната загуба на тегло сред губещите) спрямо всички останали. Повторихме всички анализи, с изключение на мъже с промяна на теглото> 2 s.d. от средното, за да се гарантира, че резултатите не са били неправомерно повлияни от извънредни стойности. Анализите бяха коригирани за възраст, раса, ИТМ, PSA, биопсия Gleason, клиничен етап, център и година на операцията. Направихме анализи на чувствителността на всички първични резултати, използвайки минимален интервал за установяване на теглото от 9 месеца (н= 333) и чрез включване на интервала от време между установяванията на теглото в многомерния модел, за да се гарантира, че промените в теглото, изчислени за кратко време, не оказват влияние върху резултатите.
Използвайки модел на пропорционални опасности на Кокс, ние оценихме риска от BCR, свързан с промяната на теглото, като непрекъсната променлива сред всички мъже и поотделно сред печелившите и губещите. Ние взаимно се приспособихме за предоперативните променливи възраст, раса, биопсия Gleason, клиничен етап, ИТМ, център и година. В отделни анализи ние допълнително се приспособихме за патологични характеристики, включително граници, инвазия на семенните везикули, екстракапсуларно удължаване, състояние на лимфните възли и патологичен резултат по Gleason. При вторичните анализи използвахме логаритмичен тест, парцели на Каплан-Майер и пропорционални опасности на Кокс, за да оценим риска от BCR при мъжете, които качват ⩾ 2,5 kg или губят ⩾ 2,5 kg спрямо всички останали. За да тестваме за взаимодействие с биопсия Gleason, включихме двете основни променливи в модела заедно с тристепенен термин за взаимодействие и оценихме промяната в вероятността χ 2 съотношение с 2 степени на свобода за изчисляване на стр-взаимодействие. Отново извършихме анализ на чувствителността, като повторихме всички анализи, използвайки минималния интервал за установяване на теглото от 9 месеца и като включихме времето между определянето на теглото в многомерния модел.
Резултати
Промяна на теглото и характеристиките на пациента
Средното време от 1 година преди тегло до хирургично тегло е 11,2 месеца (интерквартилен диапазон 10,0–12,2). Общо 333 мъже (93%) са имали ⩾ 9 месеца между двете измервания на теглото. През това време 152 (42%) мъже наддават на тегло, 193 (54%) отслабват и 14 (4%) имат същото тегло (диапазон от -35,2 до +47,2 кг) (Таблица 1). Сред набиращите тегло средно наддаване на тегло е 2,4 кг, а сред отслабващите средно отслабване е 2,7 кг. Мъжете, които са наддали, са имали значително по-ниски клинични етапи (P= 0,01) от мъжете, които са отслабнали или са били стабилни, без други предоперативни характеристики, значително различаващи се между групите.
Промяна на теглото и патологични характеристики
Сред всички мъже няма значителна връзка между промяната на теглото като продължителна променлива и риска от неблагоприятна патология (Таблица 2). Няма разлики в неблагоприятната патология между набиращите или отслабващите (всички P> 0,05). Освен това степента на наддаване или загуба на тегло, съответно на набиращите или губещите, не е свързана с неблагоприятна патология (всички P> 0,05). Увеличаването на теглото ⩾ 2,5 kg не е свързано значително с някаква патологична характеристика (всички P> 0,05). Загуба на тегло ⩾ 2,5 kg е свързана с намален риск от положителни граници, който се доближава до значимост (съотношение на шансовете = 0,61, 95% доверителен интервал (CI): 0,37–1,00, P= 0,052). С изключение на мъжете с промяна на теглото> 2 s.d. от средната стойност (т.е.> 10 kg спечелени или загубени; н= 7) не променя съществено нашите резултати: промяната на теглото остава несвързана с неблагоприятната патология, с изключение на мъжете, които губят тегло, при което по-голямата загуба на тегло е свързана с намален маржин риск (съотношение на шансовете = 0,59, 95% ДИ: 0,35–0,99, P= 0,046). Когато анализите са били ограничени до мъже с ⩾ 9 месеца между установяванията на теглото или когато времето между установяванията на теглото е включено в моделите, резултатите са непроменени (данните не са показани).
Промяна на теглото и BCR
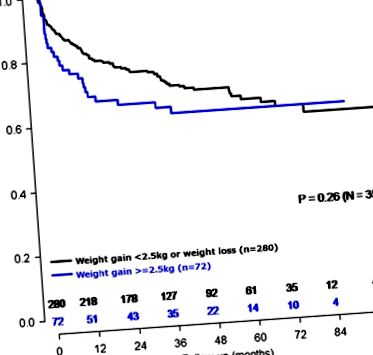
Крива на оцеляване на Каплан – Майер при мъже, наддаващи ⩾ 2,5 кг спрямо всички останали мъже (н= 352).
Трябва да се отбележи, че едномерната връзка между наддаването на тегло ⩾ 2,5 kg спрямо всички останали за рецидив на PSA не е статистически значима (log-rank, P= 0,26; Фигура 1). За да се оцени коя характеристика има най-голям ефект от засилване на връзката между наддаването на тегло ⩾ 2,5 kg и лошия резултат, всеки ковариат е добавен към мултивариантния модел един по един. Когато това беше направено, беше отбелязано, че добавянето на биопсия Gleason доведе до най-голямото изменение в HR за рецидиви, свързани с увеличаване на теглото. Не открихме взаимодействие между биопсия Gleason и наддаване на тегло (стр-взаимодействие = 0,14), което предполага, че връзката между наддаването на тегло ⩾ 2,5 kg и риска от BCR е сходна в стратовете на Gleason.
След коригиране на множество клинични характеристики, включително ИТМ, загубата на тегло ⩾ 2,5 kg не е свързана с BCR спрямо всички останали (HR = 0,83, 95% CI: 0,54–1,29, P= 0,41) (Фигура 2) или след изключване на мъже с екстремна промяна в теглото (HR = 0,83, 95% CI: 0,53–1,28, P= 0,40).
Крива на оцеляване на Каплан-Майер при мъже, загубили ⩾ -2,5 кг спрямо всички останали мъже (н= 352).
Горните резултати за вторичните анализи, свързани с наддаване или загуба на тегло ⩾ 2,5 kg, са по същество непроменени след допълнителна корекция за патологични характеристики, когато са ограничени до мъже с ⩾ 9 месеца между установяванията на теглото или когато времето между установяванията на теглото е включено в многовариантния модел ( данните не са показани).
Дискусия
Предишни проучвания показват, че затлъстяването е свързано с неблагоприятна патология и BCR след RP. 3, 5, 6, 7, 8, 9 Предишни проучвания също установиха връзка между загуба на тегло и намален риск от развитие на висококачествен PC и връзка между наддаване на тегло и риск от BCR и смъртност от PC, 3, 4, 10, макар и в тези проучвания, промяната на теглото се оценява в продължение на много години. Едно проучване установи, че периоперативното наддаване на тегло е свързано с повишена рецидивираност спрямо мъжете със стабилно тегло. 13
Нашите открития са в съответствие с предишни проучвания, показващи дългосрочно наддаване на тегло или наддаване на тегло през 5-те години преди RP да са свързани с BCR. 3, 13 Въпреки това, за разлика от друго предишно проучване, което установи, че дългосрочната загуба на тегло е свързана с намален риск от развитие на високостепенна болест, ние открихме само пределен защитен ефект срещу положителните граници в нашата популация. 10 Различия в дизайна на проучването (т.е. базираната на популация кохорта спрямо кохортата само за случая на РП), методите за установяване и определяне на промяна в теглото и крайната точка (диагностика на високостепенна болест спрямо рецидив след РП) правят директни сравнения на проучванията са трудни.
Затлъстяването може да повлияе на PC чрез нерегулирана клетъчна сигнализация. Например серумните нива на инсулин и IGF-I са повишени при затлъстяване. 15, 16 Инсулинът и IGF-I активират mTOR-AKT пътя, което води до повишена пролиферация и намалена апоптоза. 17 При животните, индуцираното от храната повишено ниво на серумен IGF-I и инсулин са свързани с повишен растеж на РС. 18, 19, 20 Освен това, повишените нива на инсулин също са свързани с ДПХ, друго заболяване, свързано с простатата. 21 Сред мъжете с PC, тези с концентрации на С-пептид (маркер на инсулин) в най-високия квартил са имали 2,4 пъти по-висока смъртност от PC в сравнение с мъжете в най-ниския квартил. 22 Дали енергийният излишък от наддаване на тегло, независимо от затлъстяването, създава същата микросреда като затлъстяването, е неизвестно и е необходимо по-нататъшно проучване.
Заключение
Общото наддаване на тегло през годината преди RP не е свързано с BCR или неблагоприятна патология. При вторичните анализи обаче наддаването на тегло ⩾ 2,5 kg през годината преди RP е свързано с BCR. Ако бъдат потвърдени в бъдещи проучвания, тези открития предполагат, че целенасочената профилактика на наддаването на тегло може да бъде разумна намеса за намаляване на BCR сред високорисковите мъже.
Препратки
Calle EE, Rodriguez C, Walker-Thurmond K, Thun MJ. Наднормено тегло, затлъстяване и смъртност от рак в проспективно проучена кохорта от възрастни в САЩ. N Engl J Med 2003; 348: 1625–1638.
Gong Z, Agalliu I, Lin DW, Stanford JL, Kristal AR. Затлъстяването е свързано с повишен риск от метастази на рак на простатата и смърт след първоначална диагноза на рак при мъже на средна възраст. Рак 2007; 109: 1192–1202.
Strom SS, Wang X, Pettaway CA, Logothetis CJ, Yamamura Y, Do KA и др. Затлъстяване, наддаване на тегло и риск от биохимичен неуспех при пациенти с рак на простатата след простатектомия. Clin Cancer Res 2005; 11. (19 част 1): 6889–6894.
Райт ME, Chang SC, Schatzkin A, Albanes D, Kipnis V, Mouw T и др. Проспективно проучване на затлъстяването и изменението на теглото във връзка с честотата и смъртността от рак на простатата. Рак 2007; 109: 675–684.
Amling CL, Riffenburgh RH, Sun L, Moul JW, Lance RS, Kusuda L и др. Патологични променливи и честота на рецидиви, свързани със затлъстяването и расата при мъже с рак на простатата, подложени на радикална простатектомия. J Clin Oncol 2004; 22.: 439–445.
Bassett WW, Cooperberg MR, Sadetsky N, Silva S, DuChane J, Pasta DJ и др. Влияние на затлъстяването върху рецидив на рак на простатата след радикална простатектомия: данни от CaPSURE. Урология 2005; 66: 1060–1065.
Freedland SJ, Aronson WJ, Kane CJ, Presti Jr JC, Amling CL, Elashoff D и др. Влияние на затлъстяването върху биохимичния контрол след радикална простатектомия за клинично локализиран рак на простатата: доклад на изследователската група на базата данни на регионалната болница за споделен равен достъп. J Clin Oncol 2004; 22.: 446–453.
Mallah KN, DiBlasio CJ, Rhee AC, Scardino PT, Kattan MW. Индексът на телесна маса е слабо свързан и не е полезен предиктор за прогресията на заболяването при мъже с клинично локализиран карцином на простатата, лекувани с радикална простатектомия. Рак 2005; 103: 2030–2034.
Freedland SJ, Banez LL, Sun LL, Fitzsimons NJ, Moul JW. Затлъстелите мъже имат по-висок клас и по-големи тумори: анализ на базата данни на центъра за простата на херцога. Рак на простатата Простатен дис 2009; 12: 259–263.
Родригес C, Freedland SJ, Deka A, Jacobs EJ, McCullough ML, Patel AV и др. Индекс на телесна маса, промяна на теглото и риск от рак на простатата в Проучване за превенция на рака II Nutrition Cohort. Рак Епидемиол Биомаркери Пред 2007; 16.: 63–69.
Bonorden MJ, Rogozina OP, Kluczny CM, Grossmann ME, Grande JP, Lokshin A и др. Анализ на напречното сечение на периодично спрямо хронично ограничаване на калориите при мишка TRAMP. Простата 2009; 69: 317–326.
Mukherjee P, Sotnikov AV, Mangian HJ, Zhou JR, Visek WJ, Clinton SK. Прием на енергия и растеж на тумор на простатата, ангиогенеза и експресия на съдов ендотелен растежен фактор. J Natl Cancer Inst 1999; 91: 512–523.
Джошу CE, Mondul AM, Menke A, Meinhold C, Han M, Humphreys EB и др. Повишаването на теглото е свързано с повишен риск от рецидив на рак на простатата след простатектомия в ерата на PSA. Cancer Prev Res (Фила) 2011; 4: 544–551.
Banez LL, Loftis RM, Freedland SJ, Presti Jr JC, Aronson WJ, Amling CL и др. Влиянието на чернодробната функция върху резултатите от рак на простатата след радикална простатектомия. Рак на простатата Простатен дис 2010; 13: 173–177.
Nam SY, Lee EJ, Kim KR, Cha BS, Song YD, Lim SK и др. Ефект на затлъстяването върху общия и свободен инсулиноподобен растежен фактор (IGF) -1 и връзката им с IGF-свързващия протеин (BP) -1, IGFBP-2, IGFBP-3, инсулина и растежния хормон. Int J Obes Relat Metab Disord 1997; 21.: 355–359.
Frystyk J, Vestbo E, Skjaerbaek C, Mogensen CE, Orskov H. Безплатни инсулиноподобни растежни фактори при човешкото затлъстяване. Метаболизъм 1995; 44 (10 Suppl 4): 37–44.
Guertin DA, Sabatini DM. Разширяваща се роля на mTOR при рак. Тенденции Mol Med 2005; 11.: 353–361.
Mavropoulos JC, Buschemeyer 3 WC, Tewari AK, Rokhfeld D, Pollak M, Zhao Y и др. Ефектите от променливото съдържание на въглехидрати и мазнини в диетата върху оцеляването при модел на миши LNCaP рак на простатата. Cancer Prev Res (Фила) 2009; 2: 557–565.
Freedland SJ, Mavropoulos J, Wang A, Darshan M, Demark-Wahnefried W, Aronson WJ и др. Ограничаване на въглехидратите, растеж на рак на простатата и ос на инсулиноподобния растежен фактор. Простата 2008; 68: 11–19.
Venkateswaran V, Haddad AQ, Fleshner NE, Fan R, Sugar LM, Nam R и др. Асоциация на индуцирана от диета хиперинсулинемия с ускорен растеж на рак на простатата (LNCaP). J Natl Cancer Inst 2007; 99: 1793–1800.
Hammarsten J, Damber JE, Karlsson M, Knutson T, Ljunggren O, Ohlsson C и др. Инсулинът и свободният естрадиол са независими рискови фактори за доброкачествена простатна хиперплазия. Рак на простатата Простатен дис 2009; 12: 160–165.
Ma J, Li H, Giovannucci E, Mucci L, Qiu W, Nguyen PL и др. Преддиагностичен индекс на телесна маса, плазмена концентрация на С-пептид и специфична смъртност от рак на простатата при мъже с рак на простатата: анализ на дългосрочната преживяемост. Лансет Онкол 2008; 9: 1039–1047.
Freedland SJ, Humphreys EB, Mangold LA, Eisenberger M, Partin AW. Време за рецидив на специфичен за простатата антиген след радикална простатектомия и риск от специфична смъртност от рак на простатата. J Urol 2006; 176 (4 част 1): 1404–1408.
Antonelli J, Freedland SJ, Jones LW. Упражнявайте терапия през континуума на рак на простатата. Рак на простатата Простатен дис 2009; 12: 110–115.
- Резултати Медицинско отслабване - Отслабване, Фентермин Резултати Медицинско отслабване
- Финансовите стимули, базирани на премии, не мотивират наетите служители да отслабват
- Проучването разглежда как пътуването за отслабване може да повлияе на дългосрочните резултати; Редакция на клиниката в Кливланд
- Резултат от наднормено тегло, затлъстяване и рак на ендометриума е систематичен преглед и мета-анализ
- Тънка бърза диета - Отслабване с резултати преди и след