Метин Басараноглу
Гьокчен Басараноглу
Елизабета Буджанеси
Резюме
Въведение
Най-ранният стадий на неалкохолната мастна чернодробна болест (NAFLD) е чернодробната стеатоза, която се определя от концентрацията на чернодробни триглицериди над 55 mg/g черен дроб (5,5%) (1). NAFLD може да прогресира до неалкохолен стеатохепатит (NASH), характеризиращ се с признаци на увреждане на хепатоцитите и чернодробно възпаление с отлагане на колаген. Приблизително 10-29% от пациентите с NASH ще развият цироза в рамките на 10 години (2). NAFLD е независим и по-силен предиктор за сърдечно-съдови заболявания от периферната или висцералната мастна маса (3,4). Разпространението на NAFLD е 15% при пациенти със затлъстяване, но нараства при затлъстели [индекс на телесна маса (ИТМ) = 30,0-39,9 kg/m 2] и изключително затлъстели (ИТМ ≥40,0 kg/m 2) пациенти до 65% и 85%, съответно (5).
В допълнение към генетичната податливост, факторите на околната среда играят важна роля в развитието на NAFLD & NASH (6-8). Бързото нарастване на разпространението на NAFLD подкрепя ролята на факторите на околната среда. Съобщава се, че свръхконсумацията на високофруктозен царевичен сироп (HFCS) в безалкохолните и предварително опакованите храни е свързана с нарастването на разпространението на затлъстяването и е свързана с NAFLD. Погълнатите въглехидрати са основен стимул за чернодробната de novo липогенеза (DNL) и е по-вероятно пряко да допринесат за NAFLD, отколкото приема на мазнини в храната.
Патофизиология на NAFLD
Затлъстяването е свързано с нискостепенно хронично възпаление (9). Това хронично възпаление е връзка между затлъстяването и инсулиновата резистентност. Резистентността към инсулин играе централна роля в патогенезата на NAFLD.
Обикновено инсулинът свързва α-субединиците на своя рецептор върху адипоцитите и хепатоцитите, което води до автофосфорилиране на β-субединиците и активира тирозин киназата (10). Автофосфорилираният рецептор активира инсулиновия рецепторен субстрат (IRS) -1, IRS-2, Src хомологичен колаген (Shc) и APS [адаптер протеин с плекстринов хомолог (PH) и Src хомология 2 (SH2) домейн], които активират компонентите надолу по веригата на инсулиновите сигнални пътища. Както в скелетните мускули, така и в мастната тъкан, тези инсулино-медиирани сигнални каскади индуцират транслокацията на глюкозни транспортери (GLUT). IRS-1 е свързан с глюкозната хомеостаза, докато IRS-2 е свързан с липогенезата с регулирането на липогенните ензими стерол-регулаторен елемент, свързващ протеин-1c (SREBP-1c) и синтаза на мастни киселини.
При затлъстелите повишеното производство на TNF-α и плазмените свободни мастни киселини са основните стимули на фосфорилирането на Ser 307 на IRS-1 (11). Инхибирането на IRS-1 поради фосфорилирането на неговите остатъци Ser 307 също изисква активиране както на c-Jun N-терминална киназа (JNK), така и на инхибитор кВ киназа β (IKK-β). Както TNF-α, така и свободните мастни киселини индуцират JNK и IKK-β активиране. TNF-α стимулира фосфорилирането на остатъците Ser на IRS-1 и IRS-2 в хепатоцитите и остатъците Ser на IRS-1 в мускулите. JNK е една от свързаните със стреса кинази и играе важна роля в развитието на инсулинова резистентност. Активираният JNK индуцира фосфорилиране на Ser 307 на IRS-1, нарушава сигнализирането на инсулина надолу по веригата и впоследствие причинява инсулинова резистентност. Протеиновата киназа C theta (PKCθ) и IKK-β са две провъзпалителни кинази, участващи в инсулиновата сигнализация надолу по веригата, които се активират от липидните метаболити. IKK-β фосфорилира инхибитора на ядрения фактор каппа В (NF-кВ). NF-κB има както апоптотичен, така и антиапоптотичен ефект.
Митохондриите на хепатоцитите са основното място на β-окисляване на свободните мастни киселини (12-15). Електроните се отстраняват от свободните мастни киселини по време на β-окисление, което в крайна сметка води до синтез на АТФ. Изчерпването на запасите от енергия (АТФ) увеличава податливостта на хепатоцитите към различни наранявания.
Въглехидрати: глюкоза, фруктоза и HFCS
Фруктозата е монозахарид (16,17). Това е захар със сладък вкус и се среща естествено в плодовете и някои зеленчуци. Фруктозата е по-сладка от глюкозата или захарозата. Преди развитието на световната захарна индустрия, фруктозата е била ограничена в човешката диета. Медът, фурмите, стафидите, меласата и смокините съдържат> 10% от тази захар. Съдържание на фруктоза от 5-10 тегловни% се съдържа в гроздето, суровите ябълки, ябълковия сок, райската ябълка и боровинките.
Днес основните източници на фруктоза в американската диета са HFCS (18-20). В индустриален план HFCS често се срещат в безалкохолни напитки и предварително опаковани храни. Най-често срещаната форма на HFCS е HFCS 55, която има 55% фруктоза в сравнение с захароза, която е 50% фруктоза. Храните и напитките се произвеждат с HFCS 55. Проучване показа, че някои популярни газирани напитки и други напитки съдържат съдържание на фруктоза, приблизително 65% от захарите. Освен това, HFCS може да съдържа произволна част от фруктоза до 90%. Наскоро беше съобщено, че повече от 50% от децата в предучилищна възраст консумират някои подсладени с калории напитки.
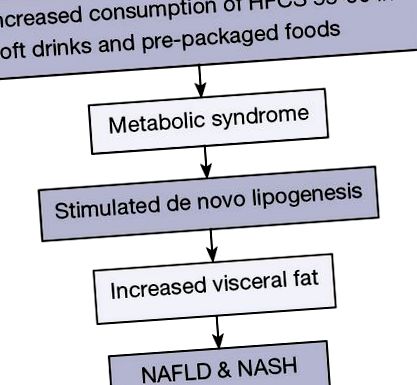
Няколко метаанализа предполагат, че консумацията на подсладени със захар напитки е свързана с риска от метаболитен синдром; повишени нива на триглицериди (TG), стимулирани DNL и повишена висцерална мазнина (20,21) (Фигура 1). Друго проучване сравнява млякото, диетичната кола, подсладената със захар кола и водата. Проучването показа, че подсладената захар напитка увеличава черния дроб и висцералните мазнини през 6-те месеца на прием на напитка, като консумира две 16-унционни напитки, съдържащи захар на ден в продължение на 6 месеца (22).
Повишената консумация на подсладени със захар напитки и предварително опаковани храни е свързана с риска от метаболитен синдром. Високо фруктозен царевичен сироп (HFCS) стимулира de novo липогенезата и накрая развитието на безалкохолна мастна чернодробна болест (NAFLD) и неалкохолен стеатохепатит (NASH).
Фруктозата е посредник в метаболизма на глюкозата (17-20). Но тя се различава по няколко начина от глюкозата. Фруктозата се абсорбира слабо от стомашно-чревния тракт по различен механизъм от този за глюкозата (Фигура 2). Повечето клетки имат само малки количества от транспортера на глюкоза тип 5 (GLUT-5), който транспортира фруктоза в клетките. Глюкозата се транспортира в клетките чрез GLUT-4, инсулинозависима транспортна система. Фруктозата се изчиства почти изцяло от черния дроб. Чернодробният метаболизъм на фруктозата стимулира липогенезата. Тези събития не зависят от инсулиновото усилие и стъпката на регулиране на фосфофруктокиназата. Високият прием на фруктоза е свързан с повишени плазмени TGs чрез повишаване на регулирането на чернодробната секреция на DNL и TGs и намален клирънс на липопротеинов триглицерид с много ниска плътност (VLDL-TG). Фруктозното фосфорилиране в черния дроб консумира АТФ, следователно натрупаният АДФ служи като субстрат за образуването на пикочна киселина. Тези събития улесняват чернодробното окислително увреждане и липидната пероксидация.
Фруктозата се абсорбира слабо от стомашно-чревния тракт от транспортера на глюкоза тип 5 (GLUT-5). Глюкозата се транспортира в клетките чрез GLUT-4, инсулинозависима транспортна система. Фруктозата се изчиства почти изцяло от черния дроб (циркулиращата концентрация е
0,01 mmol/L в периферната кръв, в сравнение с 5,5 mmol/L за глюкоза). Чернодробният метаболизъм на фруктозата индуцира de novo липогенеза. Фруктозното фосфорилиране в черния дроб консумира АТФ, следователно натрупаният АДФ служи като субстрат за образуването на пикочна киселина.
Aeberli et al. проведе 4-седмично рандомизирано кръстосано проучване с 4-седмично измиване между всяка диета при девет здрави млади мъже, сравнявайки четири различни безалкохолни напитки с нива на фруктоза, глюкоза и захароза, които са по-близки до нормалния прием (23). Това е рандомизирано кръстосано сравнение на четири напитки с две нива на фруктоза, глюкоза и захароза (50% фруктоза). Изследователите са изследвали инсулиновата чувствителност на черния дроб и цялото тяло чрез техниката на хиперинсулинемично-евгликемична скоба. Те показаха, че в сравнение с напитката с високо съдържание на глюкоза, напитката с ниско съдържание на фруктоза нарушава чернодробната чувствителност към инсулин, но не и чувствителността към инсулин в цялото тяло. Освен това те откриха, че нивата на липопротеините на обща и ниска плътност (LDL) холестерол се повишават от фруктозата спрямо глюкозата. Свободните мастни киселини също бяха повишени в групите с фруктозна напитка. Това проучване добавя към информацията за ролята на фруктозата или от захароза (обикновена трапезна захар), или от високо-фруктозен царевичен сироп за иницииране на чернодробна дисфункция и метаболитен синдром.
Cohen и Schall също съобщават, че захарозата повишава TG след хранене, но глюкозата няма ефект върху липидите (24).
Фруктозата като основен източник на чернодробна DNL при NAFLD
Повишената DNL (повишените хепатоцелуларни въглехидрати се превръщат в мазнини) има значителен принос за повишеното съдържание на чернодробни триглицериди в NAFLD (25,26). Последните техники като изотопни методологии, подход с множество стабилни изотопи и газова хроматография/масспектрометрия показаха, че относителният принос на три източника на мастни киселини към натрупаните мазнини в NAFLD като мастна тъкан, DNL и диетични въглехидрати. Двадесет и шест процента от чернодробните мазнини произтичат от DNL и 15% от диетата при пациенти с NAFLD.
Фруктозата може да индуцира NAFLD чрез способността си да действа като надрегулиран субстрат за DNL и като заобикаля основния ограничаващ скоростта етап на гликолиза при фосфофруктокиназа. Непрекъснатото поглъщане на фруктоза може да причини метаболитно натоварване на черния дроб чрез индуциране на фруктокиназа и синтаза на мастни киселини (27).
Доказателствата подкрепят фруктозата като оръжие за масово унищожение в NAFLD
Изследвания върху животни
Поглъщането на фруктоза може бързо да причини затлъстяване на черния дроб при животните с развитието на лептинова резистентност (28-30). Съобщава се, че консумацията на храна с високо съдържание на фруктоза намалява 24-часовите плазмени концентрации на инсулин и лептин, увеличава постпрандиалното гладуване и не потиска циркулиращия грелин (Фигура 3). По-рано нашата група демонстрира, че мъжки мишки C57BL/6, хранени със съответни количества еквивалент на царевичен сироп с високо съдържание на фруктоза (питейна вода, съдържаща 55% фруктоза) в продължение на 16 седмици, са развили тежка чернодробна стеатоза, свързана с некровъзпалителни промени (31).
Поглъщането на фруктоза може бързо да причини затлъстяване на черния дроб при животните чрез развитието на лептинова резистентност, намалена плазмена концентрация на инсулин и лептин и да не потиска циркулиращия грелин. HFCS, високо фруктозен царевичен сироп; NAFLD, неалкохолна мастна чернодробна болест; NASH, неалкохолен стеатохепатит.
Ackerman et al. показа, че плъхове, на които е дадена обогатена с фруктоза диета, повишават чернодробните TG и холестерола (32). Хранени с фруктоза гризачи при супрафизиологични дози при изокалорични (
60% енергия) или хиперкалорични (+ 30% излишна енергия) условия предизвикват стеатоза и стеатохепатит от DNL; фруктозата представлява 60-70% от мастните киселини в това проучване (33).
Nagai и сътр. демонстрира, че транскрипционният фактор пероксизомен пролифератор активиран рецептор гама коактиватор-1 бета (PGC-1 β) играе решаваща роля в патогенезата на индуцирана от фруктоза инсулинова резистентност при плъхове Sprague-Dawley (34). Armutcu et al. съобщава, че мъжки плъхове албиноси Wistar, снабдени с питейна вода, съдържаща 10% фруктоза за 10 дни, развиват макровезикуларна и микровезикуларна стеатоза без възпаление в черния дроб (35).
Диетата с много ниско съдържание на въглехидрати причинява загуба на тегло и повишено окисляване на мастните киселини в черния дроб и миокарда при мишки от див тип, в сравнение с мишки, поддържани на стандартна диета с чау, богата на полизахариди (37). Неотдавнашно проучване разкри, че мишки C57BL/6J в продължение на 12 седмици, хранени с кетогенна диета с много ниско съдържание на въглехидрати, ниско съдържание на протеини и високо съдържание на мазнини, водят до натрупване на чернодробна мазнина, системна непоносимост към глюкоза, стрес на чернодробния ендоплазмен ретикулум, стеатоза, клетъчно увреждане, и натрупване на макрофаги (38). Въпреки това, животните остават слаби и индуцираното от инсулин чернодробно фосфорилиране на Akt и реакцията на инсулин на цялото тяло не е нарушена. Кетогенните диети провокираха загуба на тегло при гризачи. Въпреки това, дългосрочната поддръжка на кетогенна диета стимулира развитието на NAFLD и системна непоносимост към глюкоза при мишки (37,38).
Човешки изследвания
Малки проучвания с пресечен и ретроспективен случай-контрол показват връзка между приема на захар, съдържаща фруктоза, и NAFLD (39-41). Мета-анализ показа ефект на повишаване на триглицеридите на фруктоза (39). Неотдавна публикувано проучване при хора изследва дали има връзка между спонтанния прием на въглехидрати и NAFLD (41). Те открили, че чернодробната стеатоза е свързана с приема на енергия и въглехидрати. Ролята на диетичните въглехидрати се открива в рамките на обичайния прием на въглехидрати: 32% до 58% калории.
Систематичен преглед и мета-анализ на контролирани опити за хранене изследва ефекта на фруктоза върху маркерите на NAFLD (42). Те откриха седем изокалорични проучвания, при които фруктозата се обменя изокалорично за други въглехидрати, и шест хиперкалорични проучвания, при които диетата се допълва с излишна енергия (+ 21-35% енергия) от високи дози фруктоза (+ 104-220 g/ден). Въпреки че няма ефект на фруктоза при изокалорични проучвания, фруктозата при хиперкалорични проучвания увеличава и двата чернодробни липида [стандартизирани средни разлики (SMD) = 0,45; 95% доверителен интервал (CI): 0,18-0,72] и аланин аминотрансфераза (ALT) [средна разлика (MD) = 4,94 U/L; 95% CI: 0,03-9,85]. Те стигнаха до заключението, че изокалоричният обмен на фруктоза за други въглехидрати не предизвиква NAFLD. Фруктозата осигурява излишна енергия и повишава количеството на липидите в черния дроб и серумния ALT. Освен това, това проучване заключава, че констатацията за липса на ефект на фруктоза върху NAFLD маркерите при изокалорични проучвания. Енергията представлява важен объркващ фактор за ефекта на фруктозата в този мета-анализ. Основното ограничение на този мета-анализ беше, че бяха включени няколко проучвания и повечето от тях бяха малки и кратки (≤4 седмици).
Райън и сътр. докладва post hoc анализ на 52 затлъстели, инсулиноустойчиви възрастни в програма за отслабване (43). Тези пациенти са рандомизирани да получават или диета с ниско съдържание на въглехидрати (40% въглехидрати/40% мазнини) или диета с ниско съдържание на мазнини (60% въглехидрати/25% мазнини) в продължение на 16 седмици. И двете групи загубиха значително количество тегло през пробния период. Серумните нива на ALT намаляват два пъти при диетата с ниско съдържание на въглехидрати в сравнение с диетата с ниско съдържание на мазнини. Показано е също така, че нивата на инсулинова резистентност намаляват и в двете групи, без значителни разлики между тях. Авторите заключават, че диетите с ниско съдържание на въглехидрати са по-полезни от диетите с ниско съдържание на мазнини при намаляване на нивата на ALT. de Luis et al. съобщава, че 3-месечна интервенция на хипокалорична диета (или с ниско съдържание на мазнини, или с ниско съдържание на въглехидрати) при пациенти със затлъстяване подобрява биохимичните параметри, ИТМ и обиколката (44).
Родригес-Ернандес и др. демонстрира ефект на диета с ниско съдържание на мазнини и ниско съдържание на въглехидрати върху чернодробните трансаминази (45). Това проучване включва 54 жени с ултразвукова диагноза NAFLD и ги разпределя на случаен принцип или с ниско съдържание на мазнини (25% протеин, 10% мазнини, 54% въглехидрати) или с ниско съдържание на въглехидрати (27% протеин, 28% мазнини, 45% въглехидрати) за период от 6 месеца. В края на проучването тези, които са на диета с ниско съдържание на въглехидрати, са загубили 5,7% от телесното си тегло, а тези в групата с ниско съдържание на мазнини 5,5%, което е несъществен резултат. Нивата на ALT и AST са намалени и в двете групи без значителна разлика.
В друго проучване на Haufe et al. демонстрирано при общо 102 пациенти, включително мъже и жени, за 6-месечна диетична терапия с ниско съдържание на въглехидрати (90 g въглехидрати и 0,8 g протеин на kg тегло, 30% мазнини) и ниско съдържание на мазнини (20% мазнини, 0,8 g протеин на kg, остатъкът въглехидрати) (46). Резултатите от това проучване също са подобни на Rodríguez-Hernández et al. резултати от изследването (45). В допълнение, интрахепаталното съдържание на мазнини също не показва статистическа разлика, 47% намалява в групата с ниско съдържание на въглехидрати и 42% намалява съдържанието на чернодробна мазнина в групата с ниско съдържание на мазнини.
Севастианова и др. демонстрираха 16 субекта (ИТМ = 30,6 ± 1,2) в продължение на 3 седмици, индуцирани при високо въглехидратна диета (> 1000 Kcal), показаха> 10 пъти по-голяма относителна промяна в чернодробните мазнини (27%), отколкото в телесното тегло (2%) и повишени чернодробни мазнини положително корелира с DNL (47). Освен това последвалата хипокалорична диета в продължение на 6 месеца доведе до намаляване на телесното тегло, както и до намаляване на чернодробните мазнини до норма. Това проучване предполага, че човешкият мастен черен дроб натрупва мазнини по време на прехранване с въглехидрати и подкрепя ролята на DNL в патогенезата на NAFLD.
Доказано е, че диетите с ниско съдържание на въглехидрати насърчават загубата на тегло, намаляват съдържанието на интрахепатални триглицериди и подобряват метаболитните параметри на пациенти със затлъстяване (48). Мета-анализ изследва дългосрочните (6 или повече месеца) ефекти на диети с ниско съдържание на въглехидрати (≤45% от енергията от въглехидрати) спрямо диети с ниско съдържание на мазнини (≤30% от енергия от мазнини) върху метаболитните рискови фактори чрез рандомизиране контролирани изпитвания (48). Общо 2788 участници отговарят на предварително определени критерии за допустимост (от 1 януари 1966 г. до 20 юни 2011 г.) и са включени в анализите. Както диетите с ниско съдържание на въглехидрати, така и с ниско съдържание на мазнини намаляват теглото и подобряват метаболитните рискови фактори. В сравнение с участниците на диети с ниско съдържание на мазнини, хората на диети с ниско съдържание на въглехидрати са имали леко, но статистически значително по-ниско намаление на общия холестерол и LDL холестерол, но по-голямо увеличение на липопротеиновия холестерол с висока плътност и по-голямо намаляване на TG.
Абделмалек и др. проучени 341 възрастни пациенти с NAFLD (49). Те оцениха дали повишената консумация на фруктоза корелира само с развитието на NAFLD или насърчава прехода от NAFLD към NASH и по-напредналите стадии на увреждане на черния дроб. Консумацията на фруктоза се изчислява въз основа на отчитане (честота × количество) на охладител, плодови сокове и недиетичен прием на сода, изразени като порции на седмица. Авторите установяват, че увеличената консумация на фруктоза е еднозначно свързана с намалена възраст (P 48 години), дневната консумация на фруктоза е свързана с повишено чернодробно възпаление (P Szczepaniak LS, Nurenberg P, Leonard D, et al. Магнитно-резонансна спектроскопия за измерване на съдържанието на триглицериди в черния дроб): разпространение на чернодробна стеатоза сред общата популация Am Am Physiol Endocrinol Metab 2005; 288: E462-8. [PubMed] [Google Scholar]
- Аналогът на куркумин CUR5–8 подобрява безалкохолната мастна чернодробна болест при мишки с високо съдържание на мазнини
- Фруктоза и захар Основен медиатор на безалкохолната мастна чернодробна болест - FructoseFacts
- Ефекти от приема на въглехидрати върху нивото на етанол в кръвта и алкохолно увреждане на черния дроб при плъхове
- Пълна статия Лечение на безалкохолна мастна чернодробна болест от опити при възрастни до перспективи в
- Китайски билки за безалкохолни мастни чернодробни заболявания Вестник на растителните лекарства