Нефро-урология, Институт по детско здраве, Университетски колеж Лондон, Лондон, Великобритания
Молекулярна медицина, Институт по детско здраве, Университетски колеж Лондон, Лондон, Великобритания
Биостатистика и епидемиология, Институт по детско здраве, Университетски колеж Лондон, Лондон, Великобритания
Елементи за молекулярна хематология и биология на рака, Институт по детско здраве, Университетски колеж Лондон, Лондон, Великобритания
Нефро-урология, Институт по детско здраве, Университетски колеж Лондон, Лондон, Великобритания
Резюме
Какво кара човек да се роди с по-малко нефрони от нормалното (бъбречна хипоплазия)? Вероятно има поне три основни причини: 1) мутации на гени за нефрогенеза като PAX2 и HNF1β (4; 51); 2) увреждане на феталния пикочен поток, причинено от физическа обструкция в долния уринарен изходящ тракт, фенотип, който може да бъде моделиран при експериментални животни (46, 59); и 3) тератогени (45). Напоследък се предполага четвърта причина, а именно, че майчината диета, приета по време на бременност, модулира развитието на метанефроса и други органи (40, 42). Тази идея се подкрепя косвено от човешки епидемиологични данни, свързващи ниското тегло при раждане със заболявания на възрастни като хипертония, както и захарен диабет тип 2 и коронарна болест на сърцето (3, 61); такива асоциации могат да бъдат обяснени, ако диференциацията на плода може да бъде „програмирана” от майчината диета. Всъщност при плъхове ограничаването на протеини по време на бременност води до потомство с по-малко гломерули и по-високо системно кръвно налягане от контролите (32, 33, 56). Освен това при хората има положителна връзка между теглото при раждане и гломерулния брой (24).
В настоящото проучване разгледахме два въпроса: 1) има ли LPD при майката вредно въздействие върху крайния гломерулен брой, ако експерименталните диети се подхранват в началото на бременността и продължават да достигат само до E13.0, а не в края на бременността, и 2) модулира ли LPD генната експресия в метанефроса E13.0? Резултатите от тези експерименти показват, че майчината диета програмира транскрипция в ембрионалния бъбрек в момент, когато нефроните и гломерулите тепърва ще се образуват.
Протоколите за животни бяха одобрени от Министерството на вътрешните работи на Обединеното кралство. Всички реактиви са от Sigma Chemical (Dorset, UK), освен ако не е посочено друго.
Диетични манипулации и гломерулно броене.
Диетични манипулации, извършвани за молекулярни и хистологични анализи.
PCR в реално време.
Western blot анализ и имумохистохимия.
Диети на майките и окончателно гломерулно число.
За да определим ефектите на майчиния LPD върху крайния брой на нефрона при потомството, първо изследвахме протоколи, в които съдържанието на протеини в диетата се контролира през цялата бременност (фиг. 1). Потомци на язовири, хранени с 18% протеин от E0.0 до термин, притежаваха 31.2 × 10 3 ± 0.7 × 10 3 (означава ± SE) гломерули/бъбрек; потомство, изложено на 9% LPD по време на бременността, притежава 6,3 × 10 3 ± 1,7 × 10 3 по-малко гломерули/бъбреци от контролите (около 20% по-малко, P 3 ± 1,6 × 10 3 гломерули/бъбрек по-малко от контролите (около 23% по-малко, P 3 ± 1,4 × 10 3 гломерули/бъбреци по-малко от контролите (около 19% по-малко, P 3 ± 1,3 × 10 3 гломерули/бъбреци по-малко (около 24% по-малко, P 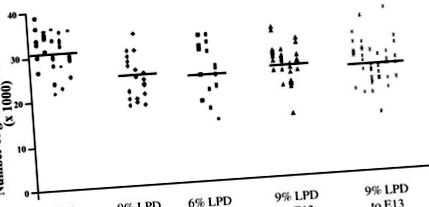
Фиг. 1.Ефект на диетите върху крайния брой гломерули. Общ гломерулен брой от бъбреци на животни на възраст 2 седмици, изложени на 18% протеин по време на бременността (•), 9% нископротеинова диета (LPD) през цялата бременност (⧫), 6% LPD през цялата бременност (▪), 9% LPD до ембрионален ден 13 (E13.0), последвано от 18% протеин за останалата част от бременността (▴), или 6% LPD до E13.0, последвано от 18% протеин за останалата част от бременността (X) са показани. Всеки символ представлява бъбрек, а всяка колона представлява отделно котило. * Значителна разлика в сравнение с 18% протеинови контроли (P
Ефекти на LPD върху метанефричната генна експресия, оценени от RDA.
Горните резултати предполагат, че LPD е променил по някакъв начин траекторията на нефрогенеза на плъхове до деня, в който се образуват метанефросите. В съответствие с това, ние (56) по-рано документирахме повишена метанефрична мезенхимна апоптоза при Е13.0 в ембриони на майки, изложени на LPD, инициирани в началото на бременността. Ние разсъждавахме, че този програмен ефект може да бъде свързан с редувания на метанефрична генна експресия и затова направихме RDA екран, сравняващ E13.0 metanephroi между контролни и изложени на LPD животни. Чрез секвениране на 31 колонии с вложки в 18T срещу 9D хибридизация и 18 колонии с вложки в 9T в сравнение с 18D хибридизация и изключване на „фалшиви“ продукти, появяващи се и в двата комплекта, няколко транскрипта бяха изолирани от този екран като нагоре или надолу регулирани от майката LPD (Таблица 1) (9, 21, 25, 28, 29, 34, 39, 47, 52, 55, 62), като някои се появяват няколко пъти.
Таблица 1. Преписи, изолирани от реципрочни екрани на RDA
Стенограмите се класифицират като понижаващи или регулирани от майчината 9% диета с ниско съдържание на протеини (LPD). RDA, анализ на представителната разлика.
* Препис, за който понастоящем не е известна последователност на плъхове и по този начин се отнася до преписа на мишката.
Ефекти на LPD върху метанефричната генна експресия, оценени чрез PCR в реално време.
Няколко от тези гени, изолирани в RDA, кодират протеини, които отговарят на критериите за потенциално участие в диференциацията и органогенезата (например транскрипционни фактори, адхезионни молекули, протеини, които влияят на цитоскелета и др.) Те бяха избрани за измерване в метанефрои E13.0, като се използва PCR в реално време както при 9%, така и при 6% LPD спрямо контролни диети. Резултатите са показани в Таблица 2.
Таблица 2. PCR в реално време
Относителните нива на транскрипт се променят постоянно спрямо 18% протеинови контроли. Относителните нива на транскрипт между различните диети представляват средните измерени съотношения от три групи реакции в реално време на всяка диетична проба. Показани са праймерите, използвани в анализа в реално време.
Имунохистохимия.
Фиг. 2.Prox-1 имунохистохимия. Показана е имунолокализация на Prox-1 в контролните метанефрои. A: E13.0 метанефрос при ниска мощност, показващ имунореактивен сигнал (кафяв) в строма (и) около уретерална пъпка (u); кондензиращият мезенхим (m) обикновено е отрицателен. Б.: изображение с по-голяма мощност на A. ° С: подобен раздел на В, изследван с изотип контролен имуноглобулин. д: E15.0 метанефрос с висока мощност, показващ широко разпространена експресия на прокс-1 в мезенхим и подмножества от ядра в клонове на уретерни пъпки и нефронови везикули (v). Лента = 100 μm инч A и 25 μm инча B – D. Е.: подобен раздел на д, сондиран с изотип контрол имуноглобулин.
Фиг. 3.Кофилин-1 имунохистохимия. Контролните метанефрои бяха изследвани с антитяло до фосфорилиран/дефосфорилиран кофилин-1 (A и Б.) или антитяло, специфично за фосфорилиран кофилин-1 (д). A: E13.0 метанефрос при ниска мощност, показващ имунореактивен сигнал (кафяв) в мезенхим и уретерна пъпка. Б.: изображение с по-голяма мощност на A. Обърнете внимание на цитоплазмения сигнал в епителиите на уретерните пъпки и кондензиращия мезенхим, докато стромалните клетки не показват значителен сигнал. ° С: подобен раздел на Б., сондиран с антитяло, специфично за фосфорилиран кофилин-1. д: централна област на E15.0 метанефрос, показващ имунореактивност в дълбоки клонове на уретера/пъпки за събиране; имайте предвид, че околната строма е отрицателна. Лента = 100 μm инч A и 25 μm инча B – D.
Експресия на свързани с апоптозата гени Bax и Bcl-2.
Експресиите на проапоптотичния ген Bax и антиапоптотичния ген Bcl-2 бяха измерени в различните диетични групи. С използването на PCR в реално време на метанефрои E13.0 се наблюдава поетапно увеличаване на експресията на двата гена с 9% и 6% LPD (Таблица 3); пропорционалното увеличение е по-голямо за проапоптотичния ген Bax спрямо антиапоптотичния ген Bcl-2. Увеличението на експресията на Bax спрямо контролите е 560% за 9% LPD и 1,269% за 6% LPD. Подобен модел се наблюдава за Bcl-2, където 9% LPD показва увеличение от 286%, а 6% LPD показва увеличение от 527% в сравнение с контролите. Сравнението на съотношението на Bax към Bcl-2 показа, че това е приблизително удвоено спрямо контролите при 9% LPD (97% увеличение) и 6% LPD (141% увеличение) метанефрои.
Таблица 3. PCR в реално време за молекули, свързани с апоптозата
Относителните нива на транскрипт между различните диети представляват средните измерени съотношения от три групи PCR реакции в реално време за всяка диетична проба. Показани са праймерите, използвани в анализа в реално време.
В настоящото проучване използвахме диетичен протокол, който променя съдържанието на протеини в синтетичната диета, доставяна на бременни плъхове. Ако това трябваше да бъде единствената манипулация, тогава общото енергийно съдържание на диетата щеше да бъде намалено в LPD спрямо нормалните диети. За да се направят заключения относно последиците от ограничаването на диетичните протеини, за разлика от глобалното намаляване на енергията, енергийното съдържание на диетите трябваше да бъде възстановено; за тази цел увеличихме количеството въглехидрати в диетата. Увеличението на въглехидратите е около 15% в LPD, докато намаляването на протеините е съответно 50% или 66% за 9% и 6% LPD. Поради това увеличението на съдържанието на въглехидрати в LPD беше доста скромно и ние го считаме за малко вероятна причина за явленията, за които докладвахме в това проучване; въпреки че объркващ ефект не може да бъде изключен, ние не знаем за независими публикувани данни, които да доказват, че такова умерено увеличение на въглехидратите нарушава ембрионалния растеж.
Настоящото проучване също така предполага, че няколко молекули, за които преди не се съобщава, че се експресират в метанефроса, може да са важни за бъбречното развитие.
В настоящите анализи на 9% LPD спрямо контролната диета, данните от количествените PCR анализи потвърждават регулирането нагоре и надолу на гените, идентифицирани като диференцирано изразени в RDA екрана; освен това, количествените PCR анализи на по-тежко ограничение на диетата, т.е. 6% LPD, показват подобно регулиране нагоре или надолу на същия набор от гени. По отношение на тези проучвания трябва да се отбележи, че иРНК, използвана за RDA и количествени PCR анализи, са получени от отделни групи от ембрионални органи за всяка диета.
Настоящият екран на RDA идентифицира няколко други гени, които бяха регулирани нагоре или надолу от LPD на майката. Макар че пространството не позволява подробно описание на всички тях, забележително е, че лактат дехидрогеназните ензими са открити в миши метанефрои (29) и е съобщено, че кадхерин-11 се изразява в мезенхим на бъбречни и други органични зачатъци (10); трябва да се отбележи, че с помощта на анализ на cDNA микрочипове, кадхерин-11 е идентифициран като ген, регулиран в неиндуциран миши бъбречен мезенхим (9). Установихме, че калмодулинът е регулиран от LPD на майката, а други съобщават, че калмодулин-свързващият протеин-1 е открит при образуването на нефрони (38). Намаляването на регулацията на α-тубулина от LPD също е забележително, тъй като тази молекула е основен компонент на цитоскелета и е критична за поддържането на полярността на бъбречния епител и диференцираното състояние чрез присъствието му в микротубули, завършващи в субапикалната мрежа и базалните тела (5, 43).
Като се има предвид, че предишното ни проучване на LPD (56) свързва регулираната метанефрична апоптоза с LPD на майката, беше забележително, че RDA екранът, представен в настоящото проучване, не идентифицира променена експресия на гени, които са „класически“ свързани с апоптозата. Известно е, че Bax и Bcl-2 се изразяват в нормално развитие на бъбреците и е известно, че тяхната експресия е дерегулирана при определени състояния, свързани с нарушена нефрогенеза и апоптоза, например блокиране на потока на фетална урина (53, 36). Използвайки PCR в реално време на метанефрои E13.0, наблюдавахме поетапно увеличаване на експресията на двата гена с 9% и 6% LPD; интересно е, че пропорционалното увеличение е по-голямо за проапоптотичния ген Bax спрямо антиапоптотичния ген Bcl-2, което може би предполага, че LPD променя баланса на експресията, за да регулира смъртта на метанефричните прекурсорни клетки. Фактът, че RDA не е идентифицирал тези промени, подчертава факта, че тази техника, макар и полезна за откриване на някои промени в генната експресия, в никакъв случай не е изчерпателна.
Как може генната експресия да бъде променена от майчината диета? Глюкокортикоидите медиират ембрионалното програмиране, тъй като приложението на дексаметазон при бременни плъхове причинява бъбречна хипоплазия и хипертония при потомството (8), а LPD намалява плацентарната 11β-хидроксистероидна дехидрогеназа, ензим, предпазващ концептуса от майчините глюкокортикоиди и надрегулира фетални биохимични маркери (глюкоорт 31) . Развиващият се пикочен тракт изразява глюкокортикоидни рецептори (27) и би било полезно да се изследват ефектите на глюкокортикоидите върху експресията на гените, идентифицирани в настоящия RDA екран. Експерименталното забавяне на вътрематочния растеж е друг сценарий, свързан с повишена бъбречна апоптоза и гломерулен дефицит (50); интересно е, че същото проучване съобщава, че статусът на метилиране на p53 ген е променен при тези експериментални животни. Интригуващо е, че променено метилиране на човешкия прокс-1 ген се среща при някои хематологични злокачествени заболявания (44). Взети заедно, би било интересно да се извършат биохимични експерименти, за да се установи дали LPD на майката променя статуса на метилиране и скоростта на транскрипция на гени като prox-1 и colfilin-1.
Това проучване беше подкрепено от Националния фонд за изследване на бъбреците и Фонда за подпомагане на бъбреците.
- Програми за диета и отслабване на Living Fit HMR - Забележка Неопределен променлив запис в
- Дългосрочната диета с високо съдържание на сол причинява хипертония и намалява бъбречната експресия на съдов ендотел
- Диетата с високо съдържание на мазнини модулира чревните адаптации на майката към бременността и води до
- HILL S РЕЦИПЛИАЛНА ДИЕТА kd Грижа за бъбреците Сорт пакет мокър; Суха котешка храна
- HILL S ПРЕДПИСКА ДИЕТА kd Грижи за бъбреците Мобилност Грижа с пиле; Зеленчукова яхния, консервирана котешка храна
