Майкъл Г. Рос
1 Перинатални изследователски лаборатории, Катедра по акушерство и гинекология, Медицински факултет на Дейвид Гефен, Калифорнийски университет, Лос Анджелис, CA 90095, САЩ
Мина Десай
2 Биомедицински изследователски институт в Лос Анджелис при Медицински център Харбър-UCLA, 1124 W. Carson Street, Torrance, CA 90502, САЩ
Резюме
Наскоро призната основна причина за епидемията от затлъстяване е въздействието върху програмирането върху развитието на бебета, родени от майки със затлъстяване или гестационен диабет, вътрематочен растеж, ограничени новородени и потомци, изложени на токсини от околната среда, включително бисфенол А. Механизмите, които водят до затлъстяване на потомството, включват програмирането на хипоталамусния апетитен път и адипогенни сигнали, регулиращи липогенезата. Процесите включват хранителни сензори, епигенетични модификации и промени в предшествениците на стволови клетки както на невроните за апетит/засищане, така и на адипоцитите, които са модулирани да потенцират затлъстяването на потомството. Бъдещите стратегии за превенция и терапия на затлъстяването трябва да се отнасят до програмните ефекти на ранната среда на живот.
Затлъстяването представлява криза в общественото здраве, което допринася значително за заболеваемостта и смъртността в Съединените щати и в развития свят. Затлъстяването е от основно значение за развитието на метаболитен синдром, който включва съзвездие от аномалии, състоящи се от инсулинова резистентност, повишени триглицериди, хипертония и атеросклероза. Сред възрастните в САЩ 66% са с наднормено тегло (BMI 25 до 2) и 33% са с наднормено тегло (BMI≥30 kg/m 2), докато 20% от децата са с наднормено тегло и по този начин са с повишен риск от затлъстяване при възрастни. Сред детородните жени се наблюдава непрекъснато нарастване на разпространението на затлъстяването с 25–36% увеличение на ИТМ на майката през последното десетилетие. Във връзка с това сме свидетели на редица усложнения при бременност и 25% увеличение на честотата на бебетата с високо тегло при раждане, което само по себе си представлява рисков фактор за детското затлъстяване. Въпреки че голямо внимание е било съсредоточено върху ролята на факторите на околната среда, включително наличието на калорични храни и начин на живот, включващ по-малко физическа работа, този преглед ще представи доказателства, че предразположението към затлъстяване може да бъде програмирано или предварително определено вътреутробно. Основните механизми, които водят до затлъстяване, включват нарушена регулация на апетита/ситост и адипогенеза/липиден метаболизъм.
Програмирано затлъстяване
Хора
Епидемиологичните проучвания при хора потвърждават, че както ниското, така и високото тегло при раждане водят до повишен риск от затлъстяване при деца и възрастни (преглед 1). Вътрематочен растеж (IUGR) или бебета с ниско тегло при раждане, особено тези с бърз растеж през първите няколко години от живота, имат по-висок риск от затлъстяване при възрастни и метаболитен синдром. 1; 2 Докато бебетата с IUGR се развиват в състояние на относително „недохранване“, „преяждането“ на плода също има последици за здравето на потомството. По-конкретно, затлъстяването на майката по време на бременност или повишеното наддаване на тегло по време на бременност е свързано с по-високо тегло при новородени 3 и повишен риск от затлъстяване и риск от диабет в по-късен живот.
Възможно е да има оптимално тегло за новородено (потенциално специфично за отделна майка), при което програмирането на потенциала за затлъстяване да е сведено до минимум. Въпреки това, в диапазони от по-ниско до по-високо тегло при раждане, проучванията показват степенуване на повишената склонност към програмиране на затлъстяването на потомството. По този начин, промените в „оптималния“ вътреутробен растеж, независимо дали става въпрос за ограничено или излишно хранене, увеличават относителния риск от метаболитен синдром при възрастни.
Модели на животни
Животински модели на IUGR, използващи различни методи, като ограничаване на хранителните вещества на майката, лигатура на плацентата на матката или излагане на глюкокортикоиди, демонстрират, че потомството на IUGR е изложено на повишен риск от затлъстяване при възрастни, особено сред онези, които имат очевиден бърз растеж. 5 По-новите животински модели на майчино прехранване, включително затлъстяване при майки и западни диети с високо съдържание на мазнини (HF), подобно повтарят човешкия опит в това, че потомството е предразположено към затлъстяване при възрастни. 5
Механизми на предизвикано от храненето програмирано затлъстяване
Както беше отбелязано по-горе, повишеният апетит и засилената адипогенеза представляват критични пътища, насърчаващи затлъстяването.
Апетит
Проучванията показват, че програмираната дисрегулация на апетита допринася за затлъстяването при фенотип при IUGR и HF потомство. 6 Ще опишем накратко развитието на невроните за апетит/засищане, за да демонстрираме потенциални механизми, чрез които може да се развие програмиран засилен апетит и/или намалена ситост.
Апетитът се контролира предимно от сложна верига от хипоталамусни ядра, участващи в синтеза на сигнали за апетит/ситост, области на действие, в които действат пратениците, и регулаторни места. Преобладаващото място за регулиране на апетита, хипоталамусното дъгообразно ядро (ARC) получава информация от периферни (мозък, панкреас и адипоцити) и централни източници. ARC съдържа поне две популации неврони с противоположни действия върху приема на храна: предимно медиален орексигенен (NPY; невропептид Y и AgRP; протеин, свързан с агути) и предимно страничен анорексигенен (POMC; про-опиомеланокортин и CART; кокаин- и амфетамин- регулиран транскрипт) неврони. Най-критичните ARC “регулаторни” апетитни прогнози са към паравентрикуларното ядро, което в крайна сметка регулира поглъщащото поведение.
Хипоталамусната регулация на апетита и функцията за ситост се развива вътреутробно при предкоциални видове, за да се подготви за живота на новороденото, въпреки че има непрекъснато нервно развитие и съзряване през неонаталния период. 7 По този начин хранителните ефекти по време на периода на плода и/или новороденото могат трайно да „програмират” ARC структурата и функцията и да повлияят на апетита и развитието на затлъстяването. През този период на развитие хипоталамусните невронни стволови клетки (NSC) се размножават и в крайна сметка се диференцират в неврони, астроцити или олигодендроцити, които мигрират и населяват ядрата на хипоталамуса. След като NSCs се диференцират до неврони, тези клетки, предназначени за ARC апетитния център, допълнително се диференцират, за да експресират орексигенни или анорексигенни пептиди. Диференциацията на NSC към невроните или глиалните клетки и крайната диференциация към невроните за апетит или засищане се регулира от сложно пространствено/времево взаимодействие на пътищата, което може да бъде значително променено от хранителната среда или да се изберат токсини.
Мастна тъкан
В допълнение към програмирания апетит/засищане, доказателствата показват, че механизмите, регулиращи развитието и функцията на мастната тъкан (липогенеза), могат да бъдат ключов фактор за развитието на програмирано затлъстяване. Адипогенезата е процес на клетъчна диференциация, чрез който преадипоцитите се превръщат в адипоцити и изисква силно организирана и прецизно контролирана експресия на каскада от транскрипционни фактори, които подобно на нервното развитие могат да бъдат повлияни от хранителната среда.
Адипогенеза и липогенеза
Клетъчното развитие, свързано с растежа на мастната тъкан, включва както клетъчна хиперплазия (увеличаване на броя на клетките), така и хипертрофия (увеличаване на размера на клетките). Хиперплазията (адипогенеза) включва пролиферацията и диференциацията на преадипоцитите, докато хипертрофията е резултат от натрупването на излишък на триглицериди в съществуващите адипоцити поради положителен енергиен баланс. Механистичните проучвания за засилена адипогенеза или промяна във функцията/отговора на адипоцитите при потомството на IUGR са ограничени. Нашите лабораторни проучвания обаче показват, че потомството на IUGR специално демонстрира хипертрофични адипоцити и повишен синтез на мастни киселини de novo, 16; 17, както прогнозират за повишена склонност към съхранение на мазнини. Ние показахме, че на 1-дневна възраст мъжките потомци на IUGR са регулирали адипогенната сигнална каскада 16, както е видно от повишената експресия на ензими, насърчаващи синтеза и съхранението на адипоцитни липиди. Тъй като тези промени са очевидни в началото на живота преди началото на затлъстяването, това предполага програмиран път на повишена диференциация на адипоцитите и липогенеза, който вероятно насърчава развитието на затлъстяване и метаболитни аномалии при потомството на IUGR. 5; 16
Допълнително проучихме дали увеличеният адипогенен потенциал на адипоцитите на IUGR се дължи на присъща клетъчна промяна чрез използване на първична адипоцитна клетъчна култура. Адипоцитите на IUGR в културата запазват фенотипа на засилена адипогенеза, което се доказва от растеж в културата, а също и ензимна/сигнална експресия. 17 По този начин самият адипоцит проявява „програмирана“ адипогенеза/липогенеза, независимо от хормоналната среда на IUGR.
Нашите първоначални механистични проучвания на потомство на затлъстели HF майки демонстрират подобно подобрена адипогенеза, подобно на новородените IUGR. По този начин програмите за недохранване и прекомерно хранене повишават адипогенезата. Въпреки че адипогенните сигнални фактори надолу по веригата са сходни както при IUGR, така и при HF потомство, има значителни разлики в реакциите на хранителните/енергийните сензори в зависимост от основния хранителен стрес. 18.
Екологични обезогени
Нарастващата експозиция на хората на широк спектър от промишлени/селскостопански химикали е добре известна. CDC съобщава за значително излагане на хора на химикали, разрушаващи ендокринната система (EDC), включително тези, действащи чрез естрогенни рецептори (eEDC). Както възрастни, така и деца са рутинно изложени на бисфенол А (BPA), тъй като има измерим BPA в кърмата, майчиния и феталния серум, околоплодните течности и плацентарните тъкани 19 Важно е, че нивото на BPA е по-високо при бебета и деца, отколкото при възрастни.
Има натрупващи се данни, че ендогенните естрогени и eEDCs участват както в телесното тегло, така и в регулирането на енергията. Естрогенното лечение на хамстерите намалява телесното тегло и мазнините, а дефицитът на естрогени при животни или жени води до натрупване на мазнини. 20 За разлика от ефектите при възрастни, излагането на eEDC в развитието може да повлияе телесното тегло на потомството чрез промени в растежа и диференциацията на адипоцитите или NSC и дългосрочни епигенетични модификации. Потомците на плъхове, изложени перинатално на ниски дози BPA, показват повишено телесно тегло, докато мишките, изложени на ниско ниво на BPA от средата до края на бременността, имат повишена телесна маса при раждането и отбиването. По-конкретно се съобщава, че ниската, а не високата доза BPA на майката е ефективна за насърчаване на наддаването на тегло на потомството. Важното е, че тези неблагоприятни ефекти, наблюдавани при животни при „ниска доза“, са в рамките на обхвата на излагане на човека на BPA.
При хората епидемиологичните проучвания подкрепят връзката между излагането на EDC и затлъстяването в развитието в по-късен живот. Пренаталната и ранна експозиция на полихлориран бисфенил (PCB) е свързана с повишено тегло на мъжете и жените в пубертета, вътреутробната експозиция на хексахлоробензен е свързана с деца с наднормено тегло на 6-годишна възраст, а хлорорганичните пестициди са положително свързани с ИТМ.
Механизми на предизвикано от BPA програмирано затлъстяване
Подобно на механизмите, чрез които програмата за недохранване и преяждане апетит/засищане и адипогенеза, излагането на BPA може да доведе до затлъстяване при възрастни. Проадипогенните ефекти на обезогените в околната среда са добре документирани, като неотдавнашни проучвания показват ефекти върху генерирането, диференциацията и липогенната функция на адипоцитите, с потенциални епигенетични ефекти, обхващащи поколенията. В допълнение към адипогенните ефекти, е доказано, че експозицията на BPA при майки с ниска доза ускорява неврогенезата и миграцията на невроните при мишки и води до анормално формиране на невронална мрежа. Пренаталната/неонаталната експозиция на BPA предизвиква дисфункция на хипокампалната холинергична система. Като последица от ускорената неврогенеза, майчиният BPA намалява популацията на феталните (e14.5) невронни стволови/прогениторни клетки (NPC).
В нашите предварителни проучвания на бременни майки се прилага перорален BPA от 10-ия гестационен ден до срока, показващи повишено телесно тегло и прием на храна. Потомците на язовирите BPA са по-тежки на възраст 1 ден и 3 седмици, което показва затлъстяване в началото. По-нататък изследвахме ефектите на BPA върху пролиферацията на преадипоцити и NSC. Преадипоцитите и хипоталамусните NSC, лекувани с BPA в продължение на 5 дни, показват повишена пролиферация. Тези открития предполагат, че токсинът от околната среда, особено съединенията, разрушаващи ендокринната система, като BPA, могат да имат подчертан ефект върху феталната неврогенеза и адипогенеза, потенциално допринасяйки за настоящата епидемия от затлъстяване.
Епигенетика и програмиране
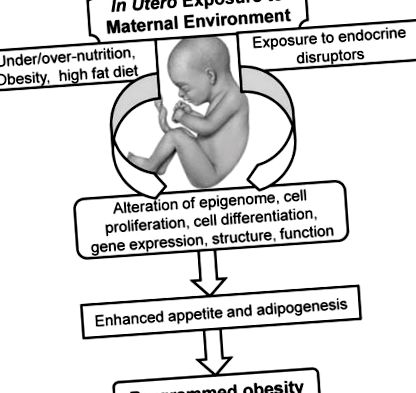
Съществената концепция за „гестационно програмиране“ означава, че хранителната, хормоналната и метаболитната среда, осигурени от майката, трайно променят структурата на органите, клетъчните реакции и генната експресия, които в крайна сметка оказват влияние върху метаболизма и физиологията на нейното потомство (Фигура 1). Освен това тези ефекти варират в зависимост от периода на развитие и като такива бързо растящите плодове и новородени са по-уязвими. Програмиращите събития могат да имат незабавни ефекти, например, увреждане на растежа на органите в критичен етап, докато други програмни ефекти се отлагат, докато не бъдат изразени от променената функция на органа в по-късна възраст. В този случай въпросът е как паметта за ранните събития се съхранява и изразява по-късно, въпреки непрекъснатата клетъчна репликация и подмяна. Това може да бъде медиирано чрез епигенетичен контрол на генната експресия, който включва модификация на генома, без да се променя самата ДНК последователност.
Хранителното излагане на майката и околната среда може да промени феталния епигеном, пролиферацията/диференциацията на стволови клетки и/или структурата на органите, които в крайна сметка влияят на апетита и функцията на мастната тъкан на нейното потомство.
Епигенетичните явления са основна характеристика на развитието на бозайниците, които причиняват наследствени и постоянни промени в генната експресия, без да променят ДНК последователността. Епигенетичната регулация включва промени в модела на метилиране на ДНК и/или модификации на опаковката на хроматин чрез посттранслационни промени в хистона. ДНК метилирането представлява основен епигенетичен механизъм. ДНК на ранния ембрион е хипометилирана и с прогресивно увеличаване на ДНК метилирането в отговор на сигналите от околната среда се получава органогенеза и тъканна диференциация. Повишеното метилиране е свързано с транскрипционно заглушаване. Аномалното метилиране на ДНК може да бъде свързано с неподходящо заглушаване на гените. Като такива, промените в епигенетичните белези са свързани с множество човешки заболявания, включително много видове рак, неврологични разстройства и дори възпаление. Тъй като метилирането включва снабдяване и ензимен трансфер на метилови групи, е вероятно правдоподобните хранителни, хормонални или други метаболитни сигнали да променят времето и посоката на моделите на метилиране по време на развитието на плода.
Друг основен механизъм на генна експресия и заглушаване е опаковането на хроматин в съответно отворено (еухроматично) или затворено (хетерохроматично) състояние. Хроматинът се състои от ДНК, опакована около хистони. Пост-транслационната модификация на хистоновите опашки може да потенцира (напр. Ацетилиране) или да потисне (напр. Деацетилиране) генна експресия.
И накрая, микроРНК се появяват като потенциален трети епигенетичен медиатор. Докато тези некодиращи РНК обикновено са свързани с регулиране на генната експресия на транслационно ниво, скорошна работа предполага, че те могат да участват и в метилирането на ДНК, като по този начин допълнително регулират транскрипцията на своите мишени.
Чрез тези серии епигенетични медиатори, вътреутробното хранене, експозицията на околната среда и вероятно други фактори (напр. Стрес) могат трайно да променят експресията на гените на потомството и структурата и функцията на клетките и органите (Фигура 2).
Епигенетичната регулация включва промени в (i) модела на метилиране на ДНК, (ii) модификации на опаковката на хроматин чрез посттранслационно ацетилиране/деацетилиране на хистон и (iii) некодиращи РНК (miRNA) на ниво транслация. Промененото хранене или експозицията на околната среда могат да модифицират всеки от трите епигенетични регулаторни фактора.
Терапии, приложения и заключения
Епидемията от затлъстяване представлява едно от основните предизвикателства за общественото здраве през 21 век. Разработването на ефективна политика и практика за борба със затлъстяването при деца е основен приоритет за много правителства и здравни специалисти. Има неотменими доказателства, че отклоненията от оптималния растеж в утробата, независимо дали от ограничено или излишно хранене, и нови доказателства, че излагането на определени токсини в околната среда, увеличават относителния риск от затлъстяване при възрастни. Промените в епигеномиката могат да бъдат ключов механизъм, чрез който излагането на околната среда може да повлияе на генната експресия и следователно на фенотипа. Бъдещите стратегии за превенция и терапия на затлъстяването в идеалния случай ще обърнат внимание на програмните ефекти от средата на ранния живот. Най-важното е, че е изключително важно да признаем, че хората със затлъстяване наистина могат да имат повишен апетит и предразположение към съхранение на липиди и адипогенеза.
Благодарности
Нашата отчетена работа се подкрепя от Националните здравни институти R01DK081756 и R01HD054751.
- Влияния върху развитието върху схемите, програмиращи податливостта към затлъстяване - ScienceDirect
- Упражненията по време на бременност намаляват затлъстяването сред потомството - Neuroscience News
- Упражненията по време на бременност предпазват потомството от затлъстяване
- Диетично предизвикано затлъстяване на бащата нарушава когнитивната функция при потомството чрез медиация на епигенетично
- Упражненията по време на бременност намаляват затлъстяването сред потомството WSU Insider Washington State University