Гейл Килрой
От Биомедицинския изследователски център в Пенингтън, Държавна университетска система на Луизиана, Батън Руж, Луизиана 70808
Дейвид Х. Бърк
От Биомедицинския изследователски център в Пенингтън, Държавна университетска система на Луизиана, Батън Руж, Луизиана 70808
З. Елизабет Флойд
От Центъра за биомедицински изследвания в Пенингтън, Държавна университетска система на Луизиана, Батън Руж, Луизиана 70808
Резюме
Въведение
Разширяването на мастната тъкан в отговор на излишния калориен прием е от основно значение за съхраняването на излишната енергия като неутрални липиди. Излишъкът от мастна тъкан обаче е рисков фактор за развитие на инсулинова резистентност и диабет тип 2, тъй като капацитетът за съхранение на липидите на мастната тъкан е надвишен (1). Капацитетът за съхранение на липиди може да се увеличи по два начина: чрез увеличаване на размера на съществуващите адипоцити (хипертрофия) и чрез набиране на стромални клетки за образуване на нови адипоцити (хиперплазия). Постоянно се наблюдава, че хипертрофията на адипоцитите е свързана с инсулинова резистентност (2, 3) и силно свързана с възпаление на мастната тъкан, тъй като границата на разширяване на адипоцитите чрез хипертрофия е достигната (4, 5). С прогресирането на медиирано от макрофаги отстраняване на некротично подобни хипертрофирани адипоцити се образуват нови адипоцити, за да се поддържа капацитет за съхранение на липиди в ремоделираната мастна тъкан (5, –7). Значението на адипоцитната хиперплазия за поддържането на функцията на мастната тъкан предизвика интерес към разбирането на факторите, контролиращи набирането на резидентни стромални клетки от мастна тъкан (8) или получени клетки от костен мозък (9), за да се подложи на адипогенеза.
Системата убиквитин-протеазома е добре описана като контролираща протеолизата и активността на ключови регулаторни протеини, които определят пролиферацията и диференциацията на стволови/прогениторни клетки от неврален, хематопоетичен и мезенхимен произход (10, –12). Системата убиквитин-протеазома функционира като набор от силно подредени ензими, които активират и след това трансферират убиквитин към целеви протеин, което води до медиирано от протеазома разграждане на целевия протеин или непротеолитично регулиране на активността на целевия протеин (13). Протеазомното разграждане на регулаторните протеини, необходимо за ангажиране на мезенхималните клетки-предшественици към остеогенезата, е описано за Wnt/β-катенин (14) и костни морфогенетични протеини (15). Тези пътища също регулират ангажираността към адипогенна линия.
Wnt10b, Wnt10a и Wnt6 инхибират адипогенезата и насърчават остеогенезата чрез β-катенинови механизми (16), които се прекратяват чрез протеазомно разграждане на β-катенин (17). Обратно, Wnt5a насърчава адипогенезата (18) и разграждането на β-катенин (19). Костният морфогенетичен протеин 4 (BMP-4) 2 е член на TGFβ суперсемейството от растежни фактори, които първоначално са идентифицирани като контролиращи костното образуване (20). Следващите данни установяват роля за BMPs в развитието на много тъкани, включително мастна тъкан (21), където BMP-4 насърчава ангажирането на мезенхимни стволови клетки към адипоцитната линия в бялата мастна тъкан (22, –24). Въпреки това, ролята на системата убиквитин-протеазома при набирането на мезенхимни стволови клетки за образуване на адипоцитни прогениторни клетки не е добре дефинирана.
Нашите изследвания в модела на адипогенеза 3T3-L1 показват, че убиквитин лигазата Siah2 насърчава адипогенезата (25). Освен това адипоцитите от мишки Siah2 -/- (Siah2KO) са по-големи от адипоцитите от див тип (26), което предполага, че загубата на Siah2 влияе върху способността да се образуват нови адипоцити in vivo. По този начин ние изследвахме дали Siah2 влияе на адипогенезата чрез Wnt или BMP-4 пътища, използвайки първични стромални клетки от мастна тъкан, получени от мишки от див тип и Siah2KO. Тук докладваме доказателства, че Siah2 функционира над BMP-4, за да регулира ангажирането на стромалните клетки на мастната тъкан към адипогенния път.
Резултати
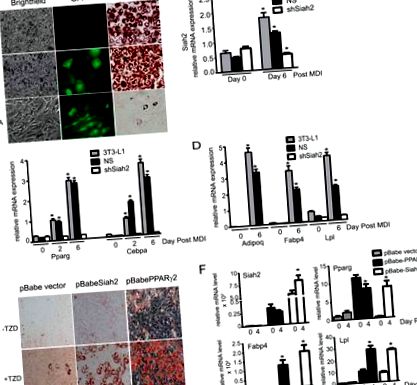
Siah2 Expression насърчава адипогенезата
Siah2 действа над BMP-4 за насърчаване на адипогенезата. Експресията на гени A и B, Bmp-4, Wisp2 и Zfp423 се изследва в ингвинална мастна тъкан от див тип и Siah2KO (A) или преди индукция на адипогенеза в първични ингвинални прилепнали стромални клетки (-MDI) и на ден 4 след индукция (+ MDI) (B). С, маркери за адипогенеза (Pparg, Fabp4 и Lpl), Wnt10b, Wisp2 и Zfp423 генна експресия са анализирани по време на адипогенеза при отсъствие или присъствие на 40 ng/ml BMP-4. D, Маслено червено O оцветяване на неутрално натрупване на липиди на ден 4 след индукция на адипогенезата в стромални клетки от див тип и Siah2KO. Siah2KO стромалните клетки се инкубират в отсъствие (Siah2KO/−BMP-4) или в присъствието на 40 ng/ml BMP-4 (Siah2KO/+ BMP-4). Статистическата значимост на Siah2KO е сравнена с див тип (A), див тип -MDI (B) или съответния ден 0 (C). #, p Фиг. 5 А показва, че нивата на Zfp521 протеин се повишават преди индукцията (ден 0 след индукция) в отсъствието на Siah2 в сравнение с дивия тип и че нивата на Zfp521 се увеличават по време на индукция на адипогенезата в клетките Siah2KO при липса на BMP-4. Когато BMP-4 (40 ng/ml) се добави 1 ден преди индукцията в клетките Siah2KO, нивата на Zfp521 се намаляват значително до ден 2 след индукция и са сравними с дивия тип до ден 4 след индукция. Експерименти in vitro (фиг. 5 Б) показват, че маркираните с HA нива на ZFP521 са значително намалени в присъствието на FLAG-Siah2, но се увеличават чрез протеазомно инхибиране (епоксомицин), когато се експресират самостоятелно или в присъствието на FLAG-Siah2, което показва, че Siah2 се увеличава протеазомно разграждане на Zfp521. Оцветяването с MemCode (фиг. 5 С) на нитроцелулозната мембрана, съответстващо на Western blot, показано на фиг. 5 В, потвърждава еднакво натоварване на протеин във всяка лента. Взети заедно, нашите резултати показват, че Siah2 регулира ранните стъпки в ангажираността с адипогенезата чрез регулиране на нивата на Zfp521 протеин по BMP-4-зависим начин за насърчаване на експресията на Zfp423 иРНК (Фиг. 5 D).
Siah2 регулира нивата на Zfp521 протеин. A, Zfp521 нива на протеини бяха анализирани по време на индуциране на адипогенеза в стромални клетки, изолирани от див тип и ингвинална мастна тъкан на Siah2KO. Контролът Zfp521 е без етикет на мишка Zfp521, преходно експресиран в клетки HEK293. Където е посочено, BMP-4 (40 ng/ml) се добавя 2 дни преди индуциране на адипогенеза. В, клетките HEK293 бяха временно трансфектирани с HA-Zfp521 и pcDNA3.1 или HA-Zfp521 и FLAG-Siah2 и третирани с протеазомния инхибитор епоксомицин (1 μ m), както е посочено. Горният панел е с къса филмова експозиция, а долният панел е с дълга филмова експозиция за откриване на HA-Zfp521. Нивата на протеини (А и В) бяха анализирани чрез Western blot анализ. C, MemCode оцветяване на общия протеин, присъстващ в B. D, схематично изобразяващо Siah2-медиирано ангажиране към адипогенезата чрез регулиране на път, който включва експресия на BMP-4, Zfp521 и Zfp423 в стромалните съдови клетки на мастната тъкан.
Дискусия
Идентифицирането на факторите, които участват в превръщането на адипоцитни стромални клетки в зрели адипоцити, е фундаментално важно за разбирането на разширяването на мастната тъкан при затлъстяване. Адипоцитите във висцералните и подкожните мастни депа на слаби или затлъстели мишки Siah2KO са хипертрофирани, в съответствие с нарушената адипогенеза in vivo, свързана със загубата на Siah2 (26). Въпреки че адипогенезата е нарушена, както слабите, така и затлъстелите мишки Siah2KO са по-чувствителни към инсулин в сравнение с дивия тип. Заедно с други проучвания, показващи, че увеличените адипоцити могат да бъдат свързани с метаболитно здраве (38), тези резултати показват, че в мастната тъкан може да възникне достатъчен капацитет за съхранение на липиди, независимо от стабилния адипогенен отговор на енергийните предизвикателства.
Въпреки че ензимите на убиквитин-протеазомната система са добре описани като регулиращи пролиферацията и диференциацията на стволови и прогениторни клетки, фокусът беше до голяма степен върху разбирането на ролята на ензимите на убиквитин-протеазомната система в регулирането на плурипотентността и препрограмирането в ембрионалните стволови клетки (10, 40 ). Натрупват се обаче доказателства, че ензимите на убиквитиновата система контролират стабилността и активността на редица протеини, които регулират крайната адипогенеза (41, –43). Като се има предвид реципрочният характер на образуването на адипоцити и остеобласти, доказателствата, че убиквитин-протеазомната система влияе върху образуването на костите чрез регулиране на експресията на bmp-2 (15), подкрепят ролята на ензимите на убиквитиновата система при определяне дали мезенхималните клетки-предшественици се набират за адипогенеза. По-специфична връзка с Siah2 се намира в проучвания, които показват, че c-Cbl, цитоплазмена убиквитин лигаза, която регулира пролиферацията и диференциацията на остеобластите (44), също си партнира със Siah2 за контрол на сигналните събития в клетъчната пролиферация и диференциация (45, 46).
Това проучване поставя Siah2 като регулация нагоре на експресията на гена zfp423 и показва, че Siah2 влияе върху експресията на гена Zfp423 чрез регулиране на експресията на Bmp-4 и стабилността на протеина Zfp521. Като цяло, нашите резултати показват, че механизмите, свързващи Zfp423 и BMP-4-медиирана регулация на адипогенезата, се разпростират и върху контрола върху експресията на гена Zfp423 и Bmp-4. Нашите резултати ясно поставят убиквитин лигазата Siah2 като фактор, който медиира връзката между експресията на Bmp-4 и Zfp423 при определяне на ангажираността на мастните стромални клетки към адипогенна линия.
Експериментални процедури
Експерименти с животни
Диви и глобални Siah2 -/- (Siah2KO) C57BL/6J мъжки мишки бяха настанени с 12-часов цикъл светлина-тъмнина при 24 ° C. Всички експерименти с животни са проведени в съответствие с Ръководството за грижа и използване на лабораторни животни и одобрено от Комитета за грижа и употреба на животните в Pennington Biomedical Research Center (протокол 876). На възраст 4-8 седмици мишките бяха евтаназирани между 8-11 часа сутринта и ингвиналната и епидидималната мастна тъкан бяха събрани за анализ на цялата тъкан или за изолиране на SVF клетки и зрели адипоцити.
Клетъчна култура
Миши 3T3-L1 преадипоцити се посяват и отглеждат до 2 дни след сливането в DMEM с високо съдържание на глюкоза с 10% говежди серум, 100 единици пеницилин/100 μg стрептомицин. Средата се сменяше на всеки 48 часа. Клетките бяха индуцирани да се диференцират чрез промяна на средата до DMEM с високо съдържание на глюкоза, съдържаща стандартна индукционна смес от 10% FBS, 0,5 mm изобутилметилксантин (IBMX), 1 μ m дексаметазон, 1,7 μ m инсулин (MDI) и 100 единици пеницилин/100 μg стрептомицин. След 48 часа тази среда беше заменена с DMEM с високо съдържание на глюкоза, допълнена с 10% FBS, и клетките бяха поддържани в тази среда. NIH 3T3 фибробластните клетъчни линии (ATCC), ектопично експресиращи Siah2 или PPARy, бяха индуцирани да се диференцират със стандартна индукционна смес в присъствието или отсъствието на розиглитазон (TZD, 2.5 μ m). Клетките HEK293 се поддържат в DMEM с високо съдържание на глюкоза с 10% FBS, 100 единици пеницилин/100 μg стрептомицин.
Мастната тъкан, получена от мишки от див тип или Siah2KO, се смила и суспендира в PBS, допълнена с 0,1% говежди серум и 0,1% колагеназа тип I (Уортингтън), предварително загрята до 37 ° С при 10 ml/2 g тъкан. Тъканта се инкубира в разклащаща се водна баня при 37 ° С в продължение на 1 час и се центрофугира при 450 х g за 5 минути при стайна температура. Зрели адипоцити от ингвинални и епидидимни мастни накладки бяха събрани от супернатантата и обработени за изолиране на РНК. Гранулираните SVF клетки от двете мастни подложки също се обработват за изолиране на РНК. SVF клетките от ингвиналната мастна тъкан бяха ресуспендирани в стромална среда (DMEM/Ham's F-12 среда, 15% FBS, 100 единици пеницилин/100 μg стрептомицин), покрити и поддържани, както е описано по-горе (47). Когато клетките бяха 80–90% сливащи се, стромалната среда беше заменена за диференцираща среда (DMEM/Ham's F-12 среда с 3% FBS, 0,5 mm IBMX, 33 μ m биотин, 17 μ m пантотенат, 1 μ m инсулин, 1 μm дексаметазон, 2,5 μm розиглитазон и 100 единици пеницилин/100 μg стрептомицин). След 3 дни средата беше заменена за поддържаща среда, която беше идентична със средата за диференциация, с изключение на това, че IBMX и розиглитазон бяха изтрити. BMP-4 (Life Technologies, 40 ng/ml) се добавя към средата 5 дни преди индукцията.
Генериране на стабилни клетъчни линии
Ретровирус-медиирана стабилна експресия на shRNA, насочена към Siah2 (SMARTvector лентивирусна shRNA) или не-заглушаваща контролна последователност на фиби, съдържаща маркер TurboGFP във вектора pGIPZ (Dharmacon), е генерирана в 3T3-L1 преадипоцити в съответствие с инструкциите на производителя. Изборът на преадипоцити, съдържащи желаната shRNA, се извършва с използване на пуромицин (2.5 μg/ml) в продължение на 2 седмици. β-Катенинът се изчерпва в неглушителните pGIPZ и pGIPZ-shSiah 3T3-L1 преадипоцити чрез обратна трансфекция (48), използвайки siRNA, насочена към β-катенин (Dharmacon SMARTpool On-Targetplus siRNA). Преадипоцитите бяха трансфектирани 1 ден преди индуциране на клетките да претърпят адипогенеза. Изчерпването на целевите гени беше потвърдено с помощта на qRT-PCR. За да се свръхекспресира Siah2 в NIH3T3 фибробласти, Siah2 cDNA се амплифицира чрез PCR, за да съдържа 5 'EcoR1 рестрикционно място и 3' Sal1 рестрикционно място. PCR продуктът се пречиства (Qiagen MiniElute PCR пречистване) и се вкарва във pBabePuro вектор (Addgene), като се използва насочена към сайта мутагенеза (Stratagene QuikChange). Последователността беше потвърдена чрез дидеокси секвениране преди трансфекция на pBabePuro-Siah2 във NIH3T3 фибробласти, както е описано по-горе (49).
Преходна трансфекция на HA-Zfp521 и FLAG-Siah2
CDNA на мишка Zfp521 беше получена от OriGene (TrueClone cDNA) и етикетът на HA епитоп беше вмъкнат след стартовия кодон, използвайки насочена към сайта мутагенеза (Stratagene QuikChange II) и потвърдена чрез дидеокси секвениране, както е описано по-горе (25). Клетките HEK293 се отглеждат до 40–70% сливане и се извършват преходни трансфекции, като се използват общо 2 μg cDNA/ямка и Polyfect съгласно инструкциите на производителя (Qiagen). Клетките бяха трансфектирани с HA-Zfp521 и pcDNA3.1 или HA-Zfp521 и FLAG-Siah2. Четиридесет и осем часа след трансфекцията, клетките бяха третирани с контрол на носителя (DMSO) или епоксомицин (1 μ m) и екстракти от цели клетки бяха събрани 4 часа по-късно.
Маслено червено O оцветяване
Оцветяването с маслено червено O се извършва, както е описано от Green и Kehinde (50).
Количествена PCR
Общата РНК беше транскрибирана обратно (200 ng РНК), използвайки Multiscribe обратна транскриптаза (Applied Biosystems) с произволни праймери при 37 ° С за 2 часа. PCR в реално време се извършва с TaqMan химия, използвайки 7900 PCR система в реално време и универсални условия на циклиране (50 ° C за 2 минути; 95 ° C за 10 минути и 40 цикъла от 95 ° C за 15 s и 60 ° C за 1 min, последвано от 95 ° C за 15 s, 60 ° C за 15 s и 95 ° C за 15 s). Резултатите се нормализират до нивата на тРНК на циклофилин В или убиквитин В и се анализират с помощта на метода 2 -ΔΔCT.
Приготвяне на екстракти от цели клетки и имуноблотинг
Екстрактите от цели клетки се приготвят чрез хомогенизиране в 50 mm Tris/Cl (pH 7,4) със 150 mm NaCl, 1 mm EDTA, 1% Igepal СА 630, 0,5% натриев дезоксихолат, 0,1% SDS, 10 mm N-етилмалеимид, протеазни инхибитори ( 1 mm PMSF, 10 μg/ml апротинин, 1 μg/ml пепстатин и 5 μg/ml левпептин) и инхибитор на фосфатазата (2 mm натриев ортованадат). Пробите се центрофугират при 14 000 × g в продължение на 10 минути при 4 ° C и концентрациите на протеин се определят чрез анализ на BCA (Thermo Fisher Scientific).
Гел електрофореза и имуноблотинг
Протеините се разделят в полиакриламидни (National Diagnostics) гелове, съдържащи SDS и се прехвърлят в нитроцелулоза (Bio-Rad). След прехвърляне мембраната се блокира в 4% мляко в 25 m m Tris/Cl (рН 8,0) със 150 m m NaCl, 0,1% Tween 20 (TBS-T) за 1 h при стайна температура. Мембраните бяха инкубирани с антитела срещу PPARγ (Santa Cruz Biotechnology, sc-7273, 1: 200; Abcam, 19481, 1: 500), β-катенин (Bethyl Laboratories, A302-012A-M, 1: 1000), Zfp521 ( ProSci, 6859, 1: 1000), HA епитопен етикет (BioLegend, 901513, 1: 2000) и FLAG епитопен маркер (Sigma, F1804, 1: 500) за 1-2 часа при стайна температура. Резултатите бяха визуализирани с конюгирани с HRP вторични антитела (Jackson ImmunoResearch Laboratories) и засилена хемилуминесценция (Thermo Fisher/Pierce). Равното натоварване беше определено с помощта на MemCode (Thermo Fisher Scientific) оцветяване на нитроцелулозната мембрана.
Статистически анализ
Статистическата значимост беше определена с помощта на несдвоен двустранен t тест. За статистически анализи е използван софтуерът GraphPad Prism 5. Данните за мастната тъкан (фиг. 4 А) са получени от 4 мишки/група, а адипогенезата в първичните SVF клетки се извършва в обединени проби от три до четири мишки и се повтаря най-малко два пъти. Експериментите в 3T3-L1 адипоцитите и клетките HEK293 се повтарят поне два пъти за минимум три повторения. Всички технически повторения бяха извършени в три екземпляра. Променливостта се изразява като средната стойност ± S.D.
Принос на автора
G. K. и Z. E. F. проектират, изпълняват и анализират експериментите, показани на фиг. 1 1 - 4. D. H. B. предостави техническа помощ за експериментите, показани на фиг. 1. Z. E. F. координира проучването и пише доклада. Всички автори прегледаха резултатите и одобриха окончателната версия на ръкописа.
Благодарности
В тази работа са използвани съоръженията за клетъчна биология и биоизображение и Genomics Core в Биомедицинския изследователски център в Пенингтън, които се подпомагат отчасти от безвъзмездните средства на COBRE (NIH 8P20-> GM103528) и NORC (NIH 2P30-> DK072476) от Националните институти на Здраве.
* Тази работа беше подкрепена от NIDDK, Национален здравен институт, грант 1R01DK099625 (на Z. E. F.). Авторите декларират, че нямат конфликт на интереси със съдържанието на тази статия. Съдържанието е отговорност единствено на авторите и не представлява непременно официалните възгледи на Националните здравни институти.
- Връзка между нивото на карбамид в млякото, храненето с протеини и екскрецията на азот в урината при високо
- Протеинова диета след бременността за здравословно отслабване по време на кърмене; Радостни бъркотии
- Reg Park Диета и план за тренировка - Учител на протеини
- Рискове от затлъстяване при майките за забавяне на развитието в ранна детска възраст SpringerLink
- Въпроси на затлъстяването на размера като проблем с разнообразието в областта на ранното детство SpringerLink