Субекти
Резюме
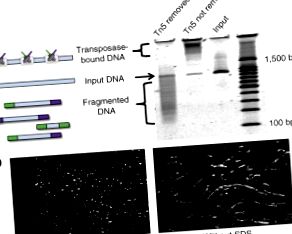
Разрешеното от хаплотип геномно секвениране дава възможност за точна интерпретация на медицински релевантни генетични вариации, дълбоки изводи относно популационната история и неинвазивно прогнозиране на фетални геноми. Описваме подход за хаплотипиране в целия геном, базиран на транспозиция, запазваща съседността (CPT-seq) и комбинаторно индексиране. Транспонирането на Tn5 се използва за модифициране на ДНК с адаптерни и индексни последователности, като същевременно се запазва съседство. След разреждане и разделяне на ДНК транспозазата се отстранява, като ДНК се разделя в индивидуално индексирани библиотеки. Библиотеките във всяко отделение, обогатени за съседни геномни елементи, се индексират допълнително чрез PCR. Комбинаторното индексиране с 96 сплетения на етапа на транспониране и PCR позволява изграждането на поетапни синтетични четения от всяко от близо 10 000 „виртуални отделения“. Демонстрираме осъществимостта на този метод, като събираме> 95% от хетерозиготните варианти в човешкия геном в дълги, точни хаплотипни блокове (N50 = 1,4–2,3 Mb). Бързият, мащабируем и рентабилен работен поток може да позволи разделителната способност на хаплотипа да се превърне в рутина в секвенирането на човешкия геном.
Опции за достъп
Абонирайте се за Journal
Получете пълен достъп до дневник за 1 година
само 4,60 € на брой
Всички цени са нетни цени.
ДДС ще бъде добавен по-късно при плащане.
Наем или покупка на статия
Получете ограничен или пълен достъп до статии в ReadCube.
Всички цени са нетни цени.
Кодове за присъединяване
Основни присъединения
BioProject
Препратки
Bansal, V. et al. Следващата фаза в човешката генетика. Нат. Биотехнол. 29, 38–39 (2011).
Tewhey, R. et al. Значението на фазовата информация за човешката геномика. Нат. Преподобни Genet. 12, 215–223 (2011).
Фен, Х.Ц. и др. Неинвазивно пренатално измерване на феталния геном. Природата 487, 320–324 (2012).
Kitzman, J.O. и др. Неинвазивно секвениране на целия геном на човешкия плод. Sci. Превод Med. 4, 137ra76 (2012).
Sabeti, P.C. и др. Откриване на скорошна положителна селекция в човешкия геном от хаплотипна структура. Природата 419, 832–837 (2002).
Adey, A. et al. Разрешен хаплотип геном и епигеном на клетъчната линия на анеуплоидния HeLa рак. Природата 500, 207–211 (2013).
Tishkoff, S.A. et al. Глобални модели на неравновесие на връзките в CD4 локус и съвременен човешки произход. Наука 271, 1380–1387 (1996).
Kong, A. et al. Откриване на споделяне чрез спускане, фаза на дълги разстояния и приписване на хаплотип. Нат. Genet. 40, 1068–1075 (2008).
Hosomichi, K. et al. Фазово дефинирано пълно секвениране на HLA гените чрез секвениране от следващо поколение. BMC Genomics 14., 355 (2013).
Браунинг, С.Р. И Браунинг, B.L. Поетапност на хаплотипа: съществуващи методи и нови разработки. Нат. Преподобни Genet. 12, 703–714 (2011).
Bansal, V. et al. MCMC алгоритъм за сглобяване на хаплотип от данни за последователността на целия геном. Геном Res. 18., 1336–1346 (2008).
Той, D. et al. Оптимални алгоритми за сглобяване на хаплотип от данни за последователността на целия геном. Биоинформатика 26, i183 – i190 (2010).
Kaper, F. et al. Хаплотипизиране на целия геном чрез разреждане, усилване и секвениране. Proc. Natl. Акад. Sci. САЩ 110, 5552–5557 (2013).
Кицман, Дж. и др. Разрешено от хаплотип геномно секвениране на индиански гуджарати. Нат. Биотехнол. 29, 59–63 (2011).
Питърс, Б.А. и др. Точно секвениране на целия геном и хаплотипизиране от 10 до 20 човешки клетки. Природата 487, 190–195 (2012).
Фен, Х.Ц. и др. Цялогеномен молекулярен хаплотип на единични клетки. Нат. Биотехнол. 29, 51–57 (2011).
Levy, S. et al. Диплоидната геномна последователност на отделен човек. PLoS Biol. 5, e254 (2007).
Duitama, J. et al. Базиран на фосмид цял геномен хаплотип на дете от трио HapMap: оценка на отделни индивидуални техники на хаплотипиране. Нуклеинови киселини Res. 40, 2041–2053 (2012).
Suk, E.K. и др. Изцяло молекулярно разрешен хаплотип геном на европейски индивид. Геном Res. 21., 1672–1685 (2011).
Lo, C. et al. Относно дизайна на хаплотипиране на базата на клонинг. Геном Biol. 14., R100 (2013).
Geraci, F. Сравнение на няколко алгоритми за единичния индивидуален проблем за възстановяване на хаплотипирането на SNP. Биоинформатика 26, 2217–2225 (2010).
Caruccio, N. Подготовка на библиотеки за секвениране от следващо поколение с използване на технологията Nextera: едновременно фрагментиране на ДНК и маркиране на адаптер от инвитро транспониране. Методи Mol. Biol. 733, 241–255 (2011).
Adey, A. et al. Бърза конструкция на библиотеки с фрагменти от пушка с ниска входна и ниска пристрастност с висока плътност инвитро транспониране. Геном Biol. 11., R119 (2010).
Erlich, Y. et al. ДНК Судоку - използване на високопроизводително секвениране за мултиплексиран анализ на проби. Геном Res. 19., 1243–1253 (2009).
Duitama, J. et al. в Proc. 1-ви ACM Int. Conf. Изчисляване на биоинформатика. Biol. 160–169 (ACM (Асоциация за изчислителни машини), Ню Йорк, 2010).
Кулешов, В. и др. Хаплотипиране на целия геном с използване на дълги четения и статистически методи. Нат. Биотехнол. 32, 261–266 (2014).
Abecasis, G.R. и др. Карта на вариация на човешкия геном от секвениране в популационен мащаб. Природата 467, 1061–1073 (2010).
Конрад, Д.Ф. и др. Разлика в честотата на мутации в целия геном в и между човешките семейства. Нат. Genet. 43, 712–714 (2011).
Kamphans, T. et al. Филтриране на разнородни варианти на хетерозиготна последователност в роднини, които не са кръвни. PLOS ONE 8, e70151 (2013).
Bentley, D.R. и др. Точно секвениране на целия човешки геном, използвайки обратима терминаторна химия. Природата 456, 53–59 (2008).
Lo, C. et al. Строб дизайн на последователност за сглобяване на хаплотип. BMC Биоинформатика 12 (доп. 1), S24 (2011).
Fu, A.Y. и др. Микрофабрициран флуоресцентно активиран клетъчен сортер. Нат. Биотехнол. 17, 1109–1111 (1999).
Hua, Z. et al. Мултиплексирана верижна реакция на полимераза в реално време на цифрова микрофлуидна платформа. Анален. Chem. 82, 2310–2316 (2010).
Adey, A. et al., Информация за дълги разстояния за de novo сглобяване на генома чрез транспозазна съседност. Геном Res. 10.1101/gr.178319.114 (19 октомври 2014 г.)
Li, H. & Durbin, R. Бързо и точно подравняване с кратко четене с трансформация на Burrows-Wheeler. Биоинформатика 25, 1754–1760 (2009).
Благодарности
Благодарим на J. Bruand, F. Zhang и A. Kia за помощта при анализа на данните. Също така сме благодарни на И. Горишин, Н. Каручио и Р. Вайдянатан за дискусиите на различни етапи от проекта. Благодарим също на S. Norberg, J. Zhang, J. Bernd, T. McSherry, T. Le, P. Diep и G. Roberts за извършването на секвениране, подпомагане на персонализирани рецепти и подпомагане на трансфера на данни. J.S. беше подкрепена с безвъзмездна помощ HG006283 от Националния институт за изследване на човешкия геном. А.А. и J.O.K. бяха подкрепени от стипендия за изследователска дейност DGE-0718124 от Националната научна фондация.
Информация за автора
Принадлежности
Illumina, Inc., Advanced Research Group, Сан Диего, Калифорния, САЩ
Сасан Амини, Дмитрий Пушкарев, Лена Кристиансен, Емрах Костем, Том Ройс, Кейси Тюрк, Наташа Пигнатели, Кандасвами Виджаян, Мостафа Ронаги, Кевин Г Гундерсън и Франк Дж Стиймърс
Департамент по геномни науки, Университет във Вашингтон, Сиатъл, Вашингтон, САЩ
Андрю Адей, Джейкъб О Кицман и Джей Шендуре
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Вноски
F.J.S., S.A. и K.L.G. замислил проучването. F.J.S. ръководи развитието на технологиите. S.A. ръководи разработването на анализа, извършва експерименти и анализира данните. L.C., C.T., N.P., A.A. и J.O.K. извършва експерименти. T.R. и Е.К. извършен анализ на данни. D.P. разработи конвейер за анализ. К.В. разработи едномолекулна образна система и събра изображения за едномолекулни експерименти. S.A., L.C., D.P., M.R., K.L.G., J.S. и F.J.S. съавтор на ръкописа. Всички автори са допринесли за преразглеждането и прегледа на ръкописа.
Автора за кореспонденция
Етични декларации
Конкуриращи се интереси
S.A., D.P., L.C., E.K., T.R., C.T., N.P., K.V., M.R., K.L.G. и F.J.S. декларират конкурентни финансови интереси под формата на притежание на акции и платена заетост от Illumina, Inc.
Интегрирана допълнителна информация
Допълнителна фигура 1 Едномолекулно изображение на непрекъснато транспонирана ДНК.
Едномолекулно изобразяване на непрекъснато транспонирана ДНК с помощта на маркирани с Cy5 транспозоми и маркирани с YOYO-1 ДНК (оцветени съответно в червено и синьо). Конфигурацията „мъниста на нишка“ на субстратната ДНК след транспозиция (горният панел с Mg 2+) показва, че целевата ДНК не е фрагментирана след транспонирането. При липса на Mg 2+, транспозозомните комплекси се свързват със субстратната ДНК (горен панел, без Mg 2+), но не се транспонират в ДНК; следователно, лечението с протеаза не фрагментира ДНК, предварително изложена на транспозоми в отсъствието на Mg 2+ (долен панел, без Mg 2+, с протеаза). Когато транспонирането е настъпило в присъствието на Mg 2+ и протеаза (която усвоява транспозазата), ДНК фрагменти (долен панел, с Mg 2+, с протеаза).
Допълнителна Фигура 2 Пример за доказателство, показващ разпределението на стойностите на разстоянието между тандемните подравнения с SDS обработка преди или след стъпката на разреждане.
Допълнителна фигура 3 Проектиране на двустепенни (транспозон и PCR) индексирани шаблони и схема за отчитане на последователността.
Универсални транспозонови последователности и индекси (т.е. индекси T5 и T7) се въвеждат в пробата по време на етапа на транспониране. По време на PCR стъпката, припокриването между PCR и транспозоновите олигонуклеотиди (т.е. универсален съединител) се използва за въвеждане на универсални последователности на последователността (т.е. P5 и P7) заедно с индексите на PCR (т.е. индексите P5 и P7). Има 8 различни P5, 12 различни P7, 8 различни T5 и 12 различни последователности на индекса T7 (вж. Онлайн методи и допълнителна таблица 4).
Допълнителна фигура 4 Графика на интензитета спрямо цикъла за типично двустепенно изпълнение на последователността с двойно индексиране.
Редът на четене на секвениране е както следва: геномна ДНК чете 1 (цикли 1-51), индекс 1 (транспозон i7, цикли 52-59 и PCR i7, цикли 60-67), индекс 2 (PCR i5, цикли 68- 75 и транспозон i5, цикли 76–83) и геномна ДНК чете 2 (цикли 84–134).
Допълнителна фигура 5 Пулсово поле гел електрофореза на геномни ДНК проби, използвани в това проучване.
Пробите NA12878, NA12891 и NA12892 са закупени от Coriell или са приготвени с помощта на протокола Gentra. Всички проби бяха анализирани със система за електрофореза с гел с импулсно поле Bio-Rad, използвайки 1% агарозен гел за 16 h при 14 ° C при 170 V с време на превключване, започващо от 1 s и прогресиращо до 6 s.
Допълнителна Фигура 6 Представителни графики за покритие за три индекса.
Разпределението на подравнени секвенирани четения се начертава за три индекса, като проксималните региони се показват като острови през част от хромозома 22. Моментната снимка е генерирана с Интегриран преглед на геноми (IGV) v.2.3 (Broad Institute).
Допълнителна Фигура 7 Представително разпределение на разстоянията между тандемните изравнения за един индекс.
Наблюдава се бимодално разпределение, като проксималните и дисталните геномни области се разделят на две отделни субпопулации. Геномна ДНК на NA12878, получена от препарат на Gentra, беше обработена с CPT-seq работен поток и секвенирана в четири ленти на HiSeq 2000. Данните бяха демултиплексирани и картографирани в референтния човешки геном (hg19).
Допълнителна фигура 8 Разпределение на вътрешно-островните стойности на покритие.
Границите на хаплотипирането на острова бяха определени чрез намиране на клъстери четения, така че разстоянието между всеки две последователни четения да не надвишава 15 kb и във всеки клъстер имаше поне пет уникални двойки четене. Изчислена е фракцията на всеки остров за хаплотипиране, обхванат от секвениране, и разпределението е начертано.
Допълнителна фигура 9 Резюме на тръбопровода за анализ на данни за фаза на целия геном.
Демултиплексираните последователни четения от всички 9 216 дяла бяха подравнени към човешкия референтен геном (hg19). Координатите за подравняване бяха използвани за извикване на хаплотипизиращи острови. За всеки дял бяха генерирани първоначални блокове за хаплотипиране чрез фазови хетерозиготни SNP, използвайки ReFHap 25. Впоследствие SNP, които бяха свързани само с една точка от данни или показваха противоречиви обаждания от множество острови, бяха премахнати. След това бяха използвани данни от панел на проекта 1000 Genomes за фазиране на допълнителни SNP.
Допълнителна фигура 10 Шиене срещу приписване на пълнене.
Данни от проекта 1000 Genomes могат да се използват за генериране на по-дълги блокове за хаплотипиране чрез свързване на по-малки блокове (пришиване на шевове). Като алтернатива тези данни могат да се използват за запълване на пропуските за SNP, които липсват и не са обхванати от експериментални данни с висока степен на доверие (приписване на пълнене). Ние отчитаме данни с (стъпка III) и без (ReFHap точност, стъпка I) приписване (Таблица 1). Импутацията се използва само за запълване на празнини, тъй като импутацията на шевовете може потенциално да доведе до високи нива на грешки при дълъг превключвател. Следователно N50 на сглобените блокове за халотипиране не се променя след стъпката на импутиране. M означава SNP от майката, а D означава SNP от бащата. В идеалния случай хаплотипният низ ще се състои само от M или D SNP.
Допълнителна фигура 11 Дълбочина на секвениране, фазово покритие и точност.
Процентът на фазираните SNP и точността на фазирането се нанасят като функция от дълбочината на секвениране.
- Можете ли да отслабнете само като пиете смути от киви! Времена на Индия
- Отслабване с чесън и други ползи за здравето - HealthifyMe Blog
- Най-дебелата държава в света Коя е най-дебелата държава списание СЗО
- Хранене по време на бременност Храни, които поддържат вашето здраве - и вашето бебе; s Прецизно хранене
- Рецепта от чесън, джинджифил и соя, печени аспержи, гъби и сладка чушка