Оливия М. Фар
1 отдел по ендокринология, Медицински център на Бет Израел за дяконеса/Медицинско училище в Харвард, Бостън, Масачузетс 02215
Chiang-shan R. Li
2 Катедра по психиатрия, Медицинско училище в Йейлския университет, Ню Хейвън, CT 06519
3 Катедра по неврология, Медицински факултет на университета в Йейл, Ню Хейвън, CT 06520
4 Междуведомствена програма по неврология, Медицинско училище в Йейлския университет, Ню Хейвън, CT 06520
Христос С. Манцорос
1 отдел по ендокринология, Медицински център на Бет Израел за дяконеса/Медицинско училище в Харвард, Бостън, Масачузетс 02215
Резюме
Апетитът и регулирането на телесното тегло се контролират от централната нервна система (ЦНС) по доста сложен начин. Човешкият мозък играе централна роля в интегрирането на вътрешни и външни входове за модулиране на енергийната хомеостаза. Въпреки че понастоящем хомеостатичният контрол от хипоталамуса се счита за главно отговорен за контрола на апетита, повечето от наличните доказателства произтичат от експерименти с гризачи и ролята на тази система за регулиране на апетита при състояния на глад/глад и в патогенезата на преяждането/затлъстяването остава да бъде напълно изяснено при хората. Освен това когнитивните и афективни процеси са замесени в дисрегулацията на хранителното поведение при хората, но техният точен относителен принос, както и съответните механизми в основата остават неясни. Тук правим кратък преглед на всяка от тези системи и представяме текущото състояние на изследванията в опит да актуализираме както клиницистите, така и клиничните изследователи относно състоянието и бъдещите насоки на изследванията за затлъстяване.
Затлъстяването е все по-голямо безпокойство в световен мащаб и е обявено за глобална здравна епидемия през 2003 г. от Световната здравна организация. Особено изразено в индустриализираните страни, включително САЩ, една трета или повече от населението е със затлъстяване, а допълнителна трета е с наднормено тегло [1]. Други държави бързо следват фаза на изоставане, която отразява тяхната степен на западност. За да се разберат и разработят ефективни терапевтични средства за това медицинско състояние, е необходимо да се разберат механизмите на централната нервна система (ЦНС), които са в основата на хранителното поведение и как тези механизми стават нерегулирани.
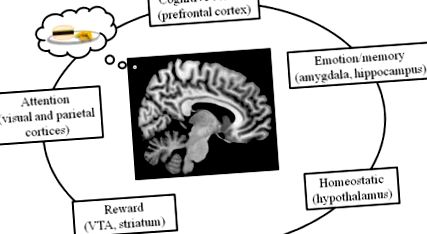
Настоящите изследвания показват, че мозъчната верига, която контролира храненето при хората, се регулира не само от хомеостатични механизми, но също така и от възнагражденията, емоциите/паметта, вниманието и системите за когнитивен контрол (Фигура 1). Тези вериги си взаимодействат, за да контролират енергийния прием и разход. Тук, след въвеждане на техниките, които се използват за изследване на човешкия мозък, ще опишем всяка от тези системи, като започнем с хомеостатичния контрол на храненето в хипоталамуса и завършим с префронталните процеси на когнитивния контрол.
Контролът на храненето в човешкия мозък се регулира от няколко системи, включително хомеостатичните мозъчни системи (хипоталамус), системи за внимание (включително теменната и зрителната кора), системи за емоции и памет (като амигдалата и хипокампуса), когнитивния контрол (включително префронталния кортекс) и мрежата за награди (включително VTA и стриатума).
Техники за изследване на ЦНС при клинични изследвания
Магнитоенцефалограмата (MEG) и Електроенцефалограмата (EEG) са неинвазивни инструменти, които откриват активирането на мозъка с по-добра времева разделителна способност, но по-лоша пространствена разделителна способност от fMRI. Невронната активност се състои от промени в електрическите токове и ЕЕГ откриват директно електрическите потенциали, а МЕГ откриват магнитните полета, генерирани от електрическите токове. MEG имат малко по-добра пространствена разделителна способност от EEG, но и двете отстъпват на fMRI. Налични са аналитични инструменти за възстановяване на локусите на активиране въз основа на пространственото разпределение на MEG и EEG сигнали и улесняване на сравненията на MEG/EEG и fMRI находките [30]. При изследване на затлъстяването MEG е използван за определяне на времевия профил на нервния отговор на категоризиране и запаметяване на хранителни сигнали [31]. ЕЕГ е използван за изследване на разликите в отговорите на емоционални или хранителни сигнали при затлъстяване [32] и как общата реакция на мозъка към хранителни сигнали се различава преди и след тренировка при затлъстели индивиди [33]. Например, фронталната бета активност, регистрирана от ЕЕГ по време на задача за внимание, корелира със загуба на контрол върху мерките за хранене при подрастващите момичета, показваща връзки между фронтални активирания, внимание и прием на храна, които могат да стоят в основата на развитието на затлъстяването [34].
Хомеостатични мозъчни системи
Контролът на храненето в човешкия мозък е сложен и включва няколко нервни системи. Хомеостатичният контрол на храненето включва предимно хипоталамуса в регулирането на приема на храна. Дъгообразното ядро на хипоталамуса контролира апетита и съдържа неврони, които експресират про-опиомеланокортин (POMC) и кокаин- и амфетамин-регулиран транскрипт (CART), които намаляват апетита и увеличават енергийните разходи, и неврони, които експресират свързания с аготи протеин (AgRP) и невропептид Y (NPY), които повишават апетита и намаляват енергийните разходи [37]. Тези неврони се модулират от периферни хормонални сигнали, които действат в хипоталамуса, за да инхибират или възбудят тези неврони, за да променят апетита. Невроните в дъгообразното ядро комуникират с други орексигенови и анорексигенни неврони в други ядра на хипоталамуса, за да контролират храненето (Фигура 2; [38-40]).
Схема на ядрата в хипоталамуса, които допринасят за контрола на храненето, както и на входа от периферията. Дъгообразното (ARC) ядро съдържа NPY/AgRP неврони, които са орексигенни и POMC/CART неврони, които са анорексигенни. Тези неврони комуникират с другите ядра и неврони, които освобождават други орексигенови или анорексигенни пептиди. Моля, обърнете внимание, че невроните може да не освобождават всички показани анорексигенни или орексигенни пептиди (напр. Единичен неврон не може да освобождава TRH, окситоцин, AVP и CART в PVN), но са показани в групи според това дали са анорексигени или орексигени във всяко ядро. AgRP, свързан с агути пептид; ARC, дъговидно ядро; AVP, аргинин-вазопресин; BDNF, мозъчен невротрофичен фактор; CART, кокаин и амфетамин регулиран препис; DMH, дорзомедиален хипоталамус; LH, страничен хипоталамус; MCH, меланин-концентриращ хормон; NPY, невропептид Y; NTS, ядро на самотния тракт; POMC, проопиомеланокортин; PVN, паравентрикуларно ядро; PYY, пептид YY; TRH, хормон, освобождаващ щитовидната жлеза; VMH, вентромедиално ядро.
При хората са демонстрирани ограничени доказателства за ролята на хипоталамуса в регулирането на апетита и храненето. Активирането на хипоталамуса, както и таламуса, средния мозък и стриатума, до млечен шейк, предсказва наддаване на тегло в рамките на една година в проучване на fMRI на хора [81]. Хипоталамусът получава външни сигнали и комуникира директно с компоненти на системите за възнаграждение и емоции и памет, както и чрез таламуса до когнитивния контрол и други кортикални области (Фигура 3) и по този начин активирането на хипоталамуса може да бъде обект на контрол/влияние от тези висши системи при хората. Тоест, въпреки че хипоталамусът е от решаващо значение за хомеостатичния контрол на храненето, вероятно е да бъде повлиян от многокомпонентни системи за определяне на приема на храна.
Обща карта на свързаността на хипоталамуса с други центрове на ЦНС, важни за енергийния прием. Тези области комуникират помежду си и хипоталамуса, за да контролират приема на енергия. Важното е, че хипоталамусът също така получава ключови входове от периферията по отношение на наличната енергия (скорошен прием и съхранение). NAcc, nucleus accumbens; OFC, орбитофронтална кора; SN, substantia nigra; VTA, вентрална тегментална област.
Тъй като хората със затлъстяване консумират храна на нива над хомеостатичната поддръжка, тези други регулаторни системи могат да упражняват по-голям контрол върху стремежа към хранене, както е продиктувано от хипоталамуса. По този начин, има нужда от повече транслационни изследвания, за да се разбере как хипоталамусните механизми могат да бъдат повлияни при затлъстяване в резултат на „над-хомеостатичен” контрол. Освен това, нови образни и аналитични инструменти за улавяне на действията на хипоталамуса с по-добра разделителна способност и точност при хората ще бъдат от полза за изследванията на затлъстяването.
Системи за възнаграждение
Няколко изследователи предположиха, че променената сигнализация за възнаграждение в мозъка е основната причина за затлъстяването [14, 20, 82-100]. Храната е естествено възнаграждаваща и обикновено действа по пътищата за възнаграждение в мозъка. Тези пътища се състоят от допаминергични неврони, които произхождат от вентралната тегментална област (VTA) и substantia nigra (SN) в средния мозък и се проектират в човешкия мозък. Nucleus accumbens, стриатумът и орбитофронталната кора (OFC) са ключови области, участващи в приемането и интегрирането на тези допаминергични сигнали за действия (Фигура 4). Всъщност е установено, че тези области реагират както на гледане на хранителни сигнали, така и на консумация на храна по време на fMRI при хора [14, 84, 85, 96, 97, 100].
Системата за възнаграждение се състои главно от допаминергичните проекции от вентралната тегментална област (VTA) и substantia nigra (SN) към орбитофронталната кора (OFC) и стриатума, особено Nucleus Accumbens (NAcc).
Има две основни теории относно това как мрежите за възнаграждения могат да бъдат променени при затлъстяване (Фигура 5). В една теория хипореактивността към наградите води до това хората да търсят и консумират повече калории и храни с високо съдържание на мазнини и да затлъстяват. Проучванията с РЕТ постоянно съобщават за по-ниска наличност на допамин 2 (D2) рецептори в стриатума при затлъстели в сравнение с индивиди с нормално тегло [101-105]. По-ниската наличност на D2 рецептори при плъхове също корелира с по-голямо наддаване на тегло във времето [106] и подобни резултати са наблюдавани при хора [107]. Като цяло тези открития предполагат, че по-ниската допаминергична сигнализация може да накара определени индивиди да търсят силно възнаграждаващи (висококалорични или с високо съдържание на мазнини) храни и това от своя страна води до затлъстяване. От друга страна, има доказателства, че излагането на храни с високо съдържание на мазнини или калории може да доведе до намалено състояние на възнаграждението. Когато плъховете са били изложени на висококалорична диета, те са имали по-високо тегло, по-ниски нива на D2 рецепторите и по-високи прагове за възнаграждение, в сравнение с тези, изложени на редовна диета [108]. Хипотезираната връзка между недостатъчно реагиращата схема за възнаграждение и обичайния прием на храна подчертава голяма част от дискусията, сравнявайки храните с високо съдържание на мазнини или калории с наркотици на пристрастяване [14, 82, 90, 95, 96, 98].
Теории за това как се повлиява реакцията на възнагражденията при затлъстяване: хиперреактивност (а) и хипоотговорност (б). Първата теория предполага, че хората със затлъстяване имат повишена реакция на възнаграждение към хранителни сигнали, но след повишена консумация на храна, това води до намалена реакция към награда към действителната консумация на храна (но не и хранителни сигнали) и това прекъсване води до по-голям прием на храна с течение на времето . Втората теория гласи, че хората с естествена хипочувствителност към награди консумират повече храна, защото се нуждаят от повече консумация на храна и повече калории или храни с високо съдържание на мазнини, за да постигнат същото ниво на възнаграждение.
Системи за емоции/памет
Клинично е известно, че емоциите са мощни модулатори на апетита. Депресията и тревожността са често срещани съпътстващи заболявания на затлъстяването, а депресивното настроение е свързано с централното затлъстяване и по-лошото качество на диетата [116-120]. Що се отнася до краткосрочните емоции, радостта и гневът едновременно повишават апетита и създават по-лош хранителен избор в сравнение със страха и тъгата [121]. Освен това тези ефекти са по-изразени при жените, отколкото при мъжете [121]. Някои изследователи предполагат, че затлъстелите индивиди могат да променят хранителното си поведение, за да регулират емоциите си и/или че затлъстелите индивиди не успяват да разпознаят вътрешните сигнали за глад и следователно не могат да регулират правилно храненето си [122]. Известно е също, че стресът причинява промени в апетита, както и предразполага индивидите към затлъстяване и кардиометаболитен риск (за скорошна дискусия вижте Farr et al. [123]).
Амигдалата е основната мозъчна област, регулираща апетита в отговор на емоциите. Всъщност амигдалата се активира към хранителни сигнали [124, 125] и този отговор се увеличава при затлъстяване в детска, юношеска и възрастна възраст [126-129]. Активирането на амигдалата също предсказва консумация на храни с високо съдържание на мазнини или калории [130]. Участниците, които са имали по-голям отговор на амигдалата към хранителни сигнали, когато не са гладни, са по-склонни да наддават на тегло [131]. Тези участници също показват повишена функционална свързаност между амигдалата и хипоталамуса по време на ситост към хранителни сигнали, което предполага, че амигдалата може да медиира реакция на глад, дори когато човек не е физически гладен [131]. По-високите нива на циркулиращ лептин при юноши корелират с активирането на амигдалата към висококалорични хранителни сигнали [129]. Установено е, че ефектът за облекчаване на стреса, предизвикан от захароза, се медиира чрез верига на амигдала, която комуникира с оста хипоталамус-хипофиза-надбъбречна жлеза [132]. Заедно има много доказателства, че амигдалата участва в емоционалното хранене и бъдещата работа може да изясни как амигдалата регулира апетита и храненето чрез нейната свързаност с хипоталамуса и молекулните детерминанти на основните механизми.
Паметта влияе циклично на хранителното поведение. Намалената хипокампална активност води до намаляване на паметта за хранене и повишен отговор на хранителните сигнали. Това води до повишена консумация на калории и затлъстяване, което от своя страна води до повишено възпаление и кардиометаболитна дисфункция, което от своя страна намалява хипокампалната функция.
Системи за внимание
Вниманието към храните и хранителните сигнали многократно е замесено в затлъстяването, при което хората със затлъстяване се грижат повече за хранителните сигнали и хората с нормално тегло, които обръщат повече внимание на хранителните сигнали, показват модели на преяждане и наддаване на тегло [168-170]. Всъщност хората са склонни да обръщат повече внимание на нещата, които ценят, тъй като тези елементи имат по-голяма видимост или значение за този индивид. Въпреки че има общ модел на затлъстели индивиди, които се грижат повече за хранителните сигнали, това не е общо правило и подкатегориите със затлъстели индивиди демонстрират повече пристрастия към вниманието от други, включително тези, които показват високо външно хранене или ядене към хранителни сигнали, въпреки вътрешните сигнали за ситост [171-173]. В проучвания за проследяване на очите индивидите демонстрират пристрастие към вниманието към висококалорични или високомаслени хранителни сигнали, независимо от теглото им по време на гладуване, въпреки че участниците със затлъстяване, но не с нормално тегло поддържат това пристрастие, докато са в хранене [174]. Като цяло изглежда, че има свързана с вниманието модулация на мозъчната активност към хранителните сигнали, а по-голямото внимание към хранителните сигнали води до консумация на храна и наддаване на тегло.
Системи за когнитивно управление
Теория за това как когнитивният контрол може да взаимодейства с възнаграждението и консумацията на храна е, че в типичните случаи засиленият когнитивен контрол може да намали активирането на системата за възнаграждение към хранителни сигнали и по този начин да намали консумацията на храна (а). Това може да се промени при затлъстяване, където когнитивният контрол е нарушен и системата за възнаграждение може да бъде повишена, което води до повишена консумация на храна (б).
Заключения
Контролът на храненето в човешкия мозък е сложен, включващ няколко кортикални и подкоркови системи и множество когнитивни и афективни процеси. Експериментите с гризачи са дали критична представа за нервните вериги, регулиращи апетита и хранителното поведение. Тези проучвания върху животни обаче могат да уловят само част от сложността, свързана с дисфункционалното хранене при хората. FMRI, комбиниран с неврокогнитивни тестове и парадигми за хранителни реплики при хората, дава големи обещания при разгадаването на това как хомеостатичните, възнаграждаващи, когнитивни и афективни системи взаимодействат за контрол на апетита и храненето. Изображенията PET и SPECT са от съществено значение за разкриването на молекулярните детерминанти на тези невронни процеси. Заедно тези инструменти за изобразяване са от решаващо значение за разбирането на това как мозъкът се променя при затлъстяване, включително потенциалните подвидове затлъстяване (напр. Емоционални ядещи) и за разработването на нови фармакологични режими за ефективно лечение на затлъстяването.
Благодарности
Olivia M. Farr се поддържа от NICHD 5T32HD052961.
Финансиране: NIH 5T32HD052961
Съкращения
| ЦНС | Централна нервна система |
| fMRI | функционално ядрено-магнитен резонанс |
| MEG | магнитоенцефалограма |
| ЕЕГ | електроенцефалограма |
| ДОМАШЕН ЛЮБИМЕЦ | позитронно-емисионна томография |
| D2 | допамин-2 |
| POMC | про-опиомеланокортин |
| КОШИЦА | транскрипт, свързан с кокаин и амфетамин |
| AgRP | протеин, свързан с агути |
| NPY | невропептид Y |
| VTA | вентрална тегментална област |
| SN | substantia nigra |
| OFC | орбитофронтална кора |
| предварително SMA | предварителна допълнителна двигателна зона |
| DLPFC | дорзолатерална префронтална кора |
| DTI | дифузионно тензорно изображение |
| AgRP | свързан с агути пептид |
| ДЪГА | дъговидно ядро |
| AVP | аргинин-вазопресин |
| BDNF | извлечен от мозъка невротрофичен фактор |
| КОШИЦА | кокаин и амфетамин регулиран транскрипт |
| DMH | дорзомедиален хипоталамус |
| LH | страничен хипоталамус |
| MCH | меланин-концентриращ хормон |
| NPY | невропептид Y |
| NTS | ядрото на самотния тракт |
| POMC | проопиомеланокортин |
| PVN | паравентрикуларно ядро |
| ПИЙ | пептид YY |
| TRH | освобождаващ хормон на щитовидната жлеза |
| VMH | вентромедиално ядро |
Бележки под линия
Декларация за оповестяване: Авторите нямат какво да разкриват.
Конфликт на интереси: Авторите нямат конфликти за разкриване.
Вноски: OMF, CSRL и CSM са написали ръкописа.
- Сигнализация за хранителни вещества в централната нервна система Регулирането на енергийния баланс и бъдещето на
- Farm Babe Как яденето на месо помага да поддържате мозъка си здрав ЕЖЕДНЕВНО
- Храненето с шоколад поне веднъж седмично може да промени мозъка ви
- Яденето на плодове е от полза за мозъка - ScienceDaily
- Хранене на зърнени храни Учете се от изследователя на мозъка; 5-то поколение Аюрведа Практикуващ д-р