Резюме
TICE включва транспорт на холестерол директно от кръвта през ентероцитите в чревния лумен. Можем да покажем, че скоростта на TICE силно зависи от наличието на акцептор на холестерол. Солите на жлъчката в чревния лумен, особено когато се комбинират с фосфолипид, силно стимулират пътя. Също така беше показано, че мишките, хранени със западен тип диета, отделят значително повече холестерол през червата (21).
За да очертаем ефекта от диетичната манипулация върху чревната секреция на холестерол и да идентифицираме фактори, участващи в контрола на този алтернативен път на секреция на холестерол, ние изучихме ефектите на хранителните мазнини в отсъствието и наличието на холестерол върху чревната секреция чрез извършване на чревни перфузии при мишки, хранени с тях диети. Извършен е анализ на чревната генна експресия, за да се установи дали може да се установи корелация в експресията на гени, за които е известно, че участват в транспорта на стерол и скоростта на TICE. За да се изследват специфичните ефекти на луминалните модификации върху TICE, се извършват проксимални перфузии на тънките черва с различни комбинации от жлъчна сол и фосфолипиди, добавени като приемници на холестерол към перфузионната течност. Данните показват, че съдържанието на мазнини в диетата и модификациите на съдържанието на липидни липиди влияят върху изтичането на хорстерол в чревния тракт при мишки.
Животни и диети.
Измерване на приема и изхода на холестерол.
Мишките бяха настанени в нормални клетки за мишки (3 мишки на клетка), за да имитират максимално естественото им положение. Всеки ден се претеглят мишки и останалите пелети от чау и се събира изпражненията. Фекалните неутрални стерини се определят, както е описано по-долу.
Процедури за перфузия на червата.
Мишките се анестезират чрез интраперитонеална инжекция с 0,1 ml FFD [Hypnorm (фентанил/флуанизон; 1 ml/kg) и диазепам (10 mg/kg)]/5 g телесно тегло и се поставят върху нагряваща подложка за поддържане на телесната температура. Жлъчният канал се канюлира през жлъчния мехур и жлъчката се събира на 15-минутни порции. Потокът на жлъчката се определя гравиметрично, като се приема плътност от 1 mg/ml. Първата фракция се използва за измерване на секрецията на жлъчен холестерол. Проксималните тънки черва (първите 10 см) бяха перфузирани, тъй като тук се провежда по-голямата част от TICE. Перфузиите се извършват, както е описано по-рано (21). В края на перфузионния период кръвта се събира чрез сърдечна пункция. Перфузионните чревни сегменти бяха изолирани за анализ на генната експресия.
Състав на перфузионната течност.
Перфузиите бяха извършени с модифициран разтвор на Krebs (119,95 mM NaCl, 4,8 mM KCl, 1,2 mM KH2PO4, 1,2 mM MgSO4 · 7H2O, 15 mM HEPES, 1,3 mM CaCl2 · 2H2O и 10 mM l -глутамин; крайно рН 7,4), допълнен с жлъчни соли и фосфолипиди. Смесите от жлъчна сол и фосфолипиди бяха направени както следва: таурохолат (TC; Sigma, Zwijndrecht, Холандия), тауроурсодезоксихолат (TUDC; Calbiochem, Амстердам, Холандия) или тауродеоксихолат (TDC; Sigma, Zwijndrecht, Холандия), разтворени в метанол и яйца жълтък 1-а-фосфатидилхолин (PC; Sigma), разтворен в хлороформ, се смесва и разтворителите се изпаряват под лек поток от азот при 45 ° С. След изпаряване филмите се лиофилизират за една нощ. Лиофилизираните проби се съхраняват под азотен газ при -20 ° C до деня на чревните перфузии. Преди началото на чревната перфузия филмите се разтварят в перфузионен буфер.
Определяне на нивата на иРНК.
Общата РНК се изолира чрез използване на реактива Trizol съгласно протокола на производителя (Invitrogen, Breda, Холандия). Пречистената РНК се третира с RQ1 без РНКаза DNase (1 единица/2 μg от общата РНК, Promega, Leiden, Холандия) и се транскрибира обратно със SuperScript II Reverse Transcriptase (Invitrogen), съгласно протоколите, предоставени от производителя. Анализът на генната експресия беше извършен върху Bio-Rad MyiQ едноцветна PCR система за откриване в реално време чрез използване на Bio-Rad iQ SYBRgreen Supermix (Bio-Rad). PCR праймерите са проектирани на базата на софтуера Primer Express 1.7 с настройките по подразбиране от производителя (Applied Biosystems, Nieuwerkerk a/d IJssel, Холандия) и са валидирани за идентична ефективност. Като стандартни домакински гени са използвани хипоксантин-гуанин фосфорибозил трансфераза (HPRT), циклофилин и киселинен рибозомен фосфопротеин P0 (36B4).
Уестърн блотинг.
Лизисен буфер, съдържащ буфериран с фосфат физиологичен разтвор, 1% Triton X-114, 0,5% натриев дезоксихолат, 0,1% SDS и пълен протеазен инхибитор се добавя към чревната тъкан. Хомогенатите са получени чрез обработка с ултразвук. Концентрациите на протеини в лизатите се определят чрез анализ на BCA (18). Равни количества протеин (40 μg) се разделят на SDS-PAGE (8% гелове) и се прехвърлят върху нитроцелулозни мембрани (Schleicher and Schuell, ‘s-Hertogenbosch, Холандия). Мембраните бяха изследвани с помощта на миши анти-Sr-B1 (pAb анти-SRB1 NB400-104; Novus Biologicals, Littleton, CO), разредени 1: 1000, последвано от откриване от Lumi-Light Western блотиращ субстрат (Roche, Woerden, Холандия ). В избрани случаи мембраните се отстраняват в продължение на 30 минути чрез инкубация в буфер, съдържащ 100 mM 2-меркаптоетанол, 2% (тегл./Об.) SDS и 62,5 mM Tris · HCl, рН 6.7, при 55 ° C, последвано от промиване и сондиране със заешко анти-Na + -K + -ATPase антитяло (1: 1000) (11). Изобилието на протеини се изчислява чрез денситометрия, използвайки софтуера LumiAnalyst 3.1 (Roche).
Аналитични процедури.
Перфузатът и жлъчните липиди бяха извлечени по метода на Bligh and Dyer (4). Концентрациите на холестерол в билиарния и перфузат са измерени чрез флуоресцентен метод, както е описано по-горе (7). За да се провери дали този метод наистина измерва само холестерол в пробите на перфузат, в някои експерименти холестеролът в перфузата също се измерва чрез газова хроматография (GC), както е описано по-долу. Добро съгласие (коефициент на вариация −1 · 100 g тяло −1 и не се различават значително един от друг.
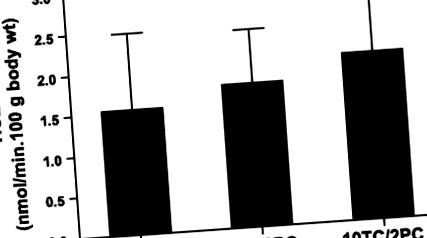
Фиг. 1.Ефект на различни смеси от таурохолат (TC) -фосфатидилхолин (PC) върху секрецията на холестерол в червата. Проксималните тънки черва на FVB мишки (н = 6, на група) са били перфузирани с Krebs, допълнени с различни комбинации TC-PC (2, 5 или 10 mM TC с 2 mM PC). Стойностите са изобразени като средни стойности ± SD. TICE, изтичане на хорстерол от чревен тракт.
Извършени са перфузии на червата с жлъчни соли, по-хидрофилни (TUDC) и по-хидрофопни (TDC), отколкото TC, за да се оцени дали хидрофобността на жлъчната сол влияе върху акцепторния капацитет за чревно секретиран холестерол. Фигура 2A показва, че TUDC в комбинация с PC предизвиква съпоставим процент TICE, както се наблюдава при TC-PC. Както TUDC/PC, така и TC-PC значително стимулират TICE в сравнение със скоростта, получена без използване на никакъв акцептор. Концентрацията на свободен холестерол в перфузата е била максимум 30 μM, което е ~ 10 пъти по-ниско от насищането при тези концентрации на жлъчна сол и PC (5). Фигура 2Б. показва, че TDC в комбинация с компютър не води до различна честота на TICE в сравнение с TC-PC като акцептор. За да се избегнат потенциални токсични ефекти на TDC, са използвани само 2 mM от тази жлъчна сол. Намаляването на PC е повлияло на TICE: както е показано на фиг. 3, 1 mM вместо 2 mM PC намалява TICE с 50%. По време на процедурата за перфузия някои от PC могат да се разграждат от чревни фосфолипази. Поради това измерихме възстановяването на компютъра и освобождаването на свободни мастни киселини. Концентрацията на свободни мастни киселини в перфузата е ~ 0,3 mM, а възстановяването на холин е 100%, което показва, че ~ 10% от PC се превръща в лизо-PC.
Фиг. 2.Ефект на хидрофобността на жлъчната сол върху секрецията на холестерол в червата. A: проксималните тънки черва на FVB мишки (н = 6, на група) бяха перфузирани с Krebs, Krebs допълнен с 10 mM тауроурсодезоксихолат (TUDC) -2 mM PC или 10 mM TC-2 mM PC. Б.: проксималните тънки черва на FVB мишки (н = 6, на група) бяха перфузирани с Krebs, допълнен с 2 mM тауродеоксихолат (TDC) -2 mM PC или 2 mM TC-2 mM PC. Стойностите са изобразени като средни стойности ± SD. * Значителна разлика в TICE между мишки, приемащи холестерол акцептор, и мишки, които не приемат холестерол акцептор.
Фиг. 3.Ефект на концентрацията на луминален фосфолипид върху секрецията на холестерол в червата. Проксималните тънки черва на FVB мишки (н = 4, на група) бяха перфузирани с Krebs, допълнен с 10 mM TUDC-1 mM PC или 10 mM TC-2 mM PC. Стойностите са изобразени като средни стойности ± SD.
Диетите с високо съдържание на мазнини влияят на TICE.
По-рано показахме, че храненето на мишки от диета от западен тип повишава TICE (21). За да установим дали това е високото съдържание на холестерол или високо съдържание на мазнини в диетата, което е предизвикало този ефект, хранехме мишки с диети, в които различните компоненти бяха селективно адаптирани. След седмица на изтичане се определя приемът и изходът на храната и след 2 седмици се извършват перфузии на червата. Както беше показано по-рано, диетата от западен тип увеличи TICE с повече от 50% (фиг. 4A). Диетата с високо съдържание на мазнини увеличи TICE още повече (100%) (фиг. 4Б.). Интересното е, че диета с висок холестерол без допълнителни мазнини не е оказала ефект върху TICE (Фиг. 4° С).
Фиг. 4.TICE се влияе от диетичните манипулации. A: проксималните тънки черва на FVB мишки, получаващи референтна диета (Ref. Diet; н = 6) или диета от западен тип (Диета W; н = 6) за 3 седмици бяха перфузирани с Krebs, допълнен с TC-PC (10: 2 mM). Б.: проксималните тънки черва на FVB мишки, получаващи референтна диета (н = 6) или диета с високо съдържание на мазнини (с високо съдържание на мазнини; н = 6) за 3 седмици бяха перфузирани с Krebs, допълнен с TC-PC (10: 2 mM). ° С: проксималните тънки черва на FVB мишки, получаващи референтна диета (н = 6) или диета с висок холестерол (висок холестерол; н = 6) за 3 седмици бяха перфузирани с Krebs, допълнен с TC-PC (10: 2 mM). Стойностите са изобразени като средни стойности ± SD. Значителна разлика в секрецията на холестерол между мишки, приемащи различни диети: *P
Данните, получени от перфузии на червата, се потвърждават от данните за баланса на холестерола. Референтна диета, хранени с мишки, погълнати 1,5 ± 0,1 μmol холестерол · ден –1 · 100 g телесно тегло -1 и 1,7 ± 0,6 μmol навлизат в чревния лумен чрез жлъчка. Тези животни екскретират 6,0 ± 0,6 μmol · ден –1 · 100 g телесно тегло -1 чрез фекалии. Мишките, хранени с диета с високо съдържание на мазнини, получават 1,3 ± 0,2 μmol холестерол на ден -1 ден · 100 g телесно тегло -1 от диетата и 1,0 ± 0,3 μmol от жлъчката в чревния лумен и екскретират 13,2 ± 0,6 μmol на ден -1 · 100 g телесно тегло -1. Не можахме да извършим точни изследвания на баланса при мишки, хранени от диета от западен тип или диета само с висок холестерол, поради високите нива на холестерол в тези диети. Потвърждавайки данните от други (14, 15), ние наблюдавахме три до четирикратно повишена секреция на жлъчен холестерол при животни, хранени от западния тип диета с висок холестерол (данните не са показани).
TICE-индуциращите диети показват диференциален модел на експресия на гени, свързани с холестерола.
За да се изследва ефектът от различните хранителни режими върху генната експресия, се събират перфузионни чревни сегменти. Количествените нива на експресия на иРНК на няколко гена, за които е известно, че участват в метаболизма на холестерола, са количествено определени (Фиг. 5). В червата на мишки, хранени от диета от западен тип, наблюдаваното повишаване на регулирането на Abca1 и Abcg5 и понижаването на експресията на HMG-CoA редуктаза и Npc1l1 са в съгласие с по-ранни открития (13, 21). При мишки, хранени с високо съдържание на мазнини, експресията на гена на Npc1l1 и Abca1 в червата е намалена.
Фиг. 5.Анализ на чревна генна експресия. Мишките получиха референтна диета (н = 6), диета от западен тип (н = 6), или диета с високо съдържание на мазнини (н = 6) за 3 седмици. След чревната перфузия, от перфузионните черва се вземат проби за изолиране на РНК и се извършва анализ на генната експресия. Измервани са червени нива на експресия на червата Abca1, Abcg5, Sr-B1, Npc1l1 и HMG-CoA. Като контролни гени бяха използвани HPRT, циклофилин и 36В4. Значителна разлика между мишки, получаващи референтна диета, и диета от западен тип или диета с високо съдържание на мазнини: *P
Интересното е, че храненето както с диети от западен тип, така и с високо съдържание на мазнини води до повишена експресия на чревния Sr-B1 (фиг. 5). Това увеличение на Sr-B1 с TICE-индуциращите диети не се наблюдава само на нивото на иРНК, но също така се увеличава количеството протеин (Фиг. 6). За директна оценка на ролята на Sr-B1 в TICE, бяха проведени чревни перфузии на Sr-B1 -/- мишки. Изненадващо, TICE беше увеличен в Sr-B1 -/- в сравнение с техните диви тийнейджъри (фиг. 7).
Фиг. 6.Нива на протеин Sr-B1. Мишките получиха референтна диета (н = 3), диета от западен тип (н = 3), или диета с високо съдържание на мазнини (н = 3) за 3 седмици. След перфузията на червата се вземат проби от перфузионните черва за определяне на нивата на чревния протеин Sr-B1. Като контрол за натоварване с протеин бяха определени и нивата на Na + -K + -ATPase.
Фиг. 7.Изтичането на хорстерол в чревния тракт се увеличава при мишки с дефицит на Sr-B1. Чревни перфузии бяха извършени на мишки, хранени с Chow Sr-B1 -/- (н = 4) и техните дичи тип (WT) отпадъци (н = 5). Проксималните тънки черва се перфузират с акцептор на холестерол, съдържащ 10 mM TC и 2 mM PC в продължение на 90 минути и концентрацията на холестерол в перфузата се измерва чрез определяне на холестерола в перфузата. Стойностите се изразяват като средни стойности ± SD. * Значителна разлика между Sr-B1 -/- мишки и диви тип котила.
Освен острия ефект на фосфолипидите, ние демонстрираме, че високото съдържание на липиди в храната също стимулира TICE при мишките. Диетата от западен тип и само с мазнини увеличи TICE около два пъти. Това увеличение корелира с двукратното увеличаване на продукцията на неутрален стерол, установено при диети, хранени с високо съдържание на мазнини.
Диференциран ефект и на двете TICE-индуциращи диети върху параметрите на метаболизма на холестерола се наблюдава на нивото на генната експресия. Диета от западен тип, хранеща се с регулирани чревни Abca1 и Abcg5 и понижена HMG-CoA редуктаза, както се очаква от диета с висок холестерол (13). За разлика от тях, Abcg5 и HMG-CoA редуктазата остават незасегнати, докато Abca1 е силно понижен при хранене с диета с високо съдържание на мазнини. Въпреки че в последно време се съобщава за отрицателна корелация между ненаситените мастни киселини и експресията на ABCA1 (20), подобно силно понижаване на регулацията in vivo от повишеното усвояване на мастни киселини не е показано преди. Чрез спиране на изтичането чрез Abca1, ентероцитът може да спести холестерол за сглобяване на хиломикрон, за да може да изнася мастна киселина под формата на триглицериди. Намаляването на регулацията на Abca1 изглежда съществено, тъй като вносът на холестерол също е ограничен поради намаляването на вносителя на холестерол Npc1l1 и увеличаването на TICE. Очевидно поради все още неизвестни причини е важно ентероцитите в тънките черва да поддържат адекватно количество холестерол в чревния лумен. Излишният холестерол може да се реабсорбира по-надолу в червата (16).
В заключение, TICE може да бъде променен от съдържанието на мазнини в диетата и чрез модифициране на холестеролния акцептор в чревния лумен. Стимулиращият ефект на диетите с високо съдържание на мазнини може да служи като експериментално средство за идентифициране на ключовите играчи в TICE. Освен това наличието на луминален компютър играе решаваща роля за улесняването на TICE. Луминалната манипулация може да осигури интересна цел за стимулиране на TICE и по този начин да увеличи общото отделяне на холестерол.
Това проучване беше подкрепено с грант 912-02-063 от Холандската организация за научни изследвания (NWO) и грант 04-55 от холандската фондация за храносмилане (Maag Lever Darm Stichting).
СТЪПКИ
Разходите за публикуване на тази статия бяха покрити отчасти чрез плащането на такси за страница. Следователно статията трябва да бъде маркирана с „реклама”В съответствие с 18 U.S.C. Раздел 1734 единствено, за да посочи този факт.
ПРЕПРАТКИ
ЗАБЕЛЕЖКИ НА АВТОРА
* A. E. van der Velde и C. L. J. Vrins допринасят еднакво за тази работа.
- Метаболитен ефект на диета LoBAG30 при мъже с диабет тип 2
- Руските маршрути Камчатка до остров Кадиак - Често срещано - вестник за ранния американски живот
- Астма, променяща затлъстяването в Американския вестник за респираторни и критични грижи на 21-ви век
- Расови разлики в отделянето на калий в урината Американско общество по нефрология
- Полови разлики в LPL активността на корема, глутеума и бедрата American Journal of