Силвия Куфи
1 Група за метаболизъм и рак, Транслационна изследователска лаборатория, Каталунски институт по онкология, Жирона, Каталуния (Испания)
2 Институт за биомедицински изследвания в Жирона (IDIBGi), Жирона, Каталуния (Испания)
Бруна Короминас-Фажа
1 Група за метаболизъм и рак, Транслационна изследователска лаборатория, Каталунски институт по онкология, Жирона, Каталуния (Испания)
2 Институт за биомедицински изследвания в Жирона (IDIBGi), Жирона, Каталуния (Испания)
Eugeni Lopez-Bonet
3 Отделение по анатомична патология, болница „Д-р Хосеп Trueta“ в Жирона, Жирона, Каталуния (Испания)
14 От името на разследващите METTEN-01 (EudraClinicalTrial Number 2011-000490-30)
Роза Бонавия
4 Уред за грижа за животните, Изследователски институт Bellvitge (IDIBELL), L'Hospitalet de Llobregat, Барселона, Каталуния (Испания)
Соня Пернас
5 Катедра по медицинска онкология, отделение за гърди, Каталунски институт по онкология - болница Universitari de Bellvitge-Bellvitge Research Institute (IDIBELL), L'Hospitalet de Llobregat, Барселона, Каталуния (Испания)
14 От името на разследващите METTEN-01 (EudraClinicalTrial Number 2011-000490-30)
Изабел Алварес Лопес
6 Медицинска онкологична служба, болница Доностия, Доностия-Сан Себастиан, Страна на баските (Испания)
14 От името на разследващите METTEN-01 (EudraClinicalTrial Number 2011-000490-30)
Джоан Дорка
2 Институт за биомедицински изследвания в Жирона (IDIBGi), Жирона, Каталуния (Испания)
7 Катедра по медицинска онкология, Каталунски институт по онкология, Жирона, Каталуния (Испания)
14 От името на разследващите METTEN-01 (EudraClinicalTrial Number 2011-000490-30)
Сузана Мартинес
8 Отделение по медицинска онкология, Hospital de Mataró, Mataró, Барселона, Каталуния (Испания)
14 От името на разследващите METTEN-01 (EudraClinicalTrial Number 2011-000490-30)
Норберто Батиста Лопес
9 Медицинска онкологична служба, болница Universitario de Canarias, La Laguna, Тенерифе, Канарски острови (Испания)
14 От името на разследващите METTEN-01 (EudraClinicalTrial Number 2011-000490-30)
Северина Домингес Фернандес
10 Медицинска онкологична служба, Hospital de Txagorritxu, Vitoria-Gasteiz, Araba, Basque Conutry (Испания)
14 От името на разследващите METTEN-01 (EudraClinicalTrial Number 2011-000490-30)
Елизабет Куяс
1 Група за метаболизъм и рак, Транслационна изследователска лаборатория, Каталунски институт по онкология, Жирона, Каталуния (Испания)
2 Институт за биомедицински изследвания в Жирона (IDIBGi), Жирона, Каталуния (Испания)
Йоана Виза
4 Уред за грижа за животните, Изследователски институт Bellvitge (IDIBELL), L'Hospitalet de Llobregat, Барселона, Каталуния (Испания)
Естер Родригес-Галего
11 Unitat de Recerca Biomèdica (URB-CRB), Institut d'Investigació Sanitaria Pere i Virgili (IISPV), Universitat Rovira i Virgili, Reus, Catalonia (Испания)
Роза Кирантес-Пине
12 Катедра по аналитична химия, Факултет на науките, Университет в Гранада, Гранада (Испания)
Антонио Сегура-Каретеро
12 Катедра по аналитична химия, Факултет на науките, Университет в Гранада, Гранада (Испания)
Хорхе Йовен
11 Unitat de Recerca Biomèdica (URB-CRB), Institut d'Investigació Sanitaria Pere i Virgili (IISPV), Universitat Rovira i Virgili, Reus, Catalonia (Испания)
Бегоня Мартин-Кастило
2 Институт за биомедицински изследвания в Жирона (IDIBGi), Жирона, Каталуния (Испания)
13 Отдел за клинични изследвания, Каталунски институт по онкология, Жирона, Каталуния (Испания)
14 От името на разследващите METTEN-01 (EudraClinicalTrial Number 2011-000490-30)
Хавиер А. Менендес
1 Група за метаболизъм и рак, Транслационна изследователска лаборатория, Каталунски институт по онкология, Жирона, Каталуния (Испания)
2 Институт за биомедицински изследвания в Жирона (IDIBGi), Жирона, Каталуния (Испания)
14 От името на разследващите METTEN-01 (EudraClinicalTrial Number 2011-000490-30)
Резюме
ВЪВЕДЕНИЕ
Наскоро предложихме CR/DR-нереагиращи тумори с активиращи мутации в PIK3CA онкогена да бъдат наблюдавани за тяхната реакция към клинично значими концентрации на метформин. Сега представяме доказателства, че ксенотуморите на човешкия рак, съдържащи не реагираща на инсулин PIK3CA-активираща мутация H1047R, остават чувствителни към метформин. Нашите данни потвърждават, че метформинът не може да се счита за добросъвестен CRM, поне по отношение на неговата противоракова активност. Предвид големия брой мутации на PIK3CA при рак на човека, това откритие би могло да окаже значително влияние върху дизайна на терапии, базирани на метформин, които имат за цел да повлияят както ранните етапи на образуване и прогресия на тумора, така и рецидив на рак при напреднали тумори.
РЕЗУЛТАТИ
PIK3CA H1047R-мутирали, устойчиви на DR MCF10DCIS.com ксенотумори са силно чувствителни към интраперитонеално (i.p.) администриран метформин. За да моделираме онкогенните PIK3CA задвижвани ранни стадии на човешкия рак, използвахме клоналната линия на рак на гърдата MCF10DCIS.com, която беше получена от ксенотрансплантат, произхождащ от премалигнени MCF10AT клетки, които бяха инжектирани в SCID мишки. Доказано е, че клетъчната линия MCF10DCIS.com има мисенс мутация, H1047R, в киназния домейн на PI3K. Тази мутация на усилване на функцията е една от мутациите на „горещите точки“ в каталитичния домейн p110α на гена PI3KCA и генерира най-мощния онкогенен PI3K, който се среща с висока честота при различни видове рак. По-важното за това проучване е, че MCF10DCIS.com клетките се размножават независимо от наличието или отсъствието на инсулин in vitro и образуват тумори, които са рефрактерни на DR in vivo [8].
Тествани са два различни протокола за лечение с метформин (n = 5 мишки на група). В първия протокол мишките са били изложени на контрол (вода) или метформин (250 mg kg -1) ad libitum 1 седмица преди инокулация на туморни клетки. Водата се сменя два пъти седмично и се осигурява непрекъснато в продължение на общо 56 дни. Във втория протокол метформин се прилага от i.p. инжектиране и мишките се третират ежедневно с 200 mg kg -1 метформин, започвайки 1 седмица преди клетъчно инокулиране. Това i.p. графикът с метформин е продължен общо 56 дни. Метформин се понася добре и при двата режима на лечение и не оказва значително влияние върху теглото (допълнителна фигура 1) или профилите на консумация на диета (данните не са показани) на мишките през целия курс на лечение.
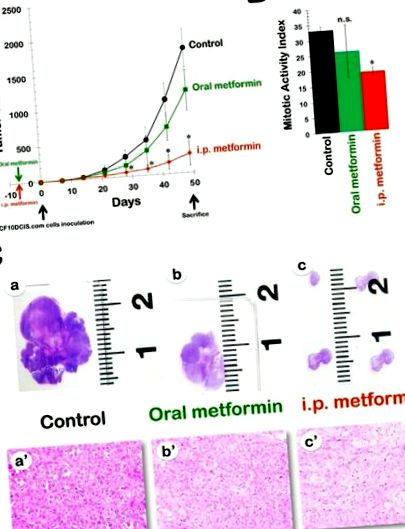
Ефикасност на перорален метформин в резистентния на DR модел MCF10DCIS.com ксенографт. Фиг. Фиг. 1А 1А показва скоростта на туморен растеж в трите лечебни групи, като данните са нанесени като среден обем на тумора във всяка група във времето. В сравнение с животните в третираната с носител група (среден ксенографтен MCF10DCIS.com обем на тумора от 1794 ± 273 mm 3), животните, които са получили 8 седмици лечение с перорален метформин, показват леко забавен растеж на тумора, с краен среден обем на тумора 1186 ± 293 mm 3 (фиг. (Фиг. 1А). 1А). Въпреки това, нито една от разликите между нетретираните контроли и перорално лекуваните метформин ксенотумори с течение на времето не достига статистическа значимост. Тази констатация е по-добре отразена от процента инхибиране на растежа на тумора MCF10DCIS.com, който се изчислява, както следва: съотношение 1-третиран/контролен обем (1-T/C). Инхибиторният ефект на пероралния метформин е умерен, достигайки максимум 43% на 4 седмици след инокулация на клетките и намаляващ към края на лечението (приблизително 30-35%).
метформин в модела за устойчив на DR MCF10DCIS.com ксенографт. А. Показани са средните обеми на тумора (± SD) на голи мишки, носещи ксенотрансплантат MCF10DCIS.com, след орално (ad libitum достъп до вода, съдържаща 250 mg kg -1 метформин) и i.p. (ежедневно i.p. инжекции от 200 mg kg -1 метформин) приложение на метформин в продължение на 8 седмици. Темповете на растеж на тумора се различават значително между контролата и i.p. групи метформин (* t-тест на Student за P 3) при нелекувани контролни животни, всеки ден i.p. лечението с метформин доведе до драстично намаляване на средния обем на тумора до 280 ± 171 mm 3 (фиг. (фиг. 1А). 1А). По-специално, антитуморната активност на i.p. метформин само 7 дни след инокулация на клетките (49%) вече е по-голям от максималната активност, постигната по всяко време с перорален метформин. Нещо повече, инхибиторният ефект на i.p метформин се увеличава в зависимост от времето, достигайки максимум 84% на 42 дни след инокулация.
Интраперитонеално прилаганият метформин значително намалява митотичната активност в раковите тъкани на MCF10DCIS.com. Анализирахме MCF10DCIS.com туморни ксенотрансплантати, за да изследваме потенциалните проапоптотични и/или анти-пролиферативни ефекти на метформин; тези ефекти може да са изиграли роля за цялостната антитуморна ефикасност на лекарството. Не се наблюдават значителни разлики в броя на апоптотичните клетки между контролните тумори и туморите от двата терапевтични режима (т.е. мишки, лекувани с перорален метформин и мишки, третирани с i.p. метформин). След това сравнихме броя на митозите в хемоматоксилин и еозин (H&E) оцветени парафинови секции съгласно хистопрогностичната система за класифициране на Scarff-Bloom-Richardson, модифицирана от Elston и Ellis (Фиг. (Фиг. 1B). 1B). За първия протокол микроскопският анализ на H&E оцветяването на тумори MCF10DCIS.com показва умерено намаляване (21%) на средния брой митоти в групата на пероралния метформин (26 ± 8) в сравнение с нелекуваната контрола (33 ± 1), но тази разлика не достига статистическа значимост (p = 0,5). За втория протокол обаче количественото определяне на средния брой митотични клетки разкрива статистически значимо (p = 0,01) 42% намаление на индекса на митотична активност в i.p. метформинова група (19 ± 1) в сравнение с контролната група.
Микроскопският външен вид на карциномите MCF10DCIS.com леко се промени след лечение с метформин. Хистологичното изследване потвърждава, че нелекуваните MCF10DCIS.com тумори се състоят от клетки, които изглеждат цитологично злокачествени, с висококачествени ядра, плеоморфизъм и обилна централна некроза (т.е. инвазивни дуктални карциноми от степен 3; Фиг. 1C, 1C, панели a и а '). Анатомопатологичното изследване на ксенотуморите на гърдата MCF10DCIS.com при животни, лекувани с перорален метформин, разкрива, че раковите тъкани остават слабо диференцирани, въпреки визуалните доказателства за намаляване на размера на тумора (фиг. (Фиг. 1С, 1С, панели b и b ')). Интересното е, че при много малките MCF10DCIS.com тумори, които се развиват в присъствието на ежедневен ip метформин, се наблюдава значителна тенденция към намаляване на клетъчността, придружена от увеличаване на количеството на извънклетъчната матрица на съединителната тъкан (фиг. 1C), 1C, панели c и c ').
Инсулино-независимият растеж на PIK3CA H1047R-мутирали туморни клетки се инхибира от метформин in vitro. Тъй като конститутивното активиране на пътя PI3K кара клетки MCF10DCIS.com да образуват устойчиви на DR тумори in vivo и да растат по инсулино независим начин in vitro, ние определихме дали екзогенната добавка с метформин значително влияе на неотзивчивостта на туморните клетки към инсулин in vitro. Устойчивите на DR клетки MCF10DCIS.com нарастват по подобен начин в културата по независим от инсулина начин, т.е. инсулинът не успява да предизвика дозозависимо увеличение на броя на клетките. Метформин не действа като инсулинов сенсибилизатор за инсулиноустойчиви PIK3CA H1047R-мутирали клетки MCF10DCIS.com; по-скоро той действа като инхибитор на растежа по дозозависим начин (фиг. (фиг. 2 2).
А. Топ. Криви на пролиферация на клетки MCF10DCIS.com, култивирани в присъствието на нарастващи концентрации на инсулин и/или метформин. Клетките MCF10DCIS.com се посяват в 24-ямкови плаки с плътност 5000 клетки/ямка и се култивират в 0,1% конски серум в отсъствие или в присъствие на инсулин (0, 100 и 1000 ng/ml), метформин (1 μmol/L, 10 μmol/L, 100 μmol/L, 1 mmol/L и 10 mmol/L) или комбинация от инсулин и метформин, както е посочено. Представените данни са средните за брой клетки × 10 4/ямка (± SD) от един представителен експеримент, направен в три екземпляра и получен след 0, 2, 4 и 6 дни. Отдолу. Криви на поглъщане на MTT на клетки MCF10DCIS.com, култивирани в присъствието на нарастващи концентрации на инсулин и/или метформин. Клетките MCF10DCIS.com се посяват в 96-ямкови плаки с плътност ~ 2000 клетки/ямка и се култивират в 0,1% конски серум в отсъствие или в присъствие на инсулин (0, 100 и 1000 ng/ml), метформин (1 μmol/L, 10 μmol/L, 100 μmol/L, 1 mmol/L и 10 mmol/L) или комбинация от инсулин и метформин, както е посочено. Представените данни са средните стойности ± SD на увеличаване на пъти в OD570.
МЕТОДИ
Клетъчни линии
MCF10DCIS.COM клетките са закупени от Asterand, Inc. (Детройт, Мичиган, САЩ). Изогенните клетъчни линии X-MAN ™ са получени от Horizon Discovery Ltd (http://www.horizondiscovery.com). В това проучване е използвана X-MAN ™ изогенната клетъчна линия SW48 PI3Kα (H1047R/+), хетерозиготно включване на мутация на активиращ домейн PIK3CA киназа, (HD103-005). Използвана е и родителската клетъчна линия SW48 PI3K (+/+). Клетките се поддържат в съответствие с препоръките на доставчика.
Туморно ксенографтно изследване
Хистология
В подходящите моменти от време животните бяха евтаназирани и туморите бяха отстранени и разрязани наполовина. Едната половина се фиксира в 10% буфериран формалин, а другата се замразява бързо. За да се оцени апоптозата и митозата в туморните тъкани, срезовете от фиксирани с формалин, вложени в парафин ксенографтни тъкани бяха оцветени с H&E.
Митотичните фигури, наблюдавани след протокола за оцветяване H&E, са определени съгласно van Diest et al. [52], с някои модификации, както следва: а) липсата на ядрена мембрана, означаваща края на профазата, и б) наличието на кондензирани хромозоми, които са били групирани заедно (начална метафаза), подредени в равнина (метафаза или анафаза), или в отделни клъстери (телофаза), всички отчетени като една митотична фигура. Хиперхроматичните ядра, фрагментираният хроматин и апоптотичните ядра бяха игнорирани. Всички H & E оцветени срезове бяха изследвани внимателно (увеличение, × 400) и участъкът, показващ най-голяма пролиферация, беше избран за оценка на митотичната активност. Започвайки от субективно най-митотично активната област на тумора и движейки се между последователни полета, приблизително 10 последователни полета с висока мощност (HPF) бяха преброени с микроскоп Olympus BH-2. Не са правени опити да се увеличи максимално броенето чрез избиране на тези полета с по-голям брой митотични фигури. Броят на митотите се извършва без знанието на имунохистохимичното оцветяване на базата на групата на лечение. Дейностите на MAI бяха сравнени с помощта на двустранен, двупробен, студентски t-тест с еднаква дисперсия.
Анализ на разпространението
На ден 0, клетъчните линии бяха засяти в подходяща среда в 24-ямкови плаки с плътност 5000 клетки/ямка и всички плаки бяха инкубирани една нощ. На 1-ви ден аналитичните плаки за всяка клетъчна линия се измиват два пъти с обикновена среда в отсъствие на серум и средата се заменя със среда, допълнена само с 0,1% серум, 0,1% серум и една от двете различни концентрации на инсулин (100 и 1000 ng/ml), 0,1% серум и една от седемте различни концентрации на метформин (10 nmol/L, 100 nmol/L, 1 μmol/L, 10 μmol/L, 100 μmol/L, 1 mmol/L и 10 mmol/L) или комбинация от инсулин и метформин, както е посочено. Във всяка плака бяха включени три гнезда на състояние на среда. Допълнителна плака за всяка клетъчна линия беше използвана като измерване на базовия ден 0 на клетъчния брой без добавяне на тестовата среда. Клетъчните номера бяха преброени на дни 0, 2, 4 и 6, като се използва брояч на Coulter (Coulter Electronics, Inc.).
Анализи на жизнеспособността на клетките
Ефектът на метформин върху клетъчната жизнеспособност при отсъствие или присъствие на инсулин се определя, като се използва стандартен колориметричен анализ за редукция на 3,4,5-диметилтиазол-2-ил-2,5-дифенил-тетразолиев бромид (MTT). За всяко третиране процентната жизнеспособност на клетките се изчислява, като се използва следното уравнение: (OD570 на третираната проба/OD570 на необработената проба) × 100.
Благодарности
Тази работа беше подкрепена финансово от Института на Салуд Карлос III (Ministerio de Sanidad y Consumo, Fondo de Investigación Sanitaria (FIS), Испания, безвъзмездни средства EC10-125, CP05-00090, PI06-0778 и RD06-0020-0028), Fundación Científica de la Asociación Española Contra el Cáncer (AECC, Испания) и Ministerio de Ciencia e Innovación (SAF2009-11579 и SAF2012-38914, Plan Nacional de I + D + i, MICINN, Испания). Силвия Куфи получи научна стипендия (BES-2010-032066, Formación de Personal Investigador, FPI) от Ministerio de Ciencia e Innovación (MICINN, Испания).
Сътрудници (изследователи на METTEN-01):
Мария Луке Кабал (Медицинска онкологична служба, Централна болница на Астурия, Овиедо, Испания), Сесар А. Родригес-Санчес (Медицинска онкологична служба, Болница Университет де Саламанка, Саламанка, Испания), Хосе Луис Алонсо Ромеро (Катедра по медицинска онкология, болница Университарио Вирген де ла Ариксака, Мурсия, Испания), Рикардо Кубедо Сервера (Катедра по медицинска онкология, болница Пуерта де Йеро, Мадрид, Испания), Хосе Мануел Лопес-Вега (Медицинска онкологична катедра, болница Университет Маркес де Валдесила, Сантандер, Испания), Noelia Martínez Jáñez (отделение по медицинска онкология, болница Universitario Ramón y Cajal, Мадрид, Испания), Kepa Amillano Parraga (служба по медицинска онкология, болница Universitario San Joan de Reus, Reus, Испания).
- Диетична захар, сол и мазнини в науката за човешкото здраве ScienceDirect
- Изследвайте ефектите на диетичното рибено масло в човешката кожа - изглед в пълен текст
- Диетични модели и персонализирано хранене - Изследователски център за човешко хранене на Jean Mayer USDA на
- Център за хранителни добавки и възпаление - Медицински факултет, Университет на Южна Каролина
- Фактори, свързани с придържането към диетата при цьолиакия. Национално проучване - FullText -