Резюме
Рядък признак на някои злокачествени тумори е внезапно изригване на множество себорейни кератози, наречено Leser-Trélat знак. Свръхпроизводството на инсулиноподобен растежен фактор-2 (IGF2) или неговия предшественик е основният механизъм, свързан с хипогликемията на туморни не-островни клетки. Синдромът на Doege-Potter е името, дадено на паранеопластична хипоинсулинемична хипогликемия в присъствието на единичен фиброзен тумор. Този доклад описва случай на пациент с хипоинсулинемична хипогликемия и знак Leser-Trélat, свързан със злокачествен самотен фиброзен тумор със секреция на IGF2. И двете състояния са се подобрили след изрязване на тумора.
Заден план
Кожната морфология може да бъде модифицирана от ендокринни и метаболитни заболявания, а кожните лезии могат да служат като прозорец за ранна диагностика и лечение на различни тумори, секретиращи хормони [1]. Пример за това е внезапно изригване на множествена себорейна кератоза, наречена като знак на Лесер-Трелат и тя е по-свързана с аденокарциноми, въпреки че може да е свързана с други тумори, показващи по-лоша прогноза [2].
Различните тумори могат да причинят хипогликемия. Сред туморната етиология инсулиномът е най-честата причина [3]. Независимо от това, други тумори, несвързани с β клетката, могат да причинят хипоинсулинемична хипогликемия, като произвеждат инсулинов растежен фактор-2 (IGF2) или неговия предшественик, наречен big-IGF2 [3–7]. Синдромът на Doege-Potter е паранеопластична хипогликемия, причинена от самотен фиброзен тумор [8, 9]. Тази рядка неоплазма може да отдели предшественик на IGF2, който е pro-IGF2 или голям-IGF2 [9, 10].
Този доклад описва 81-годишен недиабетно мъж, който се е представил със знак Лесер-Трелат и хипогликемия, вторична за ретроперитонеална злокачествена самотна фиброзна туморна.
Клиничен случай
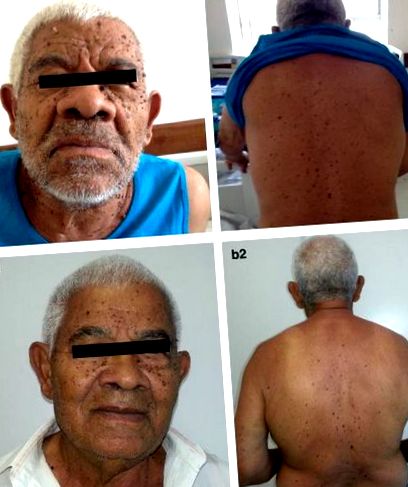
81-годишен мъж с първичен хипотиреоидизъм се оплака от симптоми, предполагащи хипогликемия в продължение на 6 месеца, с прогресивно влошаване и коремна болка. Той съобщава за бързо прогресираща поява на кафеникави брадавикови лезии по цялото тяло, една от които вече е биопсирана (себорейни кератози).
Той показа, както важно, при физикалния си преглед, акромегалоидно лице, кафяви брадавикови лезии по лицето, багажника и горните крайници (фиг. 1а) и осезаема маса в десния фланг. Хематологичната, бъбречната и чернодробната функция, електролитната оценка на кръвта и серумите му бяха в нормални граници. Работата по етиологията на хипогликемията е показана в таблица 1.
Знак на Leser-Trélat. Множество лезии по лицето (а) и гърба на пациента (б) съвместим със себорейни кератози
Неговата коремна магнитна ядрено-резонансна томография показва ретроперитонеална експанзивна маса с диаметър 18,6 cm, изключително затворена за големи коремни съдове (фиг. 2). Отдалечените метастатични лезии бяха изключени чрез скрининг с томография.
Самотен фиброзен тумор от този пациент. а ЯМР външен вид на масата в короналния самолет показва 18,6 cm в максимален диаметър. б MRI T2-претеглено изображение в сагиталната самолет демонстрира ретроперитонеалното местоположение на тумора. ° С ЯМР с контрастно усилване напречно самолет показва лобулиран тумор с твърди и кистозни компоненти. д Снимка на дисектирания образец с тегло 1,5 кг представя две възлови маси с размери 14,3 и 13 см с неправилна форма и свързани с фиброадипозна тъкан. Имаше обширни области на некроза
За тестване на туморната продукция на IGF2 бяха събрани: растежен хормон (GH), IGF1 и IGF2 (радиоимуноанализ), потвърждаващи хипотезата (Таблица 1).
По време на двумесечния период на изчакване преди операцията беше предписана фракционирана диета, перорален преднизон (30 mg/ден) плюс интравенозна инфузия на глюкозен разтвор през нощта със спорадични епизоди на лека хипогликемия. По времето на операцията се резецира капсулиран тумор (фиг. 2). Хистопатологичният и имунохистохимичен анализ потвърждава злокачествен самотен фиброзен тумор.
Пациентът показа добро възстановяване на здравето и беше изпратен вкъщи и в амбулаторно проследяване без хипогликемични кризи и на перорално лечение с преднизон, което беше спряно 6 месеца по-късно.
При амбулаторно клинично назначение той не споменава хипогликемични епизоди и неговите акромегалоидни черти и кожни лезии показват инволюция (фиг. 1б). Той започва с локална лъчетерапия, но новият томографски скрининг показва белодробни възли, предполагащи метастатично заболяване, въпреки че не показва допълнителна хипогликемия. Пациентът се е решил за палиативни грижи и е починал след 18 месеца от диагнозата.
Дискусия
Неостровни клетъчни туморни хипогликемии трябва да се подозират при всеки пациент с триада на Уипъл и хипоинсулинемична хипогликемия [4], тъй като са изключени няколко заболявания, недостиг на хормони и прием на алкохол [1, 11]. Този пациент е имал осезаем тумор и прогресивни кожни лезии, благоприятстващи туморна етиология [3, 4, 7, 12].
Наличието на себорейна кератоза допринася за подозрението за неопластичен синдром при този пациент. Тази рядка ситуация [13], дължаща се на тумор, е известна като знак Leser-Trélat. Първото описание идва от 1956 г. на Hollander [2, 14]. Себорейната кератоза обикновено се появява като черни или кафяви брадавикови папули, рязко очертани, с 3 mm главно върху гърдите и гърба. Това е признак на сенилност, но еруптивната и внезапна форма може да е резултат от възпалителни кожни заболявания, нежелана лекарствена реакция или паранеопластичен синдром [14, 15]. Лезиите се появяват главно на гърдите и гърба, по-големи от обичайните и съществуващите лезии могат да се увеличат [12].
По-често (68%) състоянието на кожата предшества диагностицирането на тумора, [12, 13, 16] и е резултат от освобождаването на туморни растежни фактори [12]. Най-често срещаните тумори са аденокарциномите, но са описани и други тумори [2, 16]. Най-доброто лечение е резекцията на тумора, но реакцията на кожата е променлива [13]. Въпреки че точно патогенезата е несигурна, тя включва цитокините, произведени от неопластичните клетки като IGF1 и епидермален растежен фактор, които действат в повърхността на епидермалните клетки [16].
При половината от пациентите с не-островни клетъчни туморни хипогликемии хипогликемията идва след откриването на тумора [5] и хипогликемията на гладно и неврогликопеничните симптоми са по-чести. Този тумор се диагностицира най-често през петото или шестото десетилетие от живота и симптомите могат да присъстват седмици или месеци преди него [1, 3, 4, 6, 7, 12]. Загуба на тегло, осезаема маса и болка са основните клинични прояви. При редки пациенти има акромегалоидни характеристики [3, 7]. За първи път е описан през 1929 г., но едва през 1988 г. е свързан с производството на IGF2 [3, 7, 17, 18].
Обикновено 80% от циркулиращия зрял IGF2 остава неактивен, свързан с инсулин като протеин 3, свързващ растежен фактор (IGFBP3) и с киселинно лабилна субединица [7, 19–21]. При пациенти с не-островни клетъчни тумори пулът на големия IGF2 се увеличава и 80% от тази молекула е свързана само с IGFBP3, образувайки по-ниско молекулно тегло, което преминава ендотелната бариера и действа върху инсулиновите рецептори [4, 7, 20, 22 ].
Повишеното усвояване на глюкоза, по-ниската секреция на инсулин и глюкагон, намалената липолиза и чернодробната глюконеогенеза са някои ефекти от масивната секреция на IGF2, които водят до хипогликемия [3, 5]. Автокринното и паракринното действие също насърчава растежа на тумора. Големият IGF2 потиска секрецията на GH и причинява намаляване на синтеза на IGF1, IGFBP2 [1, 3, 18, 20], увеличавайки бионаличността на IGF2 [1, 3, 4, 6, 20, 22].
Лабораторните тестове могат да покажат нормално ниво на IGF2, но повишено съотношение на IGF2/IGF1. Съотношение до три се счита за нормално; ако е по-високо от десет, при наличие на некетотична хипогликемия и потиснат GH, се съобщава, че е на практика патогномонично за хипогликемия на туморни не-островни клетки [7, 9, 11]. Измерването на свободен IGF2 или неговите прекурсори не са широко достъпни, но е известно, че свободният IGF2 и съотношението pro-IGF2/IGF1 се увеличават [1, 3, 4, 9]. Наличието на по-ниски нива на GH и IGF1 и положителен отговор на тест за стимулиране на глюкагон може да подкрепи диагнозата, когато анализите на IGF2 са недостъпни [4].
Туморите обикновено са големи и добре диференцирани, с епителен или мезенхимен произход, бавно растящи, възникващи в гръдния кош, таза или ретроперитонеума [1, 3, 6]. Най-често срещаният епителен тумор е хепатоцелуларен карцином, а мезенхимният е фибросарком и единичен фиброзен тумор [3, 5, 7, 10, 23]. Последното е рядко новообразувание, с широко разпространение, включващо плеврата, белите дробове, тазовите и коремните органи или ретроперитонеума [9, 10, 23]. Засяга еднакво мъжете и жените, 50% от тях са били безсимптомни и повечето са били открити като инциденталоми при диагностициране. Най-симптоматичните тумори имат екстраторакално местоположение и масови ефекти (задържане на урина, венозна тромбоза и коремна болка) [23].
Самотният фиброзен тумор обикновено следва доброкачествен клиничен курс, въпреки че в някои случаи на големи тумори може да възникне прогрес с отдалечени метастази или локален рецидив. Извънгрудното разположение, паранеопластична хипогликемия, положителни граници, висока клетъчност и митотична активност, некроза и ядрен плеоморфизъм са предиктори за по-лош клиничен резултат [10, 23].
Хипогликемия, дължаща се на самотен фиброзен тумор, е съобщена за пръв път от Doege and Potter през 1929 г. Оттогава тази находка се нарича синдром на Doege-Potter, но е много рядка (по-малко от 5% от всички единични фиброзни тумори) [8–10]. Сред 79 случая на единични фиброзни тумори, съобщени от Jason et al. само двама представиха хипогликемия [23].
Независимо от хистологията, хирургичната резекция е избраната терапия. Пълната хирургична резекция разрешава хипогликемията [3, 7, 9, 24] и обръща тези случаи на акромегалоиден фенотип [4]. Когато пълната резекция е невъзможна, техниката за дебюлиране може да се използва за подобряване на хипогликемията или за пълно разрешаване в някои случаи [7]. Адювантната терапия като туморна емболизация, лъчетерапия или химиотерапия може да донесе успех в други случаи [3, 7].
Краткосрочните мерки за избягване на хипогликемия включват прием на кортикоиди, глюкагон, диазоксид и глюкоза. Когато хипогликемията продължава след хирургическа интервенция, са използвани множество медицински методи. Въпреки че много от тези тумори имат соматостатинови рецептори, използването на аналози не е ефективно за контролиране на хипогликемията и сцинтиграфията на аналог на соматостатин не може да предскаже отговора на лечението [3].
Има много съобщения за успешно лечение с рекомбинантен растежен хормон, въпреки че той не нормализира нивата на IGF2. Независимо от това, тази терапия е скъпа, изисква високи дози и има много неблагоприятни ефекти [4, 12]. Използването му трябва да се избягва, когато има акромегалоидни характеристики [4].
Най-добрият вариант за клинично лечение е използването на глюкокортикоиди с незабавен ефект върху хипогликемията в дози, еквивалентни на 30–60 mg/ден преднизон [3, 4]. Умерените до високи дози също могат да насърчат намаляване на тумора [7]. Това е единственото медицинско лечение, което може да потисне туморното производство на IGF2, което води до нормални нива на С-пептид, инсулин и глюкоза [7, 14].
Според прегледа на английската литература, признакът на Leser-Trélat и хипоинсулинемичната хипогликемия от единичен фиброзен тумор са изключително редки. Триадата на Whipple и хипоинсулинемичната хипогликемия с ниски нива на GH и IGF1 предполагат диагнозата и потвърждаването на увеличението на IGF2/IGF1. Няколко седмици след операцията пациентът показа ремисия на хипогликемия без използване на глюкокортикоиди и подобряване на себорейната кератоза и акромегалоидните характеристики.
Препратки
Ngonga GF, Ferrari D, Lorusso L, Gasparetto C, Neznama E, D’Abramo M, Ricevuti G. Паранеопластични синдроми: патогенетични теории, клинични аспекти и терапевтичен подход. Ann Ital Med Int. 2005; 20 (1): 28–38.
Bártholo RM, Bártholo TP, Florião RA. Leser-Trélat - Um sinal clínico revisitado. Pulmão RJ. 2009; 18 (1): 53–6.
Dynkevich Y, Rother KI, Whitford I, et al. Тумори, IGF-2 и хипогликемия: прозрения от клиниката, лабораторията и историческия архив. Endocr Rev. 2013; 34 (6): 798–826.
Bodnar TW, Acevedo MJ, Pietropaolo M. управление на не-островни клетъчни туморни хипогликемии: клиничен преглед. J Clin Endocrinol Metab. 2014; 99 (3): 713–22.
Iglesias P, Diez JJ. Клинична актуализация на индуцирана от тумори хипогликемия. Eur J Ендокринол. 2014; 170 (4): R147–57.
Hizuka N, Fukuda I, Takano K, Asakawa-Yasumoto K, Okubo Y, Demura H. Серумна форма с високо молекулно тегло на инсулиноподобен растежен фактор ii от пациенти с не-островни клетъчни хипогликемии е о-гликозилирана *. J Clin Endocrinol Metab. 1998; 83 (8): 2875–7.
Dutta P, Aggarwal A, Gogate Y, et al. Индуцирана от тумори хипогликемия без островни клетки: доклад за пет случая и кратък преглед на литературата. Endocrinol Diabetes Metab Case Rep.2013; 2013: 130046.
Roy TM, Burns MV, Overly DJ, Curd BT. Самотен фиброзен тумор на плеврата с хипогликемия: синдром на Doege-Potter [резюме]. J Ky Med доц. 1992; 90 (11): 557–60.
Schutt RC, Gordon TA, Bhabhra R, et al. Синдром на Doege-Potter, проявяващ се с хипоинсулинемична хипогликемия при пациент със злокачествен екстраплеврален самотен фиброзен тумор: доклад за случая. J Med Case Rep.2013; 7 (1): 1.
Hadju M, Singer S, Maki RG, Schwartz GK, Keohan ML, Anonescu CR. Свръхекспресията на IGF2 при единични фиброзни тумори е независима от анатомичното местоположение и е свързана със загуба на импринтиране. J Pathol. 2010; 221 (3): 300–7.
Teale JD, Marks V. Неподходящо повишен плазмен инсулиноподобен растежен фактор II по отношение на потиснат инсулиноподобен растежен фактор I при диагностицирането на не-островни клетъчни туморни хипогликемии [резюме]. Clin Endocrinol. 1990; 33 (1): 87–98.
Mohammedi K, Khalil CA, Olivier S, Benabad I, Roussel R, Marre M. Паранеопластична хипогликемия при пациент със злокачествен самотен фиброзен тумор. Endocrinol Diabetes Metab Case Rep.2014; 2014: 140026.
Husain Z, Ho JK, Hantash BM. Знак и псевдо-знак на Leser-Trélat: доклади от случаи и преглед на литературата [резюме]. J Drugs Dermatol. 2013; 12 (5): e79–87.
Baxter RC, Holman SR, Corbould A, Stranks S, Ho PJ, Braund W. Регулиране на инсулиноподобните растежни фактори и техните свързващи протеини чрез глюкокортикоиди и растежен хормон при неислетна клетъчна хипогликемия [резюме]. J Clin Endocrinol Metab. 1995; 80 (9): 2700–8.
Eastman KL, Knezevich SR, Raugi GJ. Ерупиращи себорейни кератози, свързани с употребата на адалимумаб. J Dermatol Case Rep.2013; 7 (2): 60–3.
Silva JA, Mesquita Kde C, Igreja AC, et al. Паранеопластични кожни прояви: концепции и актуализации. Дерматол за сутиени. 2013; 88 (1): 9–22.
Nadler WH, Wolfer JA. Хепатогенна хипогликемия, свързана с първичен карцином на чернодробните клетки [резюме]. Arch Intern Med. 1929; 44 (5): 700–10.
Mohammedi K, Khalil CA, Olivier S, Benabad I, Roussel R, Marre M. Синтез и секреция на инсулиноподобен растежен фактор ii от лейомиосарком със свързана хипогликемия [резюме]. N Engl J Med. 1988; 319: 1434–40.
Marks AG, Carroll JM, Purnell JQ, Roberts CT Jr. Плазмени дейности по разпространение и сигнализиране на прекурсори на IGF-II. Ендокринология. 2011; 152 (3): 922–30.
Miraki-Moud F, Grossman AB, Besser M, Monson JP, Camacho-Hüber C. Бърз метод за анализ на серумен про-инсулиноподобен растежен фактор-II при пациенти с не-островни клетъчни хипогликемии. J Clin Endocrinol Metab. 2005; 90 (7): 3819–23.
Tsuro K, Kojima H, Okamoto S, et al. Глюкокортикоидната терапия подобрява хипогликемията при единичен фиброзен тумор, произвеждащ инсулиноподобен растежен фактор II. Intern Med. 2006; 45 (8): 525–9.
Steigen SE, Schaeffer DF, West RB, Nielsen TO. Експресия на инсулиноподобен растежен фактор 2 в мезенхимни новообразувания. Мод Патол. 2009; 22 (7): 914–21.
Gold JS, Antonescu CR, Hajdu C, et al. Клиникопатологични корелати на единични фиброзни тумори. Рак. 2002; 94 (4): 1057–68.
Alkemade GM, Bakker M, Rikhof B, et al. Хипогликемия при пациент с голям „голям” -ИФР-II-продуциращ тумор. J Clin Endocrinol Metab. 2013; 98 (8): 3113–4.
Принос на авторите
Всички автори са участвали в грижи за пациентите по време на хоспитализация. Те са оценили диагнозата, обсъдили са клиничното управление и са обсъдили изпитите, необходими за окончателна диагноза. ALGM е първият ендокринолог, с когото е установен контакт по време на хоспитализация на пациента. Освен това тя направи преглед на литературата и изготви този ръкопис. DM оказа медицинска подкрепа на пациента и също така допринесе за получаване на необходимите изпити. Тя също така събра медицинските записи за този доклад за клиничния случай. SAD е участвал в преразглеждането на този ръкопис. JRS координира управлението на пациента и насочва стъпките за потвърждаване на диагнозата. Той е участвал в преразглеждането на този ръкопис. Всички автори проследиха еволюцията на пациента и одобриха окончателната версия на този ръкопис.
Информация за автора
Принадлежности
Отдел по ендокринология, Escola Paulista de Medicina, Федерален университет в Сао Пауло, Сао Пауло, SP, Бразилия
Andreia Latanza Gomes Mathez, Debora Moroto, Sergio Atala Dib & Joao Roberto de Sa
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
- Затлъстяването и инсулиновата резистентност са свързани с намалена активност в основните области на паметта на
- Себорейна кератоза Диагностика и лечение
- Себорейни кератози - Аюрведична диета и природни домашни средства
- Тежка спруеподобна ентеропатия, свързана с Олмесартан - ScienceDirect
- Краткосрочното хранене с кетогенна диета предизвиква по-тежка чернодробна инсулинова резистентност, отколкото