Франсис Л. Бърн
1 Училище по биотехнологии и биомолекулярни науки, Университет на Нов Южен Уелс, Сидни, NSW 2052, Австралия; [email protected]
Стефан Р. Харгет
2 Катедра по фармакология, Университет на Вирджиния, Шарлотсвил, VA 22908, САЩ; ude.ainigriv@qh4hs (S.R.H.); [email protected] (S.L.)
Суджой Лахири
2 Катедра по фармакология, Университет на Вирджиния, Шарлотсвил, VA 22908, САЩ; ude.ainigriv@qh4hs (S.R.H.); [email protected] (S.L.)
Р. Джак Рой
3 Катедра по радиология, Университет на Вирджиния, здравна система, Шарлотсвил, VA 22908, САЩ; ude.ainigriv@a5rrj (R.J.R.); ude.ainigriv@b4BS (S.S.B.)
Стюарт С. Бер
3 Катедра по радиология, Университет на Вирджиния, здравна система, Шарлотсвил, VA 22908, САЩ; ude.ainigriv@a5rrj (R.J.R.); ude.ainigriv@b4BS (S.S.B.)
Стивън Х. Колдуел
4 Катедра по медицина, Университет на Вирджиния, Шарлотсвил, VA 22908, САЩ; ude.ainigriv@c5chs
Кайл Л. Хьон
1 Училище по биотехнологии и биомолекулярни науки, Университет на Нов Южен Уелс, Сидни, NSW 2052, Австралия; [email protected]
2 Катедра по фармакология, Университет на Вирджиния, Шарлотсвил, VA 22908, САЩ; ude.ainigriv@qh4hs (S.R.H.); [email protected] (S.L.)
Резюме
1. Въведение
Първичният рак на черния дроб, от които хепатоцелуларният карцином (НСС) е най-честата форма, е шестият по честота рак, третата водеща причина за смъртни случаи, свързани с рака, и е водеща причина за смърт при пациенти с цироза [1]. Хроничните чернодробни заболявания, включително хепатит В и С, афлатоксин В1 и неалкохолна мастна чернодробна болест, насърчават цироза и впоследствие хепатоцелуларен аденом (HCA) и развитие на HCC [1]. Метаболитните заболявания, включително затлъстяването и диабетът, също са важни рискови фактори за HCC и вероятно допринасят за нарастващото разпространение на HCC в развития свят [1].
Възможностите за лечение на рак на черния дроб включват трансплантация, хирургична резекция, образна аблация, хемоемболизация и системни терапии, включително антивирусни средства и VEGFR/мултирозин-киназен инхибитор сорафениб. Многобройни клинични проучвания сравняват ефикасността на подобни агенти, включително ленватиниб и регорафениб, но сорафениб остава единственото одобрено лечение от първа линия за HCC [2]. За съжаление, сорафениб подобрява степента на преживяемост само по месеци [1], подчертавайки спешната нужда от по-добри възможности за лечение на първичен рак на черния дроб.
Перспективата да се използват диетични интервенции за обръщане или предотвратяване на растежа на рака е спечелила голям интерес. Една такава диетична интервенция е кетогенната диета, състояща се от високо съдържание на мазнини и много ниско съдържание на въглехидрати, което води до производството на кетонни тела (кетогенеза) [3]. Черният дроб на бозайниците е основният източник на кетонни тела, които се произвеждат чрез индуцирано от окисляването на мастните киселини производство на ацетил-коензим А (CoA). Когато доставката на въглехидрати в черния дроб е ниска, ацетил-КоА се метаболизира до ацетоацетат (АсАс) и след това се редуцира до β-хидроксибутират. Кетогенна диета, състояща се от средноверижни триглицериди, в момента се използва като лечение на епилепсия [4]. Тази диета и класическата кетогенна диета могат да се окажат полезни и при други разстройства, включително болестта на Алцхаймер, диабет, безалкохолна мастна чернодробна болест и рак на централната нервна система [3,4].
Терапевтичният потенциал на кетогенната диета е изследван за няколко злокачествени заболявания in vitro и in vivo [3] и е изпробван при някои пациенти с напреднало заболяване [5]. Доколкото ни е известно, все още няма проучвания дали кетогенната диета може да бъде полезна за лечението на първичен рак на черния дроб. Нашите предишни проучвания показват, че както мъжки [6], така и женски [7] мишки, лекувани с диетилнитрозамин (DEN) на 2-седмична възраст, са били значително защитени от чернодробна туморогенеза, когато се хранят със същата кетогенна диета, използвана тук, от 6-седмична възраст. Целта на настоящото проучване беше да се определи дали кетогенната диета, прилагана след започване на тумора, може да спре или да обърне прогресията на тумора.
2. Резултати
2.1. Индуцирана от диетилнитрозамин чернодробна туморигенеза
В това проучване използвахме модела DEN за чернодробна туморогенеза при мишки. DEN е прокарциноген, който се метаболизира от цитохром Р450 ензими в черния дроб, за да произведе реактивни кислородни форми и активен канцероген, който образува адукти на мутагенно алкилиране на ДНК [8]. Прогресивните кръгове на клетъчна смърт и регенерация водят до развитието на хепатоцелуларен аденом, който прогресира до HCC. Глобално проучване за сравнение на генната експресия, използващо седем различни миши модели на рак на черния дроб, установи, че моделът DEN е най-подобен на HCC тумори при пациенти с най-лоша преживяемост [9].
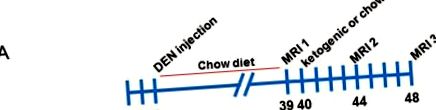
Мъжки мишки C57BL/6 се инжектират с 25 mg/kg DEN на 2-седмична възраст. Мишките се отбиват на 3-седмична възраст и се поддържат на стандартна чау диета от 3 до 39-седмична възраст, след което се оценява натоварването на тумора чрез ядрено-магнитен резонанс (MRI) (илюстрирано на фигура 1 А). Мишките бяха рандомизирани в две групи с подобно туморно натоварване и половината бяха хранени с кетогенна диета, докато другата половина оставаше на диетата с чау. Мишките отново са изобразени на възраст 44 седмици и 48 седмици. Представителни изображения на тумори при всяко ядрено-магнитен резонанс са показани на фигура 1 Б. Мишките след това се бракуват и серумът и тъканите се събират.
Анализи с магнитен резонанс на инжектирани с диетилнитрозамин мишки, хранени с чау и кетогенни диети. (A) Схематичен преглед на експерименталното проучване. (Б.) Представителни серийни изображения на черен дроб на мишка от контролната група, хранена с чау във всяка MRI времева точка.
2.2. Валидиране на кетогенна диетична интервенция
Анализите на Sera потвърждават, че нивата на β-хидроксибутират са значително по-високи при мишки, хранени с кетогенна диета, в сравнение с мишки, хранени с чау, потвърждавайки, че диетата предизвиква кетоза (средни нива от 0,2997 тМ в групата на чау срещу 0,7781 тМ в кетогенната група, р Фигура 2 А). Мишките, хранени с кетогенна диета, са имали значително увеличение на телесното тегло от седмица 39 до седмица 48, в сравнение с мишки, хранени с чау (средна гънка на промяна в групата = 0,985 спрямо средна гъвкавост на промяна в кетогенната група = 1,088, p Фигура 2 Б). Мишките, хранени с кетогенна диета, също са имали значително увеличение на подкожната мазнина (средното тегло на една мастна подложка е 0,095 g при мишки, хранени с чау, срещу 0,188 g при мишки, хранени с кетогенна диета, p Фигура 2 C, D).
Кетогенните мишки, хранени с диета, имат повишени серумни кетони, телесно тегло и тегло на мазнини, отколкото мишки, хранени с чау. (A) Серумни кетонни тела на мишки, хранени с чау или кетогенна диета. Миши серум се събира при завършване на проучването (48 седмици). Данни, анализирани чрез тест на Mann-Whitney (p Фигура 3 A, C) и множественост (брой тумори на мишка, Фигура 3 B). Изображения на повърхностни кръвоизливи тумори са показани на Фигура 3 С за всяко животно в това проучване, а общото туморно натоварване за всяко животно е количествено определено на Фигура 3 D. Като цяло, тези резултати показват, че кетогенната диета, приложена след започване на тумора, не е ефективна при намаляване или предотвратяване на DEN-индуциран растеж на чернодробен тумор.
Мишките, хранени с кетогенна диета, не са защитени от прогресия на тумора. (A) Брой мишки с тумори, видими чрез ЯМР във всяка точка от времето (n = 7). (Б.) Брой тумори, видими чрез ЯМР във всеки черен дроб на мишка (n = 7, ns = незначителен, p = 0.9664). (° С) Изображения на черен дроб от всички мишки, хранени или с чау, или с кетогенна диета. (д) Общо натоварване с тумор на мишка при аутопсия (n = 7, ns = не е значимо, p = 0,7087). Данни, анализирани чрез двупосочен ANOVA с тест за множество сравнения на Sidak (алфа = 0,05) за B и несдвоен тест на Student's t за D. Скала е 1 cm.
3. Дискусия
Повечето ракови клетки, включително рак на черния дроб, претърпяват метаболитно преоборудване, за да увеличат гликолитичния метаболизъм. Този метаболитен фенотип е открит за първи път в тъкан на карцином на черния дроб на плъх от Warburg и колеги [10]. Понастоящем е широко признато, че много видове рак стават зависими от глюкозата, за да подхранват високите нива на гликолиза. Този метаболизъм от тип Варбург е широко разглеждан като потенциална възможност за терапевтична намеса [11].
Кетогенните диети ограничават наличието на глюкоза и ограничават метаболизма от типа на Варбург. Следователно кетогенните диети стават все по-популярни както в предклинични проучвания върху животни, така и при хора, за да могат да предотвратят или обърнат туморния растеж. Като цяло повечето клинични и предклинични проучвания, извършени до момента, показват благоприятен противораков ефект на кетогенната диета [12,13]. Въпреки това, някои животински модели на меланом, глиобластом, астроцитом и рак на панкреаса са били устойчиви на кетогенна диета, а в някои проучвания кетогенната диета е имала протуморен ефект при рак на бъбреците и меланом [12]. В клинична обстановка 42% от проучванията (10 от 24) показват, че кетогенната диета има антитуморен ефект, докато едно проучване отчита протуморен ефект, а останалите нямат ефект [12]. Следователно има ясно специфични за тъканите и генетични компоненти, които определят дали туморите са чувствителни към кетогенна диетична терапия.
Моделът DEN за чернодробна канцерогенеза е най-често срещаният модел в тази област. DEN причинява изразена геномна нестабилност и произвежда тумори с хетерогенни мутации и хромозомни печалби и загуби [14]. Това разнообразие и степен на генотоксични увреждания съответстват на HCC при хора с лоша прогноза [9]; по този начин този модел е подходящ за изследване дали кетогенната диета може да има противоракови ефекти, които могат да бъдат преведени в клиниката. В предишните ни проучвания, използващи същия DEN протокол, кетогенна диета, прилагана на мишки на възраст 6 седмици, значително предотвратява образуването на чернодробни тумори [6,7]. Следователно първоначално предположихме, че кетогенната диета, приложена по-късно по време на прогресията на заболяването, ще има някои защитни антитуморни ефекти. Установихме обаче, че кетогенната диета с късно начало, прилагана през последните 8 седмици от протокола на изследването, няма ефект върху общото натоварване на тумора. Този резултат е в съответствие с наблюденията на Klement et al., Че кетогенните диети са по-защитни, когато се инициират преди трансплантация на тумор [15].
Ограниченията на това проучване включват липсата на връзки между метаболитните фенотипи и туморната тежест. Например, приемът на храна не е бил определен, тъй като животните са били настанявани в групи и остава неясно как параметрите, свързани с толерантността към глюкозата, включително нивата на инсулин и глюкоза на хранене и на гладно или глюкозо-кетонният индекс [16], корелират с туморната тежест. Освен това стареенето е свързано с намаляване на производството на кетон в тялото [17]; следователно не е възможно да се изключат по-малки ефекти от кетогенната диета при въвеждане на мишки на 40-седмична възраст в сравнение с 6-седмична възраст.
4. Материали и методи
4.1. Диетична намеса при мишки
C57BL/6N мъжки мишки бяха настанени и отглеждани в контролирана от температурата стая (22 ° C) на 12-часов цикъл светлина/тъмнина в клетки с филтър и с либитум достъп до храна и вода. На мишките се инжектира диетилнитрозамин (DEN) (25 mg/kg) на 2-седмична възраст чрез интраперитонеално (i.p.) инжектиране и се отбиват на 21-дневна възраст. Мишките са били на диета чау до навършване на 39-седмична възраст и след това са преминали на кетогенна диета или са били на чау-диета на 40-та седмица. Кетогенната диета е била приготвена вътрешно и е съставена от (w/w) 4% минерален микс AIN-76 (Harlan Teklad), 1% витаминен микс AIN-76 (Harlan Teklad), 0,4% холин битартрат, 0,3% метионин, 2% желатин, 71% свинска мас, 16% казеин и 6% масло от шафран, както е описано по-рано [6], с енергия (% от kcal) за протеини, мазнини и въглехидрати съответно от 8%, 90% и 2%. Диетата с чау беше Teklad LM-485 диета за мишки, 7012 (Envigo) с енергия (% от kcal) за протеини, мазнини и въглехидрати съответно 25%, 17% и 58%.
4.2. ЯМР на черен дроб на мишка
ЯМР сканирането се извършва на 39, 44 и 48 седмици, като се използва 7T Clinscan MR система (Bruker, Ettlingen, Германия). За радиочестотно (RF) предаване и приемане е използвана RF намотка за птичи клетки, която има диаметър 35 mm. Сърдечната честота, дишането и основната телесна температура се наблюдават с помощта на оптична, MR-съвместима система (Small Animal Imaging Inc., Stony Brook, NY, USA). Анестезията се поддържа с използване на 1,25% изофлуран в O2, вдишван през конус на носа. След анестезиране на мишките се прилага гадолиний (Gd) (инжектиране на гадобенат димеглумин, MultiHance, Bracco Diagnostics) в разтвор при 0,6 mmol/kg чрез интрамускулно инжектиране в левия квадрицепс. След това мишките се държат в продължение на 5 минути, за да може циркулиращият индикатор. Изображенията са получени с T1-претеглена, подобрена с гадолиний импулсна последователност на спин-ехо. Параметрите за изобразяване бяха TR (повторение) = 797 ms, TE (ехо) = 15 ms, 2 средни стойности, матрица от 192 × 192 (нула запълнена до 256 × 256), FatSat (силен режим), 21 среза със 100% разлика. Това се повтори с 21 съседни резена, за да се осигури непрекъснат набор от 42 изображения. Суровите DICOM файлове бяха сортирани и преименувани с помощта на DICOMSort и след това изображенията бяха импортирани в ImageJ Фиджи за преброяване на чернодробни тумори. Минималният откриваем размер на тумора е 1,5 mm в диаметър.
4.3. Колекция от миши тъкани и кръв
На 48-седмична възраст мишките бяха евтаназирани чрез цервикална дислокация и кръв, събрана чрез сърдечна пункция. Кръвните проби се центрофугират при 5000 об/мин за 15 минути при 4 ° С и серумът се съхранява при -80 ° С до допълнителни анализи. Черният дроб на мишката беше изрязан, изобразен, претеглен и след това преброени повърхностни кръвоизливи. Подкожните подложни и гонадни мастни подложки на мишки (по една подложка от дясната им страна) се претеглят и замразяват бързо. Всички експерименти с животни са одобрени от Комитета по грижа и употреба на животните в Университета на Вирджиния (Етичният кодекс е 3942: „Метаболитна намеса при рак.“).
4.4. Измервания на серума
Комплект за колориметричен тест за β-хидроксибутират (кетонно тяло) (Cayman Chemical) е използван за измерване на серумните кетонни тела в кръвта, събрана от произволно хранени мишки по време на прибиране, съгласно инструкциите на производителя.
4.5. Статистически анализи
Данните с нормално разпределение бяха анализирани с помощта на параметрични тестове, а данните с неравномерни дисперсии бяха анализирани с помощта на непараметрични тестове (посочени в легендите на фигурите). Всички статистически анализи бяха извършени в GraphPad Prism.
5. Заключения
Като цяло, това проучване показва, че кетогенната диета не спира или не спира растежа на установени тумори; това проучване обаче представлява моделна система при мишки и резултатите трябва да се интерпретират в този контекст, когато не е възможно широко екстраполиране на находките на всички хора с генетично разнообразни тумори. Резултатите обаче ясно показват, че този често срещан миши модел на чернодробна туморогенеза е устойчив на кетогенна диета. Тези данни предполагат, че кетогенните диети могат да бъдат най-ефективни, когато се използват като профилактична интервенция.
Принос на автора
Концептуализация, K.L.H., S.H.C. и S.S.B .; Методология, S.R.H., S.L. и R.J.R .; Официален анализ, S.R.H. и F.L.B .; Писане - Подготовка на оригинален проект, F.L.B .; Писане - Преглед и редактиране, F.L.B. и K.L.H.
Финансиране
Това проучване беше финансирано отчасти от Фондация за ранна кариера на Института за рака в Нов Южен Уелс (FLB, ECF171121), грант за проект на NHMRC (KLH, APP1108211), NIH R01 (KLH,> DK101803) и грант за оборудване на NIH за 7T Clinscan MR система (SSB, RR019911).
Конфликт на интереси
Авторите не декларират конфликт на интереси.
- Reddit - кето - Повишени чернодробни ензими при кетогенна диета
- PRIME PubMed Метаболитно въздействие на кетогенна диета в сравнение с хипокалорична диета при затлъстели деца
- Диетолог разкрива тайната зад драматичното отслабване на Хосе Алдо - „кетогенната диета“; Кето
- Nutrex Lipo 6 Black Keto Добавка за отслабване за кетогенна диета
- Псориазисът и затлъстяващият черен дроб са чести придружители - ако имате псориазис, помислете за диетата NAFLD