Киоко Инагаки-Охара
Изследователски институт, Национален център за глобално здраве и медицина (NCGM), 1-21-1, Toyama Shinjuku, Токио, 162-0052 Япония
Отдел по ендокринология и метаболизъм, Отдел по физиология на развитието, Национален институт за физиологични науки (NIPS), 38 Nishigonaka Myodaiji, Okazaki, Aichi 444-8585 Япония
Отдел за защита на домакините, Департамент по природни науки, Факултет по битови и екологични науки, Префектурен университет в Хирошима, 562 Нанацука, Шобара, Хирошима 727-0023 Япония
Шики Окамото
Отдел по ендокринология и метаболизъм, Отдел за физиология на развитието, Национален институт за физиологични науки (NIPS), 38 Nishigonaka Myodaiji, Okazaki, Aichi 444-8585 Япония
Казуйо Такаги
Отдел по ендокринология и метаболизъм, Отдел по физиология на развитието, Национален институт за физиологични науки (NIPS), 38 Nishigonaka Myodaiji, Okazaki, Aichi 444-8585 Япония
Кумико Сайто
Отдел по ендокринология и метаболизъм, Отдел за физиология на развитието, Национален институт за физиологични науки (NIPS), 38 Nishigonaka Myodaiji, Okazaki, Aichi 444-8585 Япония
Сейя Арита
Отдел за защита на домакините, Департамент по природни науки, Факултет по битови и екологични науки, Префектурен университет в Хирошима, 562 Нанацука, Шобара, Хирошима 727-0023 Япония
Лиджун Танг
Отдел по ендокринология и метаболизъм, Отдел за физиология на развитието, Национален институт за физиологични науки (NIPS), 38 Nishigonaka Myodaiji, Okazaki, Aichi 444-8585 Япония
Тецуджи Хори
Централен институт за микробиологични изследвания Якулт, 5-11 Идзуми, Кунитачи, Токио, 186-8650 Япония
Хироаки Катаока
Секция по онкопатология и регенеративна биология, Катедра по патология, Медицински факултет, Университет в Миядзаки, 5200 Кихара, Кийотаке, Миядзаки, 889-1692 Япония
Сатоши Мацумото
Централен институт за микробиологични изследвания Якулт, 5-11 Идзуми, Кунитачи, Токио, 186-8650 Япония
Ясухико Минокоши
Отдел по ендокринология и метаболизъм, Отдел за физиология на развитието, Национален институт за физиологични науки (NIPS), 38 Nishigonaka Myodaiji, Okazaki, Aichi 444-8585 Япония
Резюме
Заден план
Затлъстяването увеличава риска от злокачествени заболявания в различни тъкани, включително стомаха. Атрофичният гастрит с предракови лезии е свързано със затлъстяването заболяване; обаче механизмите, които стоят в основата на развитието на свързания със затлъстяването атрофичен гастрит, са неизвестни. Лептинът е хормон, получен от стомаха, както и от мастната тъкан и стомашният лептин участва в развитието на рак на стомаха. Целта на настоящото проучване е да се изследва участието на сигнала на лептиновия рецептор в развитието на атрофичен гастрит по време на диета, индуцирано затлъстяване.
Методи
Мъжете мишки C57BL/6, ob/ob и db/db са били хранени с диета с високо съдържание на мазнини (HFD) или контролна диета (CD) от 1 седмица до 5 месеца. Патологичните промени в стомашната лигавица и експресията на молекули, свързани с атрофичен гастрит, бяха оценени при тези мишки.
Резултати
HFD хранене, индуцирана стомашна лигавична хиперплазия с повишена експресия на стомашен лептин. Мукозната хиперплазия е придружена от по-висока честота на Ki67-позитивни пролифериращи клетки и атрофия на стомашните жлези при наличие на възпаление, което се увеличава след HFD хранене. В стомашната лигавица на мишки, хранени с HFD в продължение на 1 седмица, беше открито активиране на свързани с сигнализация ObR молекули като ObR, STAT3, Akt и ERK. Морфологичните промени, свързани със стомашната атрофия на лигавицата и експресията на Muc2 и Cdx2, приличат на тези, свързани с чревната метаплазия на човека. За разлика от мишки от див тип, мишки с дефицит на лептин ob/ob и мишки с мутация на лептин рецептор db/db не показват повишена експресия на Cdx2 в отговор на HFD хранене.
Заключение
Заедно тези резултати предполагат, че активирането на лептиновия сигнален път в стомаха е необходимо, за да се развие атрофичен гастрит, свързан със затлъстяването.
Електронен допълнителен материал
Онлайн версията на тази статия (doi: 10.1186/s12986-016-0066-1) съдържа допълнителен материал, който е достъпен за оторизирани потребители.
Заден план
Стомашният карцином (GC) обикновено възниква на фона на атрофичен гастрит, чревна метаплазия и дисплазия на стомашната лигавица и е втората водеща причина за смъртни случаи, свързани с рак в света [1]. Затлъстяването увеличава риска от по-голямо разпространение на гастрит [2,3], атрофичен гастрит [4–6] и аденокарцином на стомашната кардия [7–9]. Инфекцията с Helicobacter pylori, бактерия, която заразява хората и колонизира стомаха, е преобладаващата причина за предракови лезии в лигавицата на лигавицата на стомаха [10]. Въпреки че инфекцията с H. pylori не се ограничава само до пациенти със затлъстяване, затлъстяването увеличава разпространението на хроничния гастрит и GC [2]. Освен това затлъстяването е не само рисков фактор за някои тумори, но е свързано и с повишена смъртност [11]. По този начин затлъстяването потенциално влияе върху развитието на гастрит в стомашна туморогенеза. Следователно е наложително да се идентифицират сигнални молекули, свързани както със затлъстяването, така и с предраковите лезии, за да се помогне при управлението на високорискови индивиди.
Методи
Животни и диети
Мъжки мишки C57BL/6J (див тип: WT), ob/ob и db/db мишки (CLEA Япония, Токио, Япония) са изследвани на 7-седмична възраст. Животните бяха настанени индивидуално в пластмасови клетки при 24 ° C ± 1 ° C с включени светлини от 0600 до 1800 h. На мишките беше осигурена или контролна диета (CD, 10% калории от мазнини, D12450J) или диета с високо съдържание на мазнини (HFD, 60% от калориите от мазнини, D12492) (Research Diets Inc., New Brunswick, NJ ) и вода ad libitum. Етичната комисия за опити с животни на Националния институт за физиологични науки одобри всички опити с животни.
Хистопатологичен анализ на стомашната лигавица
Парафинови вградени стомашни участъци от 10% фиксирани с формалин тъкани бяха получени от HFD- и CD-хранени мишки и бяха оцветени с хематоксилин и еозин (H&E) и оценени за промени в стомашната лигавица. Оценката на лигавичните промени в стомаха се основава на сумиране на резултатите за хиперплазия (0, несъществена промяна; 1, ниска; 2, умерена; 3, висока), клетъчна инфилтрация (0, несъществена промяна; 1, ниска; 2, умерена; 3, висока), загуба на стомашни жлезисти клетки (0, незначителна промяна; 4, ниска; 5, умерена; 6, висока), оцветяване в синьо алкиан (0, несъществена промяна; 4, фокусно; 5, дифузно; 6, много силно дифузно) и дисплазия (0, незначителна промяна; 7, ниска). Всеки критерий беше независимо сляп от двама души, използвайки критерии, които бяха предварително определени [19].
Интрагастрални измервания на pH
Стомашното рН се измерва съгласно публикуван метод [21]. Накратко, мишките бяха умъртвени след анестезия чрез вдишване на въглероден диоксид. След отстраняване на стомаха, стомашният лумен беше отстранен и измит с 0,5 ml физиологичен разтвор (150 тМ, рН 7,0) и рН на събраната стомашна течност беше измерено с помощта на рН метър (Mettler, Toledo, OH).
Имунохистохимичен анализ
Western blot анализ
Стомашно-епителните клетки бяха изолирани и подготвени съгласно модификация на предварително публикуван метод [22]. Разрязаните малки сегменти на стомаха се разбъркват при стайна температура в продължение на 10 минути в балансиран солев разтвор на Hank (HBSS) (Thermo Fisher Scientific Inc., Waltham, MA) среда, съдържаща 1 mM DTT. След отстраняване на супернатанта, тъканите се разбъркват при 37 ° С в продължение на 10 минути в HBSS, съдържащ 10 mM EDTA. След отстраняване на супернатанта, тъканната суспензия се прекарва през найлонова мрежа за отстраняване на отломки и се центрофугира през 25/40% прекъснат Percoll (Sigma-Aldrich, Сейнт Луис, МО) градиент при 600 × g при 20 ° C за 20 мин. Клетките, събрани от границата на 25/40%, са епителните клетки. Лизатите се приготвят от тъкани и клетки и се анализират чрез уестърн блотинг, съгласно предварително публикуван метод [23]. Абс, използвани при уестърн блотинг, са обобщени в Допълнителен файл 1: Таблица S1.
Микродисекция с улавяне с лазер
Описаните по-горе парафинови стомашни тъкани бяха нарязани на участъци с дебелина 6 μm и монтирани върху мембранни стъкла (MembraneSlide 1.0 PEN, Carl Zeiss Microscopy, LLC, Thornwood, NY). Парафинът се отстранява чрез изплакване на секциите с ксилол, след което участъците се потапят в серия от 100% до 70% етанолови бани и се изсушават на въздух. Лигавичните участъци на стомашния епител бяха изрязани и събрани върху AdhesiveCaps (PALM, Microlaser Technologies, Bernried, Германия) чрез система за микродисекция с лазерно улавяне (LMD) (PALM MB-III, Microlaser Technologies).
Количествена верижна реакция с обратна транскрипция-полимераза (qRT-PCR)
Общата РНК от LMD пробите и от миша стомашна лигавица беше извлечена, използвайки съответно комплекти AllPrep FFPE DNA/RNA и RNeasy Mini (Qiagen, Валенсия, Калифорния), съгласно протоколите на производителя. cDNA се синтезира от приблизително 100–200 ng РНК от LMD секциите или 1-2 μg РНК от клетки на лигавицата на стомаха, използвайки ReverTra Ace ® qPCR RT Kit (TOYOBO, Co., Ltd., Osaka, Japan) съгласно протокола на производителя . qRT-PCR се извършва с помощта на Power SYBR Green PCR Master Mix (Life Technologies, Carlsbad, CA) със специфични набори праймери (400 nM при крайна концентрация, Допълнителен файл 2: Таблица S2) съгласно протокола на производителите. Относителните промени в генната експресия бяха изчислени с помощта на метода ΔΔCt, а 18S rRNA генът беше използван за нормализиране.
Количествен анализ на имунохистохимичното оцветяване
За микроскопски измервания пробите от лептинова стомашна лигавица са заснети с помощта на микроскоп (Olympus) и е извършен количествен анализ с помощта на софтуера ImageJ (http://rsb.info.nih.gov/ij/index.html). Височината на лигавицата е измерена между основата на стомашните жлези и зоната на шията.
Плазмен анализ
Серумът се събира от кръв, получена чрез кардиоцентеза под анестезия и се съхранява при -80 ° C. Инсулин (Mouse Insulin ELISA kit, Shibayagi, Gunma, Япония), лептин (Leptin ELISA, Millipore, St. Charles, MO), глюкоза (глюкозен CII-тест, Wako, Osaka, Япония) и неестерифицирана мастна киселина (NEFA ) (NEFA C-тест, Wako) нивата в серумите бяха измерени съгласно протоколите на производителите.
Статистически анализ
U-тестът на Mann-Whitney и тестът на Kruskal-Wallis бяха използвани за определяне на значителни разлики. Стойността на р по-малка от 0,05 се счита за значима. Статистическите анализи бяха извършени с помощта на софтуер Prism версия 6 (GraphPad, Сан Диего, Калифорния, САЩ).
Резултати
Хранените с HFD мишки развиват атрофичен гастрит
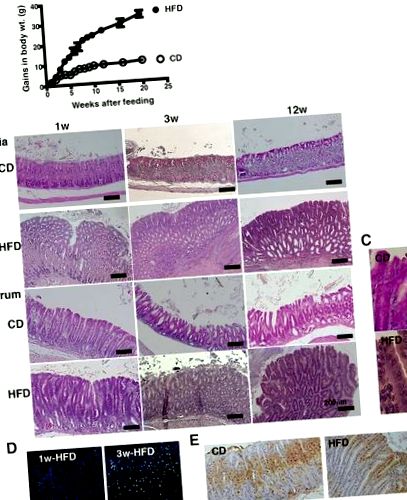
Патологични промени в стомашната лигавица поради HFD хранене. а Промяна на нарастването на телесното тегло на мишки C57BL/6 J, хранени с CD (n = 10) или HFD (n = 10) в продължение на 20 седмици. б Представителни H & E-секции на стомашната кардия и антрума от мишки, хранени с CD или HFD за 1, 3 и 12 седмици. ° С Увеличено изображение на стомашния антрал при мишки, хранени с CD и HFD на фиг. 1b на 12 седмици след хранене (увеличение, × 400). Наблюдавани са клетъчните ядра, ядрена хипертрофия, дисполярност и псевдостратификация. д CD45 оцветяване на стомашната лигавица на 1 и 3 седмици HFD-хранени мишки. д Ki67-оцветяване в стомашната лигавица на мишки, хранени с CD или HFD в продължение на 3 седмици. При всеки анализ бяха използвани 5–10 мишки и са показани представителни данни
Забавена индукция на възпалителни цитокини в стомашната лигавица след HFD хранене. а Експресия на ген на лептин, Il6 и Il11 в стомашната лигавица на CD- и HFD-хранени мишки след 1, 3 и 12 седмици. Стойностите представляват средните стойности ± SD на 4 мишки. Резултатите са анализирани чрез теста на Kruskal-Wallis. * p 7a). Анализът на височината на лигавицата е в съответствие с хистологичните находки (фиг. 7в). Освен това, имунохистохимичният анализ разкрива повишена колокализация на Cdx2 и лептин в стомашната лигавица на WT мишки, хранени с HFD в продължение на 1 седмица (Фиг. 8а), докато db/db мишки не показват експресия на Cdx2 в лептин-положителни клетки. За разлика от това, ob/ob мишките показаха малко Cdx2 и липса на експресия на лептин. По същия начин, съвместна локализация на фосфорилирани ObRb и Cdx2 е открита при HFD-хранени WT мишки, но не и при HFD-хранени ob/ob или db/db мишки, които показват само известно фосфорилиране на ObRb или Cdx2, съответно. CD-хранените ob/ob и db/db мишки показват драстично нарастване на телесното тегло, но само лека хиперплазия в стомашната лигавица в сравнение с WT мишки на 3 седмици (Фиг. 7b и and7c). 7в). Въпреки че имат по-високо телесно тегло, ob/ob и db/db мишки, хранени с HFD в продължение на 3 седмици, показват по-малко хиперплазия, отколкото WT мишките, хранени с HFD в продължение на 20 седмици. След 20 седмици HFD хранене, WT мишките показаха неправилна и слята структура в кардията (Фиг. 7b). HFD храненето не повишава експресията на Cdx2 и Muc2 в стомашната лигавица на ob/ob и db/db мишки (Фиг. 8b). Тези резултати показват, че сигналът за лептин в стомаха е важен фактор, който води до метапластична патология при гастрит, свързан със затлъстяването.
Потиснато изменение на стомашната морфология при HFD-хранени мишки, лишени от лептинова сигнализация. Представителни H & E-секции на стомашната лигавица от WT, ob/ob и db/db мишки, хранени с CD или HFD за 1 (а) и 3 седмици (б). Всяка стойност на изображенията показва телесното тегло на мишката, от която е получена стомашната лигавица и оцветена с H & E-оцветяване. ° С Измерване на височината на лигавицата в стомашния фундус на WT, ob/ob и db/db мишки на 1 и 3 седмици и на WT мишки на 20 седмици след хранене. Стойностите представляват средните стойности ± SD на 4 мишки. Резултатите са анализирани чрез теста на Kruskal-Wallis. * p 5a) и показват по-малко прогресиране на стомашната хиперплазия, въпреки че тези мишки са по-затлъстели от WT мишки, хранени с HFD (фиг. 7). Освен това, ob/ob и db/db мишките не развиват спонтанно стомашни тумори, въпреки че тези мишки проявяват извънредно затлъстяване. По този начин, резултатите от нашето проучване, заедно с тези от предишните доклади, показват, че сигнализирането за лептин е критично включено в контрола на развитието на епитела в различни тъкани. Въпреки че значението на експресията на лептин и неговото сигнализиране в стомаха остава несигурно, като се има предвид конститутивната експресия на лептин и ObRb в стомаха [45, 46], лептин може да е необходим за поддържане на хомеостазата на стомашната лигавица.
В обобщение, демонстрирахме развитието на атрофичен гастрит, използвайки миши модел на диета, индуцирано затлъстяване с подобрена сигнална пътека лептин-ObRb. Експресията и уникалната локализация на сигналния път на лептин-ObR показва предимно роля в ранната фаза на човешкия GC. Значението на това проучване се крие в потенциалната и безценна употреба на лептин и ObR като биомаркери или като нови терапевтични цели за диагностика и лечение на атрофичен гастрит.
Заключение
В това проучване ние показваме, че индуцираните от диета затлъстели WT мишки проявяват свръхекспресия на лептин и активиране на сигнала за лептинов рецептор в стомашната лигавица, което води до атрофичен гастрит с чревна метаплазия на стомашната лигавица. Тези патологични характеристики са по-малко тежки при ob/ob и db/db мишки, при които липсва сигнализация за лептинов рецептор, отколкото при WT мишките. Следователно, сигнализирането за лептинов рецептор в стомаха е критична контролна точка за появата на стомашна неоплазия и може да се разработи превантивна терапия, насочена към сигнализиране на стомашен лептинов рецептор срещу GC.
Благодарности
Тази работа беше подкрепена от Безвъзмездни средства за научни изследвания (C) от Министерството на образованието, културата, спорта, науката и технологиите на Япония (23590272 и 26461391) и Програма за безвъзмездна помощ за научни изследвания PUH (A) (Префектурен университет в Хирошима ) присъден на К. ИО. Бихме искали да благодарим на професор Такао Шимидзу, професор Масаши Мизоками (NCGM), д-р Масанобу Нано (Якулт Хонша Ко ООД) и професор Масао Мицуяма (Университета в Киото) за тяхното непрекъснато насърчаване и подкрепа.
Съкращения
| CD | Контролна диета |
| DTT | Дитиотреитол |
| EDTA | Етилендиаминтетраоцетна киселина |
| ELISA | Имунособентен анализ, свързан с ензимите |
| GC | Стомашен карцином |
| HFD | Диета с високо съдържание на мазнини |
| LMD | Микродисекция с улавяне с лазер |
| НЕФА | Неестерифицирана мастна киселина |
| WT | Див тип |
Допълнителни файлове
Списък на антителата: Антитела, използвани за вестерн-блотинг и имунохистохимия. (DOCX 127 kb)
Грундове, използвани за количествена PCR. (DOCX 100 kb)
Промяна на индекса, свързана със затлъстяването. Телесното тегло (A), инсулин, лептин, глюкоза и NEFA в серуми (B) при CD- и HFD-хранени WT, ob/ob и db/db мишки бяха измерени 1 седмица след хранене. Резултатите бяха анализирани чрез теста на Kruskal Wallis. * стр
Бележки под линия
Конкуриращи се интереси
Авторите заявяват, че нямат конкуриращи се интереси.
Принос на авторите
K I-O замисля и проектира проекта и изпълнява експериментите и пише ръкописа. KT, LT, KS и SA подпомагат експериментите за грижа за животните и плазмен анализ, TH и SM създават LMD. SO и YM анализираха данните и предоставиха конструктивна дискусия. Всички автори прочетоха и одобриха окончателния ръкопис.
- Диета с високо съдържание на мазнини и висок холестерол увеличава честотата на гастрит при LDL рецептор-отрицателни мишки
- Инсулинова и лептинова резистентност при хиперлептинемия при мишки, при които липсва диабет с андрогенен рецептор
- Високомаслено диетично затлъстяване, мастно възпаление, чернодробна стеатоза и хиперинсулинемия в
- Загубата на протонен канал Hv1 с напрежение води до затлъстяване, предизвикано от диета при мишки BMJ Open Diabetes
- Диетата с високо съдържание на мазнини прави мишките податливи на нараняване на черния дроб - ScienceDaily