Моник Барел
1 Université Paris Descartes, Sorbonne Paris Cité, Париж, Франция
2 INSERM U1151 - National National de la Recherche Scientifique UMR 8253, Institut Necker-Enfants Malades, Париж, Франция
Елоди Рамънд
1 Université Paris Descartes, Sorbonne Paris Cité, Париж, Франция
2 INSERM U1151 - National National de la Recherche Scientifique UMR 8253, Institut Necker-Enfants Malades, Париж, Франция
Гаел Гесберт
1 Université Paris Descartes, Sorbonne Paris Cité, Париж, Франция
2 INSERM U1151 - National National de la Recherche Scientifique UMR 8253, Institut Necker-Enfants Malades, Париж, Франция
Ален Шарбит
1 Université Paris Descartes, Sorbonne Paris Cité, Париж, Франция
2 INSERM U1151 - National National de la Recherche Scientifique UMR 8253, Institut Necker-Enfants Malades, Париж, Франция
Резюме
Въведение
Francisella tularensis е малък Грам-отрицателен бацил, аеробен, не образуващ спори и неподвижен. Този факултативен вътреклетъчен патоген е причинителят на зоонозната болест туларемия при голям брой животински видове. Този силно инфекциозен бактериален патоген може да се предаде на хората по много начини (Sjostedt, 2011), включително директен контакт с болни животни, вдишване, поглъщане на замърсена вода или храна или чрез ухапвания от кърлежи, комари или мухи. Съществуват четири различни подвида (subsp.) На F. tularensis, които се различават по вирулентност и географско разпространение, обозначени subps. tularensis, holarctica, mediasiatica и novicida, съответно. Най-вирулентният подвид tularensis се счита за потенциален агент от клас А в биотероризма от Центровете за контрол на заболяванията (CDC) в САЩ (Oyston et al., 2004; Keim et al., 2007). F. tularensis subsp. novicida (F. novicida) рядко е патогенен за неимунокомпрометирани хора, но е напълно вирулентен за мишки и поради това е широко използван като модел за изследване на вътреклетъчния паразитизъм на Francisella.
F. novicida има способността да избягва защитата на гостоприемника и да се репликира до голям брой в цитозола на еукариотните клетки (Jones et al., 2012). Бактерията е в състояние да се репликира в различни клетки, и по-специално в макрофаги. След преходно преминаване през фагозомно отделение бактериите се освобождават в рамките на 30–60 минути в цитозола на гостоприемника, където претърпяват няколко кръга на активна репликация (Celli and Zahrt, 2013). Най-малко 20% от генома участва до известна степен във вирулентността на Francisella (Meibom и Charbit, 2010b), включително важна част от гените, свързани с метаболитните и хранителните функции. Разбирането на връзката между храненето и in vivo жизнения цикъл на Франсисела все още е слабо разбрано.
Предполага се, че Франсиела притежава множество системи за усвояване на хранителни вещества, за да улови необходимите хранителни вещества, получени от гостоприемника, някои от които вероятно се предлагат в ограничаващи концентрации. Тук ще разгледаме последните си открития относно две системи за придобиване на аминокиселини на Francisella и тяхното значение във физиологията и вътреклетъчния жизнен цикъл на Francisella. Също така ще обсъдим основните отговори на гостоприемника, идентифицирани до момента, предизвикани от инфекция на Francisella, които допринасят за подхранването на цитозолното отделение.
Аминокиселинните транспортери на Francisella играят критична роля при вътреклетъчното размножаване
По-рано показахме, че Francisella използва цистеин-съдържащия трипептид глутатион (GSH) като източник на цистеин, за да се репликира в заразени макрофаги (Alkhuder et al., 2009), като по този начин предполага, че тази бактерия се е развила чрез експлоатация на естественото изобилие на GSH в гостоприемника цитозол, за да компенсира естествената си ауксотрофия за цистеин. Съвсем наскоро решихме да оценим ролята на аминокиселинните транспортни системи в качеството на Francisella да процъфтява вътреклетъчно.
По-долу ще обсъдим данните, които получихме съвсем наскоро за GadC и AnsP, като два вторични транспортера са участвали специално във фагозомно бягство и цитозолно размножаване, съответно.
Членовете на семейството APC
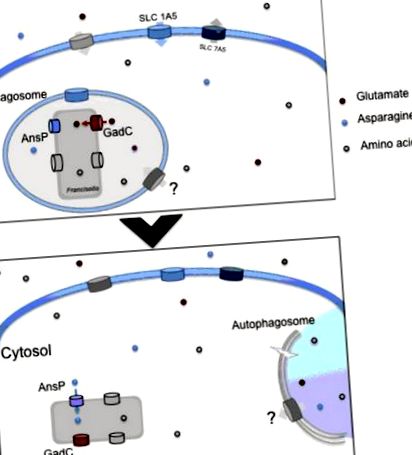
Геномите на F. tularensis кодират 11 предсказани членове на аминокиселинно-полиамин-органокационните (APC) транспортери от суперсемейство, специално участващи в обмена на аминокиселини без йони. Забележително е, че 8 от 11-те членове на APC са идентифицирани поне веднъж в по-ранни генетични изследвания (in vitro или in vivo). Функционалната роля на един от тях, глутаматният транспортер GadC, беше изяснена в нашата лаборатория (Ramond et al., 2014) и беше показан нейният съществен принос за фагозомното бягство на Francisella.
Поглъщането на глутамат е критично за фагозомата
Транспортьорите на MFS
Значението на семейството MFS за вирулентността на вътреклетъчните бактерии е демонстрирано за първи път при Legionella pneumophila. Всъщност е установено, че треонин транспортер (наречен PhtA за фагозомния транспортер А) не може да се диференцира в репликативна форма в макрофаги и изразява ранен стадий на факторите, водещи до трансмисивната форма в хранителната среда (Sauer et al., 2005) . Геномът на L. pneumophila кодира 10 допълнителни паралога на PhtA (Sauer et al., 2005), някои от които са необходими и по време на вътреклетъчна репликация (Fonseca и Swanson, 2014). PhtJ е необходим за придобиване на валин и PhtC и PhtD съвсем наскоро бяха показани, че допринасят за защитата на L. pneumophila от dTMP глад (Fonseca et al., 2014).
Поразително е, че Pht транспортерите представляват подсемейство на MFS транспортери, открити изключително във вътреклетъчните патогени и по-специално в алфа и гама-протеобактериите (включително L. pneumophila, Coxiella burnetii, Rickettsiella grylli, Francisella tularensis, Wolbachia, Anaplasma, Ehrlichicus, Protochloc marinus и Zymomonas mobilis (Chen et al., 2008).
Това ни накара да разгледаме приоритетно ролята на членовете на подсемейство Pht в патогенезата на Francisella. Шестте Pht транспортера, идентифицирани във Francisella, са силно консервирани в различните подвидове (> 95% идентичност на аминокиселините). Установено е, че всеки от тези носители допринася за вирулентността на F. tularensis (Qin and Mann, 2006; Weiss et al., 2007; Kraemer et al., 2009; Asare and Abu Kwaik, 2010; Asare and Kwaik, 2010; Moule et ал., 2010; Peng и Monack, 2010; Llewellyn et al., 2011).
Функционалната роля на два Pht транспортера на F. tularensis беше съвсем наскоро изяснена в нашата лаборатория (Gesbert et al., 2014, 2015). По-долу ще се съсредоточим върху един от тях, аспарагиновият транспортер AnsP, който допринася изключително за цитозолното размножаване на патогена.
Поглъщането на аспарагин е критично за цитозолното размножаване
Инактивирането на гена ansP в F. tularensis subsp tularensis SCHU S4, F. tularensis subsp holarctica LVS или F. tularensis subsp novicida U112, води до намаляване на вътреклетъчното размножаване при различни клетъчни модели като HepG2 човешки хепатоцити, първични макрофагаги на мишки и миши макрофафаги J774 (Qin and Mann, 2006; Marohn et al., 2012; Gesbert et al., 2014). In vivo инактивирането на гена ansP причинява значително намаляване на вирулентността на F. tularensis subsp novicida U112 при Drosophila (Asare и Abu Kwaik, 2010); и F. tularensis subsp holarctica LVS при мишки BALB/c (Marohn et al., 2012).
Вероятно други членове на семействата MFS и APC (и евентуално на други семейства), които предстои да бъдат открити, могат да участват във вътреклетъчния жизнен цикъл на Francisella (Фигура (Фигура 1 1).
Използване на аминокиселина от вътреклетъчната Francisella. (А) При влизане в макрофагите, Франсизела временно се намира във фагозомно отделение. В това отделение глутаматната пермеаза GadC помага на бактерията да се противопостави на оксидативния стрес, генериран от NADPH оксидазата. Този транспортер е критично необходим за правилното бактериално фагозомно бягство. Едновременно с това синтезът на неутралния аминокиселинен транспортер гостоприемник SLC1A5 бързо се регулира нагоре, благоприятствайки навлизането на аминокиселини в заразената клетка гостоприемник. (Б) Веднъж попаднали в цитозола на гостоприемника, бактериите започват своята активна репликация и следователно се нуждаят от доставяне на множество допълнителни хранителни вещества, получени от гостоприемника. Проникването на AnsP допринася за размножаване на бактерии, като осигурява аспарагин за синтез на протеини. Независимата от ATG-5 автофагия допринася за доставянето на аминокиселини, обогатявайки цитозолната бактериална диета. И в двата етапа други аминокиселинни транспортери допринасят за правилното хранене на бактерията.
Източници на аминокиселини, получени от домакин
Цитозолът гостоприемник, считан по-рано за безопасен хранителен продукт (Ray et al., 2009), сега е установен като животозастрашаваща среда, лишена от хранителни вещества за нахлуващите бактерии (Abu Kwaik and Bumann, 2013). Постоянна война се провежда между гостоприемника и патогена. Всъщност вътреклетъчните патогени се опитват да лишат хранителните вещества от своя гостоприемник, докато клетката гостоприемник се опитва да лиши нахлуващите бактерии от хранителни вещества. Това явление обикновено се определя като „хранителен имунитет“ (Barel and Charbit, 2013).
Приема транспортери на аминокиселини
Участието на еукариотния глутаминов транспортер SLC1A5 е описано наскоро по време на инфекция с LVS на F. tularensis (Barel et al., 2012). F. tularensis LVS индуцира регулиране на този транспортер както на ниво мРНК, така и на протеин. Освен това, бактериалната инфекция предизвиква дегликозилиране на този аминокиселинен транспортер. Този процес на дегликозилиране се увеличава с времето на инфекцията и е свързан с увеличаването на експресията на SLC1A5. Мутантът IglC, който не излиза от фагозомата и не се мулиплицира в цитозола, не предизвиква това дегликозилиране. Следователно това дегликозилиране се предизвиква само от бактерии, които са в състояние да избегнат фагозомата и да се размножат в цитозола.
В същото време експресията на мРНК и протеин на SLC7A5 е регулирана надолу. SLC7A5 е партньор на SLC1A5, тъй като те работят заедно за уравновесяване на цитоплазмения аминокиселинен фонд (Fuchs and Bode, 2005) и особено на глутамина (Gln). Следователно диференциалният ефект на инфекцията с F. tularensis LVS върху експресията на SLC1A5/SLC7A5 може да предизвика повишаване на вътреклетъчната концентрация на глутамин. Това хранително вещество играе важна роля в регулирането на генната експресия, белтъчния оборот, антиоксидативната функция, хранителния метаболизъм, имунитета и киселинно-алкалния баланс. Остава да се проучи употребата на глутамин от човешки клетки за контролиране на инфекцията на Francisella. Установихме (Barel and Charbit, 2013), че добавянето на глутамин повишава способността на F. tularensis LVS да се размножава в цитозола на заразените THP-1 клетки. Въпреки че е класифициран като „несъществен“, глутаминът изглежда от съществено значение за жизнеспособността и растежа на клетките, поддържани в тъканната култура, като служи предимно като метаболитен предшественик в няколко биосинтетични пътища или директно за синтез на протеини (Neu et al., 1996). Установено е, че лишаването от глутамин, медиирано от Helicobacter bilis γ-глутамил-транспептидаза, е отговорно за индуцирането на възпалителни нарушения в епителните клетки (Javed et al., 2013).
За отбелязване е, че генът SLC1A5 се активира от инсулин чрез активиране на SGK1, SGK3 и PKB киназа, което стимулира абсорбцията на аминокиселини (Palmada et al., 2005). В добри отношения наистина открихме, че добавянето на инсулин също повишава вътреклетъчното размножаване на F. tularensis LVS (Barel et al., 2012). Глутаминът може да се превърне в глутамат, който от своя страна може да се използва или от бактериите, или от човешките клетки, за да осигури метаболитни предимства и да предотврати инфекцията на Francisella. Както беше обсъдено по-горе, е показано, че глутаматният транспортьор на Francisella (GadC) е критичен за защитата от оксидативен стрес във фагозомата (Ramond et al., 2014).
Дегликозилирането на SLC1A5 изглежда е общ механизъм, индуциран от инфекция с F. tularensis, тъй като се наблюдава и дегликозилиране на друг силно гликозилиран протеин (CD147). Следователно протеиновото дегликозилиране, предизвикано от вътреклетъчната Francisella, може да служи и като хранителен източник. Произведеният гликан може да служи в мрежи, регулиращи клетъчното участие, насочено към оцеляване на вътреклетъчните бактерии.
Автофагия
Наскоро беше показано, че използването на пътя на автофагията представлява друг механизъм на бактериална адаптация, допринасящ за оцеляването и храненето на вътреклетъчната Francisella (Steele et al., 2013). Интересното е, че Kawula и колега са установили, че вътреклетъчната F. tularensis subsp tularensis SCHU S4 разчита на ATG5-независима автофагия за размножаване. Снабдяването с излишък от пируват или аминокиселини потиска бактериалния дефект на растежа в клетките с дефицит на автофагия, което предполага пряка роля на този процес за доставяне на аминокиселина. Обаче вътреклетъчният растеж на F. tularensis subsp holarctica LVS изглежда е значително нарушен в ATG5 -/- макрофагите. Следователно е вероятно този подвид да използва както зависими от ATG5, така и независими от ATG5 процеси на автофагия, за да поддържа ефективен вътреклетъчен растеж. Като цяло тези данни показват, че вътреклетъчният F. tularensis от див тип обикновено избягва поглъщането от класически автофагозоми, но може да използва автофагия, за да подхрани цитозолната бактериална репликация с аминокиселина. Възможно е чрез този процес да се доставят други хранителни вещества на вътреклетъчните бактерии (като въглехидрати или липиди).
Тези два отговора на гостоприемника, задействани при инфекция, отразяват способността на вътреклетъчната Francisella да използва еукариотните машини за производство на аминокиселини и остатъци от гликани, които могат да служат за собственото му оцеляване.
Заключителни бележки
Ние показахме, че два носителя на Francisella, участващи в усвояването на аспарагин и глутамат, играят критична роля в бактериалния вътреклетъчен жизнен цикъл. Забележително е, че тези две аминокиселини са две несъществени аминокиселини, което означава, че прототрофията в бульона не предсказва непременно независимостта спрямо източника (ите) на приемните аминокиселини по време на инфекцията. Сравнението на прогнозираното използване на хранителни вещества и биосинтетичните пътища на поредица от патогени на бозайници подкрепя идеята, че повечето патогени споделят способността да използват едновременно множество източници на азот и въглерод (Abu Kwaik and Bumann, 2013; Steeb et al., 2013) Нашите текущи проучвания показват, че Francisella също разчита на няколко други източника на аминокиселини, получени от гостоприемника, за размножаване в заразените макрофаги (Gesbert et al., 2015, непубликувано).
Изявление за конфликт на интереси
Авторите декларират, че изследването е проведено при липса на каквито и да било търговски или финансови отношения, които биха могли да се тълкуват като потенциален конфликт на интереси.
Благодарности
Тези проучвания са подкрепени от INSERM, CNRS и Université Paris Descartes Paris Cité Sorbonne. Gael Gesbert беше финансиран от стипендия от „Délégation Générale à l'Armement“ (DGA), а Elodie Ramond от стипендия от „Région Ile de France“.
- Средиземноморската диета Ефекти върху протеините, които медиират метаболизма на мастните киселини в дебелото черво
- Алкалната диета, балансираща киселина и основа - Самоуправление на диабета
- Би ли вегетарианска диета повишила серумната ми пикочна киселина
- Съдържанието на докозахексаенова киселина в сученето и диетата за отбиване благоприятно модулира
- Какви са ползите от обогатяването на висши аминокиселини при диетата на свине и птици