Сунил Шарма
Отдел по белодробни, критични грижи и медицина на съня, Катедра по вътрешни болести, Медицинско училище Броуди, Грийнвил, 27834 NC, САЩ
Мани Кавуру
Отдел по белодробни, критични грижи и медицина на съня, Катедра по вътрешни болести, Медицинско училище Броуди, Грийнвил, 27834 NC, САЩ
Резюме
Сънят и неговите нарушения стават все по-важни в нашето общество, лишено от сън. Сънят е сложно свързан с различни хормонални и метаболитни процеси в тялото и е важен за поддържането на метаболитната хомеостаза. Изследванията показват, че лишаването от сън и нарушенията на съня могат да имат дълбоки метаболитни и сърдечно-съдови последици. Лишаването от сън, нарушеното сънно дишане и циркадното несъответствие се смятат, че причиняват метаболитна дисрегулация чрез безброй пътища, включващи симпатикова свръхстимулация, хормонален дисбаланс и субклинично възпаление. Тази статия прави преглед на съня и метаболизма и как лишаването от сън и нарушенията на съня могат да променят човешкия метаболизъм.
1. Въведение
Последствията от лишаването от сън и фрагментацията се признават все по-често. Ние сме общество, лишено от сън, с доказателства, които показват, че спим средно 6,8 часа, за разлика от 9 часа преди век. Около 30% от възрастните съобщават, че спят по-малко от 6 часа на нощ [1–3]. Денонощната икономика и последващото й въздействие върху моделите на съня може да са тестване на телесните граници за поддържане на метаболитно и хормонално равновесие. Разпространението на диабет и затлъстяване се е увеличило, за да придобие пандемични размери. Въпреки че други фактори като диетата и намалената физическа активност са допринесли за епидемията от затлъстяване, влиянието на нарушената регулация на съня върху причиняването на метаболитни нарушения е все по-широко признато. Като се има предвид, че само малък процент от хората могат да поддържат здравословно тегло за дълъг период от време само с диета и упражнения, въздействието на съня върху теглото отвори ново място за потенциална намеса.
Разбирането на тази тема е важно, тъй като както сънят, така и метаболитната дисрегулация са често срещани и нарастващи проблеми. Има много нерешени проблеми, включително причина и следствие, патогенеза и потенциални последици за терапията.
2. Метаболизъм при нормален сън
Човешкият сън се състои от сън с небързо движение на очите (NREM) и REM сън. NREM допълнително се състои от три етапа (етапи N1, N2 и N3). N3, наричан още бавен вълнен сън, се счита за дълбок сън, като тялото е най-малко метаболитно активно през този период. REM сънят се характеризира с живи сънища, загуба на мускулен тонус и бързи движения на очите. ЕЕГ моделът на REM сън наподобява отблизо този на будност, белязан от високочестотен и нисковолтов модел на вълната. NREM и REM сън се появяват алтернативно в цикли от около 90 минути през цялата нощ [4]. Първата половина на нощта е предимно NREM, а втората половина е предимно REM сън. Архитектурата на съня обаче е силно повлияна от генетични и екологични фактори, включително пол, раса, социално-икономически статус и култура. Продължителността на съня при бозайниците обикновено зависи от големината на животното [5]. Слоновете изискват само 3 часа сън, докато плъховете и котките могат да прекарат до 18 часа в сън. Предполага се, че това може да се дължи на различия в метаболизма. По-малките животни имат по-висока скорост на метаболизма и по-високи телесни и мозъчни температури в сравнение с по-големите животни.
Метаболизмът се определя като цялата гама от биохимични процеси, които протичат в живия организъм. Той представлява двата процеса на анаболизъм (изграждане) и катаболизъм (разрушаване). По-просто казано, метаболизмът е количеството енергия (калории), което тялото изгаря, за да се поддържа. Общият метаболизъм е свързан с увреждане на клетките поради освобождаването на свободни радикали [6]. По-ниската скорост на метаболизма и мозъчната температура, възникващи по време на сън без REM, изглежда дават възможност за справяне с щетите, нанесени по време на буден и метаболитно активен период. Siegel и неговата група от Калифорнийския университет в Лос Анджелис (UCLA) са показали увреждане на мозъка при лишени от сън плъхове [7]. Повечето налични и споменати в този преглед данни се отнасят до използването на глюкоза и енергийните разходи.
Смята се, че по време на нормален сън скоростта на метаболизма намалява с около 15% и достига минимум сутрин по стандартен циркаден модел [8, 9]. Само 15% намаление на метаболизма изглежда контраинтуитивно, като се има предвид продължителното състояние на физическо бездействие. Базовата скорост на метаболизма обаче представлява 80% от метаболизма, необходим за поддържане на всички клетъчни процеси в тялото. Употребата на глюкоза при нормални субекти е най-висока по време на будно състояние и най-ниска при NREM сън и междинна при REM сън [10].
Растежният хормон и кортизолът са два хормона, които оказват влияние върху регулирането на глюкозата. Растежният хормон обикновено се повишава при настъпване на съня с най-високи нива по време на бавен вълнен сън (SWS), докато нивата на кортизол се повишават значително през втората половина на съня, предимно при REM сън [11, 12]. Проучвания върху нормални субекти с постоянна инфузия на глюкоза по време на сън (за потискане на ендогенното производство на глюкоза) разкриват, че спадът в метаболизма на глюкозата в мозъка е допринесъл за спад от две трети в системното използване на глюкоза по време на сън, въпреки увеличаването на нивата на глюкоза и инсулин. Намаленият мускулен тонус и анти-инсулиноподобният ефект на скока на растежния хормон през първата половина на съня допринася за останалата част от падането на усвояването на глюкозата [13]. Следователно има относително състояние на инсулинова резистентност по време на ранните фази на съня.
По време на последната част от съня нивата на глюкоза и инсулин падат въпреки непрекъснатото вливане на глюкоза. Други проучвания показват подобни констатации, предполагащи повишено използване на глюкозата по време на REM фаза на съня и повишени нива на глюкоза вечер с намалена инсулинова чувствителност [13]. В допълнение, проучванията показват, че повишаването на нивата на кортизол вечер след само една нощ на недоспиване допринася за нарушаване на регулацията на глюкозата [14].
3. Последици от лишаването от сън
Въпреки че въздействието на съня върху регулирането на глюкозата е известно и проучвано от известно време, метаболитната дисрегулация със загуба на сън е разбрана едва наскоро. Предишни изследователски модели бяха фокусирани върху острото лишаване от сън. Изследвания, направени от Hampton et al. разкри, че когато субектите са направени да симулират работа на смени, това води до промени в метаболизма на глюкоза и липиди след хранене [15]. Този отговор беше отбелязан с 9-часово предварителен етап. По-късно същата група показа, че отнема най-малко 2 дни, за да се адаптира към яденето на храна на симулирана нощна смяна [16]. Тъй като тялото има добра способност за възстановяване, метаболитните нарушения, ако има такива, бяха лесно коригирани в модела на остра загуба на сън. По-практичният модел за изследване е повтарящо се продължително частично лишаване от сън, което отразява сценарии от реалния живот. Всъщност проучванията показват, че както бавният вълнен сън (SWS), така и растежният хормон (GH) се възстановяват след остра загуба на сън, но не се наблюдава подобен скок при SWS и GH по време на повтарящо се частично ограничаване на съня [17, 18]. Поради тези причини моделите на хронично лишаване от сън са по-подходящи от гледна точка на клиничното значение и предмет на нашия фокус.
Въпреки че предишно проучване показа намалена инсулинова чувствителност към перорално приложение на глюкоза, то беше ограничено до една нощ на лишаване от сън [19]. Първото подробно проучване за изследване на въздействието на частичното лишаване от сън върху глюкозния толеранс е извършено от Cauter et al. в Чикагския университет. Единадесет здрави млади мъже бяха подложени на 4 часа в леглото в продължение на 6 нощи, последвани от 12 часа в продължение на 7 нощи, за да се възстановят от дълга на съня. На шестия ден е направен интравенозен тест за глюкозен толеранс. Лишаването от сън води до намален глюкозен толеранс (скорост на глюкозен клирънс) с 40%. Ефективността на глюкозата, мярка за неинсулиново зависимо глюкозно изхвърляне, беше намалена с 30% заедно с намаляване на инсулиновия отговор на глюкозата [20]. Последващо проучване с рандомизиран дизайн на кросоувър от същата група потвърждава констатациите [21]. Заключението от тези лабораторни проучвания е, че една седмица лишаване от сън може да доведе до значителни промени в метаболитната и ендокринната функция.
Механизмът на недоспиване, причиняващ метаболитна дисрегулация, може да бъде многофакторен. Промените в профила на хормоналната секреция, както е обсъдено по-горе, могат да имат силен ефект върху регулирането на глюкозата [13].
Доказано е, че симпатиковата стимулация се проявява при недоспиване [22] и може да допринесе за метаболитната дисрегулация. Третият възможен механизъм е възпалението. Установено е, че експерименталното лишаване от сън променя имунния отговор и увеличава проинфламаторните маркери като IL-6, TNF-α и CRP [23-25].
4. Продължителност на съня и риск от диабет
Прогнозира се, че до 2010 г. 221 милиона души ще бъдат засегнати от диабет в световен мащаб [26]. Важно е да разберем ролята на съня в метаболизма на глюкозата и потенциалните насоки за нови изследвания и терапия.
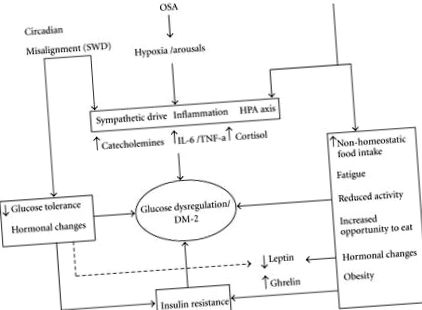
Смята се, че обструктивната сънна апнея може да причини метаболитна дисрегулация по няколко пътя. Известно е, че симпатиковият прилив се появява при всяко събитие на апнея. Доказано е, че симпатиковата активация повишава нивата на циркулиращите свободни мастни киселини поради стимулирането на липолизата, която насърчава инсулиновата резистентност [86]. Повишени нива на катехоламин са открити при хора с повече време за събуждане след настъпване на съня [108]. Освен това, фрагментацията на съня, повтарящата се хипоксемия и задействането на възпалителни цитокини всяка вечер може да допринесе за по-висока склонност към метаболитен синдром и диабет тип II. Относителният принос на някой от горните пътища не е известен. Някои от тези пътища могат да се припокриват с предложените патофизиологични пътища на лишаване от сън и циркадно несъответствие (Фигура 1).
Схематична диаграма на потенциалния механизъм на дисрегулация на глюкозата/патогенеза на диабета, вторичен след загуба на сън, сънна апнея и циркадно несъответствие. Трите основни нарушения на съня са изброени най-отгоре. Стрелките сочат към възможна патофизиологична промяна, която нарушенията могат да предизвикат. Някои от пътищата са общи за всички разстройства и са изброени заедно, тоест симпатикус, възпаление и промяна на оста на HPA. Загубата на сън в допълнение може да доведе до промени като хормонален дисбаланс и намалена активност (изброени в полето вдясно на диаграмата). По същия начин циркадните промени могат също да причинят инсулинова резистентност и хормонален дисбаланс (показан в полето вляво). Всички тези патофизиологични промени в крайна сметка могат да доведат до диабет тип II, който е показан в центъра. SWD: Разстройство на работа на смяна.
В обобщение, въпреки че има все повече доказателства за връзка между OSA и метаболитна дисрегулация, посоката на причинно-следствената връзка и отделянето на основния объркващ фактор на затлъстяването не е ясно посочена. Данните за интервенционните проучвания също са противоречиви и са помрачени от малки размери на извадката, неадекватна мощност и дизайн на наблюдение.
8. Метаболитни последици от разстройството на работа на смени
Механистичните пътища, по които работата на смени може да предизвика метаболитна дисрегулация, не са ясни, но изглежда включват хормонални промени и повишено симпатиково шофиране, водещи до намалена инсулинова чувствителност и недостатъчна компенсация на бета-клетките. Възможността за променен профил на мелатонин по време на циркадното несъвместимост е друг потенциален път, тъй като има някои доказателства, че мелатонинът може да инхибира индуцираното от глюкоза освобождаване на инсулин [120]. Освен това животински модели, подложени на циркадни промени, симулиращи работа на смени, са довели до преждевременна смърт [121].
В заключение, ограничените данни относно циркадното несъответствие предполагат неговата роля, макар и неясна, в метаболитната дисрегулация. Тъй като лишаването от сън е често свързано с разстройство на работа на смени, са необходими по-нататъшни проспективни проучвания, приспособяващи се към лишаване от сън, за да се установи ролята на циркадното несъответствие, за разлика от косвения ефект на лишаването от сън върху метаболитната дисрегулация.
9. Разход на енергия при сън и нарушения на съня
Няколко проучвания разглеждат връзката между енергийните разходи на тялото при сън и нарушения на съня (главно OSA). Изглежда, че енергийните разходи на човешкото тяло намаляват и са най-ниски по време на сън [122–125]. Това намаляване на енергийните разходи може да бъде повлияно от циркадния ритъм [122, 126], промените в телесната температура [127] и намаляването на мускулната активност [128, 129], да не говорим за дълбочината и продължителността на съня и физическата активност [8, 129–132]. Съобщава се също така, че енергийните разходи се различават в зависимост от етапа на съня [8, 133]. Изглежда, че расата също играе роля, тъй като афро-американците изглежда имат по-ниска скорост на метаболизъм на съня (SMR) и повишена склонност към наддаване на тегло в сравнение с кавказците [134]. Също така SMR намалява по време на сън като функция на BMI и скоростта на намаляване на SMR е по-голяма, тъй като BMI се увеличава [134].
Острата загуба на сън води до малко увеличение на SMR [122, 133, 134]. Подобно малко увеличение на SMR е регистрирано при хронично лишаване от сън [135].
Ограничени проучвания за разход на енергия при пациенти с обструктивна сънна апнея разкриват смесени резултати. Stenlof et al. установи по-висок общ енергиен разход (TEE) и SMR с намаляване на енергийните разходи при лечение с непрекъсната терапия с положително налягане (CPAP). Изследване на Lin et al. установено увеличение на SMR, но не и сутрешен BMR при пациенти с OSA. Пациентите в това проучване, които са били подложени на лазерно асистирана увулопалатопластика, показват намаляване на SMR. Въпреки това, Hins et al. не намери връзка между OSA и TEE или SMR. Подобни смесени резултати са отбелязани при деца [136–138].
В обобщение, енергийните разходи се намаляват по време на сън. Лишаването от сън изглежда увеличава енергийните разходи. Данните за въздействието на сънната апнея върху енергийните разходи са еднозначни. Проучванията при пациенти с OSA също са ограничени от малки размери и липса на данни за телесния състав, което значително влияе върху разхода на енергия. Също така е важно да се отбележи, че повечето от тези изследвания са използвали техника на индиректна калориметрия вместо златната стандартна метаболитна камера (директна калориметрия). Необходими са по-големи проучвания, използващи директни калориметрични техники, за да се разбере влиянието на сънната апнея върху разхода на енергия.
10. Заключения
Необходими са допълнителни проучвания, за да се изясни ясно ролята на пола, продължителността на съня и метаболизма с по-обективни измервания на съня. Също така трябва да се изясни разликата между лишаването от сън поради доброволна загуба на сън спрямо безсънието. Модел на пациенти, страдащи от безболезненост с OSA, може да помогне да се раздели влиянието на затлъстяването върху диабета. Съществуват разлики между реакцията на човека и животните при лишаване от сън по отношение на теглото. Механизмът, обясняващ сложното взаимодействие между съня и метаболизма, трябва да бъде допълнително проучен, ако се надяваме да извлечем повече клинични километри, като сънят стане важен инструмент за борба с пандемията със затлъстяването.
- Общ преглед Метаболизъм
- Преглед на нарушенията на метаболизма на пурин и пиримидин - Педиатрия - Ръководства на Merck Professional
- Преглед на липидния метаболизъм - ендокринни и метаболитни нарушения - Merck Manuals Professional
- Нарушение на пуриновия метаболизъм - общ преглед на ScienceDirect теми
- Оксалатен метаболизъм след чревни байпас операции Скандинавски вестник по гастроентерология Vol