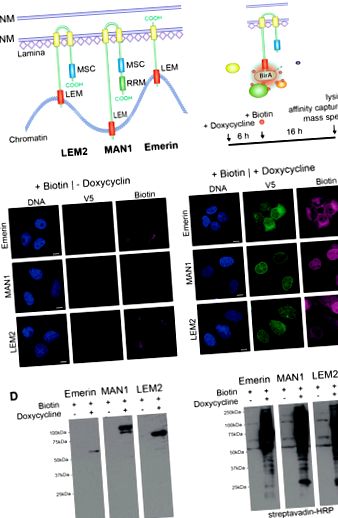
Експресия на BirA * -emerin-V5, BirA * -MAN1-V5 и BirA * -LEM2-B-V5 в U2OS клетки. (А) Схематична домейн организация на LEM2-, MAN1- и emerin. Жълт, трансмембранен домейн; син, MSC- (MAN1-SRC1p-C-терминал) домейн; червено, LEM-домейн; зелено, мотив за разпознаване на РНК (RRM). (B) Слитите протеини BirA * биотинилират протеини в непосредствена близост (10 nm). Карикатура и времеви курс, показващ подхода BioID. Клетките се инкубират със среда, съдържаща 1 ug/ml доксициклин, за да се индуцира експресия на слят протеин, 50 цМ биотин се добавя след 6 часа и се инкубира още 16 часа преди клетките да се лизират. (C) U2OS клетки, стабилно експресиращи индуцируеми от доксициклин конструкции BirA * -конфузионни конструкции бяха инкубирани без (-Doxycycline) или с (+ Doxycycline) доксициклин и биотин и обработени за имунофлуоресцентна микроскопия, използвайки антитела към V5 етикета и флуоресцентно маркиран стрептавидин (биофитин). ДНК се оцветява с DAPI. Лента, 10 µm. (D) Общи клетъчни лизати на инкубирани клетки бяха приготвени и анализирани чрез имуноблотинг, използвайки V5-антитяло и конюгиран стрептавидин от хрян (HRP). Линиите на фигура 1 D бяха на една и съща петна (вижте допълнителна фигура S1 за нередактиран имуноблот) и бяха генерирани с идентично време на експозиция.
BioID идентифицира общи и специфични взаимодействия за emerin, MAN1 и LAP2-Emerin-MAN1 (LEM2). Масспектрометричните набори от данни бяха анализирани с помощта на SAINT v. 2.5.0 [43, 44] въз основа на средна вероятност (AvgP) ≥ 0,45. (A) Диаграма на Venn, показваща припокриването на интерактоми. Цифрите показват идентифицирани взаимодействащи с висока степен на доверие. (B) Анализът на приликата между стръв и примамка разкрива по-голямо сходство между свързващите партньори на MAN1 и LEM2, отколкото сходството на тези протеини с емерин. (C) Анализ на обогатяване на генетичната онтология (GO), използвайки ENRICHR, като се има предвид промяна на сгъване ≥ 1 и p-стойност ≤ 0,05 [47]. ENRICHR идентифицира обогатени биологични процеси за всеки LEM протеин. Сините ленти представляват p-стойност (log10), а розовите точки показват обогатяване на GO термин. (D) Идентифицираните взаимодействия на emerin и MAN1 на посочените GO биологични процеси бяха допълнително групирани и анализирани с помощта на базата данни STRING. Цветът на запълване на възлите представлява AvgP, а ширината на линията представлява взаимодействието STRING.
Интерактомът LEM2 съдържа няколко протеина, участващи в възстановяването на ексцизията на нуклеотиди. (А) Идентифицираните високо доверителни взаимодействия на LEM2 на посочените GO процеси бяха допълнително групирани и анализирани с помощта на базата данни STRING. Цветът на запълване на възлите представлява AvgP, а ширината на линията - резултатът за взаимодействие STRING. (Б) Схематично представяне на пътя на възстановяване на ексцизия на нуклеотиди (NER). GG-NER, глобален геномен NER; TC-NER, транскрипция, свързана NER. Протеините, биотинилирани от BirA * -LEM2, са оцветени; протеините, които не се намират в LEM2 интерактома, са светлосиви.
Нокдаунът LEM2 влошава реакцията на увреждане на ДНК след облъчване с UV-C. Жизнеспособността на U2OS на клетките беше достъпна след нокдаун на emerin, MAN1, LEM2 или DDB1 чрез RNA интерференция. Разбърканата РНК (Sc) се използва като отрицателна контрола. (А) Имунофлуоресцентни анализи на U2OS клетки 48 часа след трансфекция с посочени siRNAs, оцветени за ДНК (синьо), LEM2 (червено) и емерин (зелено). Лента, 10 µm. (Б) Имуноблот анализ на целоклетъчни лизати 48 часа след трансфекция с посочени siRNAs, използвайки антитела, както е посочено отгоре. γ-тубулинът служи за контрол на натоварването. (C) Емерин-MAN1-, LEM2- и DDB1-изчерпани клетки или клетки, третирани с кодирана РНК, са оставени необработени (контрол) или облъчени с сублетална доза UV-C (5 J/m 2) (+ UV) и клетка пролиферацията се анализира за 96 h постирадиация. (D) Стълбовидна графика, представяща номера на клетки в 96-часова времева точка. Статистическият анализ беше извършен с използване на двупосочно ANOVA и множествено сравнение на Tukey, n = 8, *, p-стойности: '*' за pppp E) Целите клетъчни лизати бяха анализирани чрез имуноблотинг преди и 48 часа след UV лечение, като се използват антитела към фосфорилиране H2AX (γH2AX). Петното на Ponceau S служи за контрол на натоварването. (F) Количествено определяне на имуноблот. Графиката представлява увеличаване на пъти на γH2AX след UV лечение, нормализирано до общия протеин.
Резюме
Експресия на BirA * -emerin-V5, BirA * -MAN1-V5 и BirA * -LEM2-B-V5 в U2OS клетки. (А) Схематична домейн организация на LEM2-, MAN1- и emerin. Жълт, трансмембранен домейн; син, MSC- (MAN1-SRC1p-C-терминал) домейн; червено, LEM-домейн; зелено, мотив за разпознаване на РНК (RRM). (B) Слитите протеини BirA * биотинилират протеини в непосредствена близост (10 nm). Карикатура и времеви курс, показващ подхода BioID. Клетките се инкубират със среда, съдържаща 1 ug/ml доксициклин, за да се индуцира експресия на слят протеин, 50 цМ биотин се добавя след 6 часа и се инкубира още 16 часа преди клетките да се лизират. (C) U2OS клетки, стабилно експресиращи индуцируеми от доксициклин конструкции BirA * -конфузионни конструкции бяха инкубирани без (-Doxycycline) или с (+ Doxycycline) доксициклин и биотин и обработени за имунофлуоресцентна микроскопия, използвайки антитела към V5 етикета и флуоресцентно маркиран стрептавидин (биофитин). ДНК се оцветява с DAPI. Лента, 10 µm. (D) Общи клетъчни лизати на инкубирани клетки бяха приготвени и анализирани чрез имуноблотинг, използвайки V5-антитяло и конюгиран стрептавидин от хрян (HRP). Линиите на фигура 1 D бяха на една и съща петна (вижте допълнителна фигура S1 за нередактиран имуноблот) и бяха генерирани с идентично време на експозиция.
BioID идентифицира общи и специфични взаимодействия за emerin, MAN1 и LAP2-Emerin-MAN1 (LEM2). Масовите спектрометрични набори от данни бяха анализирани с помощта на SAINT v. 2.5.0 [43, 44] въз основа на средна вероятност (AvgP) ≥ 0,45. (A) Диаграма на Venn, показваща припокриването на взаимодействащите. Цифрите показват идентифицирани взаимодействащи с висока степен на доверие. (B) Анализът на сходството между стръв и примамка разкрива по-голямо сходство между свързващите партньори на MAN1 и LEM2, отколкото сходството на тези протеини с емерин. (C) Анализ на обогатяване на генетичната онтология (GO), използвайки ENRICHR, като се има предвид промяна на сгъване ≥ 1 и p-стойност ≤ 0,05 [47]. ENRICHR идентифицира обогатени биологични процеси за всеки LEM протеин. Сините ленти представляват p-стойност (log10), а розовите точки показват GO термин обогатяване. (D) Идентифицираните взаимодействия на emerin и MAN1 на посочените GO биологични процеси бяха допълнително групирани и анализирани с помощта на базата данни STRING. Цветът на запълване на възлите представлява AvgP, а ширината на линията представлява взаимодействието STRING.
LEM2 интерактомът съдържа няколко протеина, участващи в възстановяването на ексцизия на нуклеотиди. (А) Идентифицираните високо доверителни взаимодействия на LEM2 на посочените GO процеси бяха допълнително групирани и анализирани с помощта на базата данни STRING. Цветът на запълване на възлите представлява AvgP, а ширината на линията - резултатът за взаимодействие STRING. (Б) Схематично представяне на пътя на възстановяване на ексцизия на нуклеотиди (NER). GG-NER, глобален геномен NER; TC-NER, транскрипция, свързана NER. Протеините, биотинилирани от BirA * -LEM2, са оцветени; протеините, които не се намират в LEM2 интерактома, са светлосиви.
Нокдаунът LEM2 влошава реакцията на увреждане на ДНК след облъчване с UV-C. Жизнеспособността на U2OS на клетките беше достъпна след нокдаун на emerin, MAN1, LEM2 или DDB1 чрез RNA интерференция. Разбърканата РНК (Sc) се използва като отрицателна контрола. (А) Имунофлуоресцентни анализи на U2OS клетки 48 часа след трансфекция с посочени siRNAs, оцветени за ДНК (синьо), LEM2 (червено) и емерин (зелено). Лента, 10 µm. (Б) Имуноблот анализ на целоклетъчни лизати 48 часа след трансфекция с посочени siRNAs, използвайки антитела, както е посочено отгоре. γ-тубулинът служи за контрол на натоварването. (C) Емерин-MAN1-, LEM2- и DDB1-изчерпани клетки или клетки, третирани с кодирана РНК, са оставени необработени (контрол) или облъчени с сублетална доза UV-C (5 J/m 2) (+ UV) и клетка пролиферацията се анализира за 96 h постирадиация. (D) Стълбовидна графика, представяща номера на клетки в 96-часова времева точка. Статистическият анализ беше извършен с използване на двупосочно ANOVA и множествено сравнение на Tukey, n = 8, *, p-стойности: '*' за pppp E) Целите клетъчни лизати бяха анализирани чрез имуноблотинг преди и 48 часа след UV лечение, като се използват антитела към фосфорилиране H2AX (γH2AX). Петното на Ponceau S служи за контрол на натоварването. (F) Количествено определяне на имуноблот. Графиката представлява увеличаване на пъти на γH2AX след UV лечение, нормализирано до общия протеин.
- Клетки Безплатни пълнотекстови механизми на зависима от възрастта загуба на диетични ограничителни защитни ефекти в
- Безплатни пълноценни секс разлики в клетките в черния дроб, мастната тъкан и мускулната транскрипция
- Безплатен пълен текст на клетките Сайтът за репликация на РНК на Tula Orthohantavirus се намира в рамките на реконструиран
- Клетъчен безплатен вписване на Ca2, предизвикан от ангиотензин-II в миши сърдечни фибробласти, не зависи
- Пълнотекстов химически състав на храни от месо от диви елена лопатар (Дама Дама) от Южна Африка A