Аладжи Бах
От Катедрата по биохимия и молекулярна биофизика, Медицинско училище във Вашингтонския университет, Сейнт Луис, Мисури 63110
Кристофър Дж. Карел
От Катедрата по биохимия и молекулярна биофизика, Медицинско училище във Вашингтонския университет, Сейнт Луис, Мисури 63110
Жиуей Чен
От Катедрата по биохимия и молекулярна биофизика, Медицинско училище във Вашингтонския университет, Сейнт Луис, Мисури 63110
Прафул С. Ганди
От Катедрата по биохимия и молекулярна биофизика, Медицинско училище във Вашингтонския университет, Сейнт Луис, Мисури 63110
Енрико Ди Сера
От Катедрата по биохимия и молекулярна биофизика, Медицинско училище във Вашингтонския университет, Сейнт Луис, Мисури 63110
Резюме
Предишни проучвания показват, че заличаването на девет остатъка в веригата за автолиза на тромбина води до мутант с антикоагулантна склонност от потенциално клинично значение, но молекулният произход на ефекта остава неразрешен. Рентгеновата кристална структура на този мутант, решена в свободна форма при разделителна способност 1,55 Å, разкрива неактивна конформация, която е практически идентична (средно квадратично отклонение от 0,154 Å) на наскоро идентифицираната форма E *. Страничната верига на Trp 215 се срутва в активното място, като се измества> 10 Å от позицията му в активната Е форма, и дупката на оксианиона се нарушава от обръщане на пептидната връзка Glu 192 – Gly 193. Това откритие потвърждава съществуването на неактивната форма Е * в по същество същото въплъщение, както е идентифицирано за първи път в структурата на тромбиновия мутант D102N. В допълнение, това показва, че антикоагулантният профил, често причинен от мутация на тромбиновото скеле, намира своя вероятен молекулярен произход в стабилизирането на неактивната Е * форма, която селективно се измества към активната Е форма при свързване на тромбомодулин и протеин С.
Сериновите протеази от семейството на трипсините са отговорни за храносмилането, коагулацията на кръвта, фибринолизата, развитието, оплождането, апоптозата и имунитета (1). Активирането на протеазата изисква преход от зимогенна форма (2) и образуване на йонна двойка между новообразувания аминокрайник на каталитичната верига и страничната верига на силно запазения остатък Asp 194 (химотрипсиногеново номериране) до каталитичния Ser 195. Това осигурява достъп на субстрата до активното място и правилно образуване на оксианионната дупка, допринесена от гръбначния N атоми на Ser 195 и Gly 193 (3). Превръщането на зимоген → протеаза е класически свързано с началото на каталитичната активност (3, 4) и осигурява полезна парадигма за разбиране на ключовите характеристики на протеазната функция и регулиране.
МАСА 1
Кристалографски данни за тромбиновия мутант Δ146–149e (код на протеинова банка 3GIC)
| Събиране на данни | |
| Дължина на вълната | 0.9 Å |
| Космическа група | P43 |
| Размер на единичната клетка | a = b = 58,23, c = 119,56 A |
| Молекули/асиметрична единица | 1 |
| Диапазон на разделителната способност | 40,0–1,55 Å |
| Наблюдения | 220 618 |
| Уникални наблюдения | 54 240 |
| Пълнота | 94,3% (76,1%) |
| Rsym (%) | 3,7% (27,9%) |
| I/σ (I) | 27,7 (2,3) |
| Усъвършенстване | |
| Резолюция | 40,0–1,55 Å |
| | F |/σ (| F |) | > 0 |
| Rcryst, Rfree | 0,188, 0,224 |
| Отражения (работещи/тест) | 51 479/2747 |
| Протеинови атоми | 2295 |
| Молекули на разтворител | 257 |
| r.m.s.d. дължини на връзките a | 0,012 Å |
| r.m.s.d. ъгли a | 1,4 ° |
| r.m.s.d. ΔB (Å2) (mm/ms/ss) b | 0,86/0,67/2,21 |
| 〉B〉 протеин | 18,6 Å 2 |
| 〈B〉 разтворител | 28,6 А2 |
| Парцел Рамачандран | |
| Най-облагодетелствани | 98,3% |
| Щедро разрешено | 1,3% |
| Забранено | 0,4% |
a Средноквадратични отклонения от идеалните дължини и ъгли на връзката и r.m.s.d. са показани стойности в В-фактори на свързани атоми.
b mm означава основна верига-основна верига; ms показва основната верига от страната на веригата; и ss показва странична верига страна верига.
РЕЗУЛТАТИ
Веднъж генериран в кръвта от неговия неактивен предшественик протромбин, тромбинът действа като прокоагулант, когато превръща фибриногена в неразтворим фибринов съсирек (45) и действа като протромботик, когато разцепва протеазно-активираните рецептори (PAR) (46, 47). Въпреки това, при взаимодействие с ендотелните клетъчни рецепторни тромбомодулин, тромбинът губи както прокоагулантни, така и протромботични функции и увеличава своята активност> 1000 пъти спрямо антикоагулантния протеин С (48). Тромбинов мутант, стабилизиран във формата Е *, би имал малка или никаква активност спрямо физиологични субстрати. Ако този мутант може да се превърне в Е форма след свързване на тромбомодулин, тогава селективен антикоагулант отговор ще се предизвика при активиране на протеин С в съдовия ендотел, където присъства тромбомодулин.
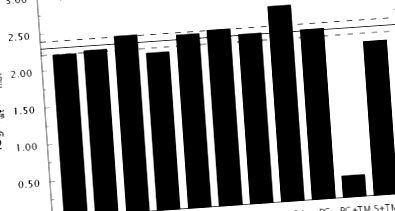
Доказателството, че тромбиновият мутант Δ146–149e е стабилизиран във формата Е * в разтвор, идва от проверка на стойностите на kcat/Km за хромогенни и естествени субстрати. Данните на фиг. 1 разкриват забележително сходство в загубата на активност спрямо фибриноген, PAR1, PAR3 и протеин С за мутант Δ146–149e в сравнение с див тип. По същия начин се наблюдава сравнима загуба на активност спрямо няколко хромогенни субстрата, носещи заместители в позициите P1 или P2 (54). Средно загубата е около 200 пъти. За мутация, която селективно измества равновесието E * -E в полза на E *, без да се въвеждат допълнителни ефекти върху разпознаването на субстрата или инхибитора, стойностите на s и K в уравнения 1-2 трябва да намалят със същото количество. По-конкретно, съотношението, показано в уравнение 3 между дивия тип (WT) и мутантните стойности на s и K, трябва да бъде еднакво за всички субстрати и инхибитори.
Данните на фиг. 1 са в съответствие с прогнозата от уравнение 3. Възмущаването на разпознаването на PAR4 е значително по-изразено в сравнение с всички други субстрати, но това е в съответствие с директните взаимодействия, които този субстрат прави с остатъци от веригата за автолиза (55) . Допълнителна подкрепа за стабилизиране на Е * в мутанта Δ146–149e идва от калориметрични измервания на свързването на инхибитора аргатробан (39) с активното място. Стойността на K (вж. Уравнение 2) пада 135 пъти в мутанта в сравнение с див тип (фиг. 2), както се очаква от уравнение 3.
Свързване на аргатробан с тромбинов див тип (вляво) и Δ146–149e (вдясно), измерено чрез изотермична титрационна калориметрия. Горният панел показва обмена на топлина при всяко отделно титруване за тромбиновата проба (долна следа) и контрола на бургана на аргатробана (горната следа). Долният панел е интегрирането на данните, за да се получи общата топлина, обменяна като функция от моларното съотношение лиганд/протеин. Експерименталните условия са 5 m m Tris, 0,1% полиетилен гликол, 145 m m NaCl, pH 7,4, 37 ° C. Концентрациите на ензимите и аргатробана са както следва: 13,44 и 140 μ m (тромбинов див тип); 52,5 и 777 μ m (Δ146–149e). Кривите на титруване бяха подходящи, използвайки софтуера Origin на iTC200, със стойности на най-добри параметри, както следва: див тип тромбин, K = 1,0 ± 0,1 10 8 m -1, ΔG = −11,3 ± 0,1 kcal/mol, ΔH = −15,2 ± 0,1 kcal/mol и TΔS = -3,9 ± 0,1 kcal/mol; Δ146–149e, K = 7,4 ± 0,4 10 5 m -1, ΔG = −8,3 ± 0,1 kcal/mol, ΔH = −13,8 ± 0,1 kcal/mol и TΔS = −5,5 ± 0,1 kcal/mol. Стойността на стехиометричната константа N е 1,01 ± 0,01 за тромбинов див тип и Δ146–149e мутант.
Добавянето на тромбомодулин възстановява активността на мутанта към протеин С (фиг. 1), което показва, че въпреки че мутацията стабилизира Е *, активната форма Е все още присъства в разтвор и може да бъде попълнена за активиране на протеин С в присъствието на кофактор. Доказателства, че свързването с екзозит I, основният тромбинов епитоп за разпознаване на тромбомодулин (56, 57), може да преобразува Е * в Е, е предоставено наскоро от структурата на тромбиновия мутант D102N, свързан с фрагмент от тромбоцитния рецептор PAR1 (6) . Следователно, тромбиновият мутант Δ146–149e вероятно функционира като алостеричен превключвател, стабилизиран в неактивна форма Е *, докато комбинираното свързване на тромбомодулин и протеин С измести Е * към Е и възстанови активността.
Лентово представяне на структурата на тромбиновия мутант Δ146–149e (злато), покрито със структурата на тромбина в Е конформацията (35) (циан). Новообразуваната пептидна връзка между Lys 145 и Gly 150 е обозначена в червено в съкратената верига за автолиза на Δ146–149e (виж също Фигура 4), а веригата в конформацията Е не се вижда между остатъците Trp 148 и Lys 149e. 215–217 β-веригата в мутанта се срива в първичния джоб за специфичност (червени отворени върхове на стрелки), като страничната верига на Trp 215 (модел на стик) е разположена в активното място (остатъци от каталитичната триада His 57, Asp 102, и Ser 195, показани като модели на пръчки) в хидрофобно взаимодействие с Trp 60d, Tyr 60a, Leu 99 и His 57. Това представлява драстична промяна (r.m.s.d. 0,384 Å) от конформацията на E, където страничната верига на Trp 215 е разположена на 10,5 Å и оставя активното място достъпно за субстрата. Конформацията на Δ146–149e е забележително подобна (r.m.s.d. 0,154 Å) на тази на E *, определена наскоро (6, 7).
Отляво са показани подробности за колапса на Trp 215 в активното място и разрушаването на оксианионната дупка в тромбиновия мутант Δ146–149e (CPK, жълто). Конформацията на същите остатъци във формата Е е показана чрез сравнение (CPK, циан). Пептидната връзка между Glu 192 и Gly 193 се преобръща в мутанта Δ146–149e (червена отворена глава на стрелката), както се вижда във формата E * (6, 7, 9), причинявайки разрушаване на оксианионната дупка, допринесена от N атомите на Gly 193 и Ser 195. Картата на електронната плътност 2Fo - Fc (зелена мрежа) е контурирана на 2.0σ. Вдясно, заличаването на остатъци 146 ETWTANVGK 149e в веригата за автолиза на мутанта Δ146–149e води до нова връзка на пептидна връзка между Lys 145 и Gly 150 (CPK, жълто). Примката за автолиза рядко се вижда изцяло в тромбиновите структури и значително разстройство остава в мутанта Δ146–149e, където последователността 144 LKGQ 151 трябва да бъде контурирана на 0,5σ в картата на електронната плътност 2Fo - Fc (зелена мрежа).
ДИСКУСИЯ
Новата парадигма, получена от анализ на скорошни кристални структури на трипсиноподобни протеази (6, 7, 15-23), подкрепя съществуването на E * -E равновесие като критична характеристика на трипсиновата гънка (9). Това алостерично равновесие обяснява няколко важни аспекта на биологията на протеазата. За протеази, които са слабо активни до взаимодействие с кофактор, както се наблюдава при някои фактори на съсирването и комплемента (29), началото на каталитичната активност може да се отдаде на преобразуването E * → E. Формата Е * действа в този случай като състояние на покой за ензима и пружинен механизъм, който може да се включи, когато се изисква от биологичния контекст. Равновесието E * -E също предоставя контекст за интерпретиране на ефекта от мутации, свързани със загуба на биологична активност при силно активни протеази. В някои случаи, както е документирано от тромбин (8, 58), молекулярният произход на ефекта е неясен, тъй като мутацията не засяга остатъците при директен контакт със субстрата. Стабилизирането на E * чрез молекулярни канали, които не са задължително включени в разпознаването на субстрата, може да предложи правдоподобно обяснение.
* Тази работа е подкрепена, изцяло или частично, от Националните институти по здравни помощи HL49413, HL58141 и HL73813 (на E. D. C.).
- Видове мускулна дистрофия и причини за всяка форма
- Респираторна ацидоза при юноши с нервна анорексия, хоспитализирани за медицинска стабилизация a
- Вече близо 100 паунда, шофьорът се насочва към социалните медии, за да стимулира целта за отслабване
- Тейлър Суифт за 30 неща, които е научила преди 30-ия си рожден ден - Тейлър Суифт навършва 30 години
- Подпомага процесите на отделяне на мазнини в тялото ✅ Lean Form 24 Reviews 💊 - TheCGBros