Резюме
Цели/хипотеза
По време на патогенезата на диабет тип 2 инсулиновата резистентност причинява компенсаторна пролиферация на бета клетки. Тъй като бета клетките имат ограничен репликационен потенциал, тази компенсаторна пролиферация може да ускори клетъчното стареене и да доведе до диабет. Изследвахме клетъчното стареене на бета клетки след пролиферация по време на липоглюкотоксичност.
Методи
Маркерите, свързани със стареенето, в бета клетки са изследвани при индуцирани от хранителни вещества диабетни мишки C57BL/6J, които са били хранени с диета с високо съдържание на мазнини. След 4 и 12 месеца диета с високо съдържание на мазнини бяха проведени интраперитонеални тестове за толерантност към глюкоза (IPGTT) и хистохимични анализи на Ki-67, p38, свързана със стареенето бета-галактозидаза и бета клетъчна маса.
Резултати
На 4 месеца AUC за плазмените нива на инсулин по време на IPGTT (AUCinsulin) е по-висока, масата на бета клетките е 3,1 пъти по-голяма, а пролиферацията на бета клетки е 2,2 пъти по-висока, отколкото в контролната група. Въпреки това, на 12 месеца AUCinsulin намалява, честотата на Ki-67-позитивни бета-клетки намалява до една трета от тази на контролната група, а свързаната със стареенето, бета-галактозидаза-положителна зона се увеличава до 4,7-кратна от тази на контролна група. Нещо повече, малки количества p38, който се индуцира от оксидативен стрес и медиира клетъчното стареене, са открити в бета клетките от групата с високо съдържание на мазнини, но не и в бета клетките от контролната група. Освен това, свързаната със стареенето, бета-галактозидаза-позитивна област в групата с високо съдържание на мазнини има силно значима отрицателна корелация с AUCinsulin (r= -0,852, стр
Въведение
Дефектната секреция на инсулин при захарен диабет тип 2 се причинява от дисфункция на бета-клетките и намалена маса на бета-клетки. Бета-клетъчната дисфункция се причинява от хронична хипергликемия и/или хиперлипидемия, съответно наричани глюкотоксичност и липотоксичност, които по-рано бяха разгледани подробно [1–3].
Дългосрочната регулация на бета-клетъчната маса се определя от баланса на растежа на бета-клетките, включително репликация и неогенеза, и загубата на бета-клетки чрез апоптоза, некроза и стареене [4–7]. Намалената маса на бета-клетки се наблюдава при хора с диабет тип 2 и животински модели на диабет тип 2 [6–12]. Хроничната хипергликемия води до прогресивна загуба на бета-клетъчна маса с продължително нарастване на скоростта на апоптоза на бета-клетките без компенсаторно увеличаване на растежа на бета-клетките. В допълнение към некрозата, значително повишената апоптоза на бета клетки се счита за един от основните фактори в патогенезата на диабета. Клетъчните механизми на повишената апоптоза на бета клетки, които включват индуциран от хипергликемия оксидативен стрес [8, 12], се изучават усилено [13–18].
Материали и методи
Животни
Шестседмични мъжки мишки C57BL/6J са закупени от Clea Japan (Токио, Япония). Контролната група е хранена с нормална диета (AIN-93; 14% протеин, 72% въглехидрати, 4% мазнини) [27], със свободен достъп до вода. Диетичната група с високо съдържание на мазнини получи свободен достъп до диета с високо съдържание на мазнини, при която телешкият лой замества 36% от въглехидратите в нормалната диета (диета с високо съдържание на мазнини: 14% протеини, 36% въглехидрати, 40% мазнини). Мишките бяха настанени в контролирана от температурата стая с 12-часов цикъл светлина-тъмнина. Всички експерименти са одобрени от Комитета по етика на животните към Университета по хранене в Кагава и са в съответствие с „Принципите на лабораторните грижи за животните“ (NIH публикация № 85-23, преработена 1985 г.).
Анализ на кръвта и тестове за толерантност към глюкоза
За интраперитонеалния тест за толеранс към глюкоза (IPGTT), мишките гладуват в продължение на 12 часа и кръвта се взема от опашната вена на 0, 30, 60 и 120 минути след i.p. инжектиране на глюкоза (2 g/kg телесно тегло). За измерване на плазмените липиди се събира кръв от вената на опашката преди i.p. инжектиране на глюкоза. Плазмената глюкоза, NEFA, триглицеридите и общият холестерол се измерват с търговски комплекти (Wako Pure Chemical Industries, Осака, Япония). Плазменият инсулин се измерва, като се използва система за имуноанализ на ензимен инсулин на плъх (Amersham Biosciences, Piscataway, NJ, USA). Във всеки момент от време, кръвни проби (приблизително 70 μl) се вземат в една капилярна тръба, с изключение на кръвните проби, взети в точката на време 0 (приблизително 100 μl в 1,5 капилярни тръби). Поради малкото телесно тегло на мишките, необходимият обем на кръвта за микроанализи е само 2 μl, с изключение на инсулиновите анализи (20 μl). Правилото за трапец се използва за определяне на AUC за концентрациите на глюкоза и инсулин при всяко животно. Инсулиногенният индекс се изчислява чрез разделяне на AUC за плазмените нива на инсулин по време на IPGTT (AUCinsulin) на AUC за плазмените нива на глюкоза по време на IPGTT (AUCglucose) (0–30 минути).
Изолиране на островчета и изследване на островчета
Островчета бяха изолирани от панкреаса чрез разграждане на колагеназа и събрани под микроскоп след 4 и 12 месеца диета с високо съдържание на мазнини. Островчетата се култивират в продължение на 12 часа в среда RPMI 1640, съдържаща 11,1 mmol/l глюкоза, 10% топлинно инактивиран фетален говежди серум, 100 IU/ml пеницилин и 100 μg/ml стрептомицин, както беше описано по-горе [28, 29]. След това съответстващите по размер островчета бяха предварително инкубирани за 60 минути при 37 ° С с KRB, съдържащ 0.2% BSA и 2.8 mmol/l глюкоза. След предварителна инкубация, 10 островчета се стимулират с KRB при посочената концентрация на глюкоза за 1 h при 37 ° С. Веднага след това супернатантата се събира и съхранява при -80 ° С до инсулиновия анализ. След това островчетата се измиват с PBS три пъти и се хомогенизират с киселинен етанол (0,18 mol/l HCl в 95% етанол), за да се определи съдържанието на инсулин.
Имунохистохимичен анализ
Морфология на панкреатичните островчета
За морфометричен анализ на бета-клетъчната маса, три секции на всеки панкреас бяха систематично покрити чрез улавяне на изображения от непокриващи се полета с цифров фотоапарат (Nikon 950; Nikon, Токио, Япония). Зоната на островчето и участъкът бяха анализирани с помощта на софтуера NIH Image 1.63, както беше описано по-рано [30]. Процентът на площта на бета-клетките в района на островчето се изчислява чрез разделяне на площта на всички инсулино-положителни клетки на областта на островчето и чрез умножаване по 100. Масата на островчето се изчислява чрез умножаване на теглото на панкреаса по процента на островчета на панкреас. Бета-клетъчната маса се изчислява чрез умножаване на островната маса по процента на бета-клетките на островче. За да се оцени относителната скорост на бета-клетъчна неогенеза от клетки на екзокринните канали, ние определихме количествено процента на клетките на екзокринните канали, които са имунореактивни за инсулин, както беше описано по-рано [31]. Получените данни бяха изразени като процент на каналчевите клетки, които бяха положителни за инсулин във всеки панкреас, и средното беше изчислено за всяка група.
Пролиферация на бета клетки
Репликацията на бета-клетки на островче беше изчислена чрез сравняване на инсулиновите и Ki-67 петна и осредняване на броя на Ki-67-положителните бета-клетки от приблизително 80 островчета на мишка.
Откриване на клетъчно стареене
Клетъчното стареене се оценява чрез имунохистохимия с клетъчен маркер за стареене фосфо-p38 и чрез оцветяване, свързано със стареенето бета-галактозидаза (SA бета-гал). Честотата на стареене на бета клетки, определена чрез имунохистохимия, се изчислява, като се използва методът, описан за репликация на клетки. Откриването на SA бета-гал беше извършено, както е описано по-рано [32] с незначителни модификации. След 12 месеца от експерименталния период, панкреасите се фиксират за 3 часа в 4% параформалдехид при 4 ° C, поставят се за една нощ в PBS (pH 7,2), съдържащ 30% захароза при 4 ° C, вградени в Tissue-Tek OCT съединение (Miles, Elkhart, IN, USA), замразен и разделен на резени с дебелина 8 μm от хладилен микротом. SA beta-gal е открит чрез комплект за откриване на стареене (BioVision, Mountain View, CA, USA) и е оцветен с Kernechtrot. За всеки панкреас изображенията на островчета в две секции, разделени с 200 μm, бяха заснети с цифров фотоапарат (Nikon). Бета-гал-положителната зона на SA в островчетата и зоната на островчетата бяха анализирани с помощта на софтуера NIH Image 1.63, както беше описано по-рано [30]. Процентът на SA бета-гал-положителна площ се изчислява чрез разделяне на SA бета-гал-положителната площ в островчетата на островната площ и умножаване по 100.
Откриване на апоптоза
За да се открие апоптоза, три участъка (3 μm), разделени на 200 μm, бяха оцветени чрез терминалния деоксинуклеотидил трансфераза-медииран dUTP nick-end метод за маркиране (TUNEL), използвайки in situ комплект за откриване на апоптоза (Wako Pure Chemical Industries, Japan). DAB се използва като субстратен хромоген. Честотата на апоптозата на панкреатичните островни клетки, която се изразява като събития на островче, се изчислява чрез осредняване на броя на TUNEL-положителните бета-клетки в приблизително 60 островчета от всеки панкреас.
Статистически анализ
Всички анализи на данни бяха проведени с помощта на StatView 5.0 (SAS Institute, Cary, NC, USA). Данните са показани като средната стойност ± SEM. Извършен е корелационен анализ между клетъчното стареене и клетъчната пролиферация, AUCglucose, AUCinsulin, инсулиногенен индекс или p38 митоген-активирана протеин киназа (MAPK). Значимостта на коефициентите на корелация е анализирана от Fisher’s z-трансформация. Статистически анализ на останалите данни е извършен с Mann-Whitney U-тест. Обмислихме стр стойности под 0,05 да бъдат статистически значими.
Резултати
Телесно тегло, кръвни анализи и тестове за глюкозен толеранс
Телесно тегло, плазмена глюкоза, инсулин, NEFA, триглицериди и общ холестерол, измерени след 4 и 12 месеца от диетата, са показани в Таблица 1. Телесното тегло е значително по-високо в групата с високо съдържание на мазнини, отколкото в контролната група след 4 и 12 месеца от диетата (стр Таблица 1 Телесно тегло, плазмени триглицериди, NEFA, общ холестерол, глюкоза и нива на инсулин на мишки C57BL/6J преди и след 4 и 12 месеца диета с високо съдържание на мазнини
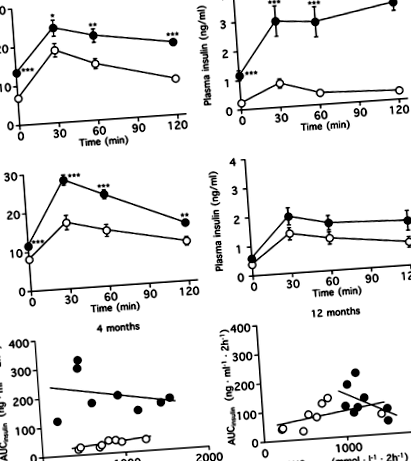
IPGTTs бяха извършени след 4 и 12 месеца от диетата и оценени чрез AUCglucose, AUCinsulin и инсулиногенен индекс (Фиг. 1, Таблица 2). На 4 месеца плазмените нива на глюкоза и инсулин бяха значително по-високи в групата с високо съдържание на мазнини, отколкото в контролната група. AUCinsulin в групата с високо съдържание на мазнини е била увеличена до 6,6 пъти тази на контролната група (стр Фиг. 1
Островни проучвания
След 4 и 12 месеца от диетите, отделянето на инсулин се стимулира с глюкоза в експериментите със статична инкубация и се измерва съдържанието на инсулин в островчетата (фиг. 2). В диетичната група с високо съдържание на мазнини след 4 месеца нивата на освобождаване на инсулин, индуцирани от 16,7 и 33,4 mmol/l глюкоза (съответно 2,02 ± 0,10 и 2,82 ± 0,21 ng островче - 1 h -1; стр −1 h −1, съответно). Въпреки това, на 12 месеца, нивата на освобождаване на инсулин в групата с високо съдържание на мазнини, стимулирана с 16,7 и 33,4 mmol/l глюкоза (съответно 0,76 ± 0,13 и 1,13 ± 0,25 ng островче - 1 h -1), са почти същите като тези в контролната група (0,91 ± 0,10 и 1,35 ± 0,08 ng островче - -1 h -1, съответно). По същия начин, в сравнение с контролната група, съдържанието на инсулин в островчетата от групата с високо съдържание на мазнини е значително увеличено след 4 месеца (съответно 58,0 ± 5,17 и 36,1 ± 0,73 ng/островче), стр Фиг. 2
Бета клетъчна маса и пролиферация
Морфометрични анализи на бета клетъчна маса и пролиферация се извършват чрез имунохистохимичен анализ на 4 и 12 месеца. След 4 месеца площта на островчетата в панкреасите на групата с високо съдържание на мазнини е била 2,2 пъти по-голяма от тази в контролната група, а относителното разпределение на бета-клетките в островчетата е леко, но значително увеличено в сравнение с това в контролата група (стр Таблица 3 Морфометричен анализ на панкреаса на мишки C57BL/6J след 4 и 12 месеца диета с високо съдържание на мазнини
Двойно оцветяване на протеин Ki-67 (кафяв) и инсулин (бледо червено) в островчета от парафинови секции от мишки C57BL/6J след 4 и 12 месеца контролна диета (а, ° С) и диета с високо съдържание на мазнини (б, д). SA бета-гал оцветяване в островчета от замразени секции от мишки C57BL/6J след 12 месеца контролна диета (д) и диета с високо съдържание на мазнини (е). Оцветени с инсулин, свързани с канал бета клетки от мишки C57BL/6J след 4 (ж) и 12 (з) месеци диета с високо съдържание на мазнини. Оригинално увеличение × 300 (лента= 40 μm)
На 4 месеца пролиферацията на бета-клетки (оценена по честотата на Ki-67-положителни бета-клетки/островче) в групата с високо съдържание на мазнини е била 2,2 пъти по-висока от тази на контролната група, за да компенсира повишеното търсене на инсулин (стр Фиг. 4
Бенеклетъчно стареене и апоптоза
Клетъчното стареене и апоптоза в островчетата се оценяват след 12 месеца диета с високо съдържание на мазнини (фиг. 5). Процентът на SA бета-гал-положителна площ в островчетата от групата с високо съдържание на мазнини е бил 4,7 пъти този на контролната група (съответно 12,4 ± 3,7% и 2,4 ± 0,4% от островната зона), стр Фиг. 5
Корелация между клетъчното стареене и пролиферация, AUCglucose, AUCinsulin, инсулиногенен индекс и p38 MAPK
Както е показано на фиг. 6, процентът на SA бета-гал-положителна площ е в значителна корелация с Ki-67-позитивни бета клетки и AUCglucose (r= -0,864, стр Фиг. 6
Дискусия
Маркерите за клетъчно стареене в бета клетки са били увеличени при мишки, хранени с диета с високо съдържание на мазнини. Преди стареенето на бета клетките се наблюдава повишена пролиферация при хипергликемични условия. Имаше силно отрицателна корелация между клетъчната пролиферация и стареенето. Тези открития показват, че клетъчното стареене настъпва след бърза пролиферация на бета клетки и причинява намалена клетъчна пролиферация и бета клетъчна маса.
Намалената маса на бета-клетките на панкреаса е основен фактор в патогенезата на диабет тип 2, както и дисфункцията на бета-клетките. Дългосрочната регулация на бета-клетъчната маса зависи от баланса на снабдяването с бета-клетки от репликацията и неогенезата и смъртта на бета-клетките главно от апоптозата [4–7]. За да се адаптира към хипергликемия по време на патогенезата на диабет тип 2, увеличената пролиферация на бета-клетки причинява компенсаторно увеличение на масата на бета-клетките. Нарушаването на адекватно увеличение на бета клетъчната маса води до диабет тип 2 [6–12]. След продължителна диета с високо съдържание на мазнини, пролиферацията на бета клетки значително намалява и се наблюдава клетъчно стареене на островчета. Не успяхме да извършим оцветяване с бета-галактозидаза на островчетата от 4-месечни мишки. Ако обаче стареенето спре разпространението, тогава некрозата и апоптозата, които следват, ще намалят островната маса. Клетъчното делене и клетъчната смърт са независими събития, както в случая с невроните, но бета клетките са уязвими на липоглюкотоксичност и масата на островчетата може да намалее чрез апоптоза. Намалената хипертрофия може също да допринесе за намаляване на масата на островчетата. За да се прецени от тези открития, стареенето на бета клетки причинява намалена маса на бета клетки и може да доведе до диабет тип 2.
В заключение, намалената пролиферация на бета клетки и клетъчното стареене се установяват при диабетни мишки тип 2, предизвикани от диета. Клетъчното стареене може да бъде причинено от компенсаторната бърза пролиферация на бета клетки, необходима за поддържане на адекватна маса на бета клетки и/или натрупване на ROS в бета клетки. Бета-клетъчното стареене води до недостатъчно освобождаване на инсулин като последица от намалената маса на бета-клетките и допринася за патогенезата на диабет-индуциран диабет.
- Забележка Принос на взаимодействието на HN-рецептор на човешкия вирус на грип тип 3 към патогенезата
- Добавката на метформин подобрява наддаването на тегло, намалява нуждите от инсулин при диабет тип 1
- Насърчаване на начина на живот и промяна в поведението при деца и юноши с наднормено тегло с диабет тип 2
- Метформин увеличава риска от умерена анемия при диабет тип 2
- Метформин за профилактика на забавяне на захарен диабет тип 2 (T2DM) и свързаните с него усложнения при