Муджиб Улах
Катедра по физиология, BMSB, Медицински колеж, Университет на Оклахома Център за здравни науки (OUHSC), 940 Stanton L. Young Blvd, Oklahoma City, OK 73126-0901 USA
Zhongjie Sun
Катедра по физиология, BMSB, Медицински колеж, Университет на Оклахома Център за здравни науки (OUHSC), 940 Stanton L. Young Blvd, Oklahoma City, OK 73126-0901 USA
Свързани данни
Резюме
Заден план
Стареенето е неизбежен, но разширяем процес [1]. Стареенето обединява няколко болести за опустошителни последици върху човешкото общество и претоварва цялата здравна система и икономика [1, 2]. Артрит, сърдечно-съдови заболявания, рак, деменция, остеопороза, диабет, хипертония, дегенерация на тъкани, невропатия, инсулт, затлъстяване и депресия са примери за индуцирани от възрастта заболявания [1, 2]. Стареенето е жизненоважен спусък на болестите и разширява техните шокове, за да повлияе на зрението, слуха, мускулната сила, костната маса, имунитета, нервната функция и метаболитните нарушения [3]. Стареенето е пряка заплаха за самия живот и също така създава огромни предизвикателства пред цялата система, като по този начин се налага спешна нужда от справяне с тези здравословни проблеми.
Стареене и стволови клетки
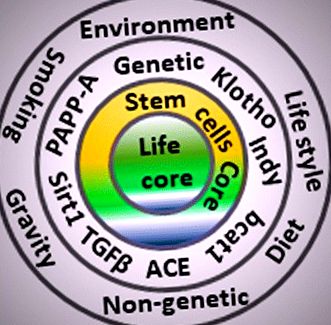
Фактори, засягащи ядрото на живота. Различните кръгове представляват различните категории фактори, отговорни за влиянието върху стареенето и дълголетието. Външният кръг се състои от околна среда, начин на живот, гравитация, химикали, лекарства, географски региони и фактори, свързани с диетата. Вторият кръг е представител на генетични и жизненоважни гени като Klotho и аз не съм мъртъв (Indy). Третото ядро показва, че подмладяващите стволови клетки са много близо за обновяване на увредените клетки за сърцевината на живота. Всички кръгове в крайна сметка натрупват бремето от щети, мутации, болести и дегенерация върху централното ядро на живота (стареене). ACE ангиотензин-конвертиращ ензим, PAPP-A, свързан с бременността плазмен протеин-A, TGFβ трансформиращ растежен фактор бета и Sirtuin 1 (Sirt1)
Фактори, допринасящи за стареенето. Фактори, влияещи върху процеса на стареене: стресови фактори от околната среда, диетични, генетични, негенетични, хормонални и епигенетични
Бозайниците, особено хората, частично подмладяват своите болни или липсващи части, като използват стволови клетки. По същия начин хематопоетичните стволови клетки непрекъснато поддържат популацията си, за да обновят кръвните клетки [11]. Използването на стволови клетки при стареене цели да разбере техните механизми и как регенеративният капацитет на стволовите клетки може да бъде подобрен за насърчаване на здравословния живот [11, 12]. Според една теория стволовите клетки от костния мозък преминават в тъкан и се превръщат в клетки на тази тъкан [13]. Стареенето е баланс между ентропия (стареене или бавно разграждане на тъканите) и възстановяване (стволови клетки). Ако силата на ентропията е по-голяма от способностите за възстановяване на стволовите клетки, това ще доведе до стареене [13]. Стволовите клетки заместват увредените клетки всеки ден, но степента на увреждане при стареене е по-голяма от капацитета на стволовите клетки [12]. Как стволовите клетки и гените против стареене участват в процеса на удължаване на живота, изисква допълнително проучване. Тук описваме тези фактори на стареене, начините, по които те взаимодействат и как тези взаимодействия намаляват здравето на стволовите клетки с течение на времето. По-доброто разбиране на тези промени ще доведе до разкриване на загадъчни загадки (фиг. 1 и и 2 2).
Фактор на стареене и против стареене Klotho
Стареещи и допринасящи фактори
Стареенето и дълголетието се определят от сложна комбинация от генетични, негенетични и фактори на околната среда [21]. От генетична страна Klotho и други гени са доказани като полезни за удължаване на живота и при животински модели, където е доказано, че едногенните мутации, свързани с недостатъчна експресия, драстично намаляват продължителността на живота на мишките [2, 20, 22, 23]. Тези гени са полезни потенциални цели за интервенции на стареенето, които вероятно биха могли да свършат същата работа в дълголетието на човека.
От гледна точка на околната среда е доказано, че диетата (по-специално ограничаването на калориите) оказва съществено влияние върху продължителността на живота, включително забавяне или профилактика на много заболявания, свързани със стареенето [21, 24]. Диетичните ограничения насърчават дълголетието при много видове и забавят стареенето на генетично ниво чрез стабилизиране на активността на теломеразата [21, 25]. Ефектите от ограничаването на калориите противодействат на ефектите от окисляването, възпалението, детоксикацията, активността на теломеразата и намаляването на стреса и увреждането на гените [12, 25, 26]. Мишките, хранени с по-нисък прием на калории, показват намаляване на честотата на свързаните с възрастта заболявания [21, 25]. По-нататъшното проучване на диетата и ограничаването на калориите при стареене и теломераза може да помогне за разкриването на нови лечения против стареене.
Сред много фактори, които влияят върху процеса на стареене, излагането на околната среда е един от основните модифицируеми рискови фактори [24]. Експозицията на околната среда, замърсителите и химикалите влияят заедно на стареенето, което често води до развитие на някои заболявания в по-ранна от очакваната възраст. Това е дълъг списък, не само ограничен до различни токсини, замърсители, гравитация и климатични промени, но разширен и до личния начин на живот под формата на пушене, пиене, стрес, социална тежест и депресия [21, 24]. Генетичните фактори и факторите на околната среда влошават процеса на стареене, вероятно поради натрупани щети през целия живот [27]. Регенеративната сила на стволовите клетки обаче ограничава процеса на стареене [11], но изчерпването на стволовите клетки се случва с увеличаване на възрастта [2, 12]. Нещо повече, когато стволовите клетки се делят, теломерите им се скъсяват и клетките спират да се делят и умират [2, 28]. Теломеразата предотвратява този спад в стволовите клетки чрез удължаване на теломерите, но в процеса на стареене се съобщава за намалена активност на този ензим [28, 29]. Когато мишките са проектирани така, че теломеразата да им липсва напълно, теломерите им постепенно се съкращават и животните остаряват много по-бързо от нормалните мишки [25, 28].
Стареене и сигнални пътища
Различните стволови клетки имат различни регенеративни способности. Като пример, хематопоетичните стволови клетки имат най-високата степен на възстановяване, за да обновяват непрекъснато клетките в основния кръвен поток. По същия начин ембрионалните, плюрипотентните и мезенхимните стволови клетки (MSC) са свързани с възстановяването на тъканите [3]. Предполага се, че стволовите клетки отделят някакъв вид объркващи вещества против стареене. Ако можем да ги идентифицираме, намерихме протеин против стареене за удължаване на живота.
Стареене и генетика
MSC са насочени към специфична тъкан, тъй като те изискват правилната комбинация от сигнални молекули от увредената тъкан и съответните рецептори [12]. Използвайки тактика за сигнализиране, MSC е демонстрирано да реагира на различни ситуации и дори в някои случаи да пребивава в увредени тъкани [12].
Откъде MSC знаят кога да отговорят, къде да отидат, как да общуват, защо да останат на местоназначението и какво да правят там и как да преценят съдбата си дали е необходимо или не? За да разберем по-добре това, трябва да разгадаем сложната мрежа от стимулиращи сигнали. Тези стимулиращи сигнали могат да бъдат от произход като цитокини или/и растежни фактори. Всъщност стволовите клетки използват комуникативния език на цитокините и растежните фактори по време на регенеративния процес [41]. Подобно на аварийната сирена, увредените тъкани отделят цитокини и растежни фактори, за да привлекат стволови клетки и да ги използват по такъв начин, че да насърчават заздравяването и регенерацията [41]. Например, богатата на протеини плазма помага на стволовите клетки да увеличат популацията си както по количество, така и по функция. Секрецията на FGF2 и VEGF (растежни фактори) е добре документирана за насочване на стволови клетки към наранени участъци от тялото [26, 41]. Те също така стимулират образуването на кръвоносни съдове, като привличат стволови клетки [42]. Костният морфогенетичен протеин има способността да отклонява клетъчния трафик на стволови клетки към образуването на кости. Фибробластният растежен фактор укрепва пролиферативния потенциал на стволовите клетки да се справят с спешни нужди по време на регенерация и възстановяване [26, 42].
Като първи реагиращи, стволовите клетки мигрират до мястото на увреждане и координират спасителната операция [42]. Стволовите клетки се превръщат в регенериращата част на остатъчната тъкан, но в противен случай лечебните ефекти се дължат на техните секреторни цитокини и растежни фактори в отговор на нараняването. Освен това стволовите клетки комуникират с местните тъкани и насочват резервните си клетки и медиатори да координират и контролират стъпките на увреждане и възстановяване [41, 42]. Мечът на стареенето обаче с времето отрязва тази невероятна репаративна способност на стволовите клетки. Както можем да видим, има забележителна сила на регенерация в детството, но темпът на регенерация намалява с прогресивно стареене [3]. С течение на живота броят на стволовите клетки намалява драстично и дава разумно обяснение защо лечебният капацитет намалява с остаряването.
Език на стареенето
Стволовите клетки и факторите, удължаващи живота, вероятно използват езика на цитокини, растежни фактори, възпалителни сигнали и други медиатори за комуникация между увредената тъкан и спасителния екип от стволови клетки и други лечебни клетки [26]. Тази комуникация не се ограничава една до друга и с други клетки, но също така се разпростира върху съседните клетки и тъкани и дори цялото тяло [41]. MSC са добре известни, че модифицират продукцията си на цитокини въз основа на това, което е необходимо, къде е необходимо, по кое време е необходимо, в кое количество е необходимо, как да неутрализира възпалението и как да регулира противовъзпалението в отговор на ефективно комуникация [26, 41]. Тази комуникационна система обаче отслабва с увеличаване на възрастта и допълнително ускорява процеса на стареене. На практика разбирането и насочването на такива комуникационни линии може да бъде по-добър избор за бъдещи терапии за остаряване.
Стареене и козметика
Освен болестите и дълголетието, биологията на остаряването ще революционизира цялата козметична индустрия, като обнови и отгледа нова здрава кожа [43, 44]. Във всяка възраст здравата кожа се възприема като по-млада и естетически по-привлекателна от нездравата. Отново може да не сме по-млади, но можем да изглеждаме по-млади. С увеличаване на възрастта количеството и функцията на стволовите клетки намаляват драстично и е обяснение защо лечебният капацитет намалява през целия живот [3, 43, 44]. При стареене обаче броят на MSC избледнява в костния мозък, което е една от основните причини за стареенето [3, 44]. Като алтернатива, ако в тялото присъстват повече стволови клетки, има повече на разположение за мигриране към увредените области и за възстановяването им чрез секреция на растежни фактори, което може да бъде мощен нов клас активни съставки за кожни терапевтици. Те трябва да могат да насърчават ефикасно и без излекуване на белези. Събирането на растежните фактори би било полезно в борбата срещу увредената кожа. За отстраняване на белези можем да използваме примера на макрофаги, които достигат целевата зона и почистват щети и отломки [45].
Заключение
Остаряването е световно бедствие, което не оставя завинаги нищо в младежко състояние, но в бъдеще може да се забави за известно време, като се използват най-новите научни открития. Тези открития биха въвели най-новите технологии за контрол и препрограмиране на гените и стволовите клетки, участващи в стареенето. Възстановяването на младежката генна експресия би позволило на клетките да станат по-млади. Възстановяването на младежката генна експресия може да помогне да върнете часовника на стареенето и потенциално да удължите здравословния живот. Отговорните фактори могат да бъдат от генетичен, негенетичен и екологичен произход [2, 27]. От генетична страна това може да включва модулиране на експресията на Klotho, AMPK, циклин А2, FGF21, FOXN1, GDF11, октомври, PGC-1, TGF-β1, аполипопротеин A-1 и още не съм мъртъв (INDY), гените, отговорни за удължаването на живота [38–40].
От страна на околната среда, храните, хранителните вещества, витамините и лекарствата ни правят по-здрави, вероятно защото те индуцират експресията на гени, които насърчават здравето и намаляват експресията на гени, стимулиращи заболяването [21, 24, 46]. И обратно, консумацията на токсични вещества, включително химикали, дим, наркотици и алкохол, прави обратното.
Регенеративните терапии концентрират фокуса си върху стволовите клетки и други фактори, удължаващи живота, и търсят внимание към обратното стареене. Независимо от това, потенциалът на стволовите клетки да бъдат използвани като терапевтичен товар оказа дълбоко влияние върху визията за бъдещето на регенеративната медицина. Възрастните тъкани имат ограничен резервоар на стволови клетки, намалена популация и ниска ефективност на обновяване [11, 30]. Всичко това са факторите, допринасящи за клетъчното стареене, апоптоза, автофагия и оксидативен стрес, които накрая се натрупват и водят до стареене [27, 47, 48].
Терапиите против стареене са нова нововъзникваща ера на науката, която изглежда е от полза за обществото, използвайки силата на стволовите клетки, цитокините и факторите за растеж, регенерация и удължаване на живота. Бъдещите научни открития ще разгадаят тези пъзели на застаряващата биология. Вероятно такива удължаващи живота фактори мобилизират ендогенните стволови клетки или обновяват или увеличават техния брой и функции [1]. Регенеративните терапии и екзогенната трансплантация на стволови клетки в увредени тъкани също ще подобрят износването на стареенето.
Уроците от биологията на рака може да са жизненоважни за потушаването на историческия стремеж към безсмъртие [29, 49]. Изглежда, че както ракът, така и стареенето споделят антагонистични черти и инхибирането на едното може да причини активирането на другото. Клетъчното стареене, апоптоза, съкращаване на теломерите и други механизми, които ни предпазват от рак, могат да ускорят стареенето [49, 50]. По подобен начин дълголетието изисква неопределена клетъчна пролиферация, която може да предизвика рак [45]. Независимо от това, стареенето и ракът са тясно взаимосвързани и изглежда имат общи биологични характеристики. Сега е ясно, че както ракът, така и остарелите клетки показват увреждане на ДНК, геномна нестабилност и мутации [29, 49]. Как раковите клетки подхранват стареенето или как стареенето подхранва рака? Жертвите ли са както ракът, така и застаряването или виновникът за дерегулация на стволовите клетки? Отговорите могат да прокарат още една крачка напред в разбирането на биологията на остаряването. Прилагането на терапия със стволови клетки за забавяне на процеса на стареене чрез подобряване на лечението от болести е по-ясно, но удължаването на човешкия живот изглежда изглежда по-отдалечено. Докато животинските модели са добре проучени за удължаване на живота [15], такъв превод от животно в човек е по-голямо предизвикателство.
Остаряването не се дължи само на местно износване. Това е процес (кумулативен процес на щети) и процесът може да бъде контролиран по значителен начин. Стволовите клетки са отличен кандидат за регенеративна медицина; обаче е важно да се разбере, че тези чудотворни клетки наистина могат да бъдат бъдещето на медицината за масовите клетъчни терапии на стареенето. Науката за остаряването е в зародиш, но явно води до времето, когато учените ще разработят генно инженерство и терапии със стволови клетки, които ще ни позволят да обърнем остаряването и да ни помогнат да станем по-млади и по-здрави.
Благодарности
Авторите са благодарни за съдействието на Националния здравен институт (NIH) за финансиране и преподаватели, работещи в Катедрата по физиология, особено д-р Шърли Уанг и Линдзи Бергер, здравен научен център на Университета в Оклахома. Тази работа не би могла да се свърши без тях. Авторите искат да благодарят и на експерти, работещи в Центъра за биомедицински изследвания към Университета в Оклахома.
Финансиране
Тази работа беше подкрепена от Националния здравен институт (NIH), САЩ чрез номера на безвъзмездни средства R01 HL118558, DK093403, HL122166, HL116863 и AG049780 (към ZS).
- Стволовите клетки остават „млади“ в Центъра за рак на без мазнини с диета
- Супермодел Карол Алт; s Най-суровите истини - удължаване на живота
- Преглед на удължаване на живота Super R липоева киселина трик
- Роля на бифидобактериите в дългосрочното здраве - удължаване на живота
- Skinnygirl Cocktails Recipe Classic Margarita - Tips on Life and Love