1 отдел по хирургия на дебелото черво и ректума, Медицински център на Бет Израел за дяконеса, Медицинско училище в Харвард, Бостън, 330 Brookline Avenue, Stoneman 9, Бостън, Масачузетс 02215, САЩ
Резюме
Лъчевият проктит е известно усложнение след лъчева терапия за злокачествено заболяване на таза. Повечето случаи се лекуват нехирургично и разбирането на наличните условия е от решаващо значение при лечението на тези пациенти. В тази статия ние се фокусираме върху съвременното лечение на лъчевия проктит.
1. Въведение
Радиацията причинява както апоптоза, така и клетъчна смърт, вторично увреждане на ДНК, протеини и липиди и обикновено засяга бързо пролифериращи клетки като тези, открити при рак [1]. Днес облъчването на таза е важна съставка при лечението на злокачествени заболявания на малкия таз и се прилага или като неоадювантна, или като адювантна терапия. Първоначално се смяташе, че лъчетерапията (RT) не дава полза за пациентите, особено пациентите с рак на ректума, поради резистентността на тези видове рак към радиация. Едва по-късно беше открито, че са необходими по-високи дози за преодоляване на тази резистентност. Въпреки това, по-високите дози радиация са довели до съпътстващо увреждане на органи в или около полето на радиация. В момента най-честото усложнение на лъчетерапията, вторично след използването на по-високи дози, е проктитът след лечение на рак на простатата [2].
Брахитерапията има два метода на доставка, които се опитват да постигнат същата цел - локално излагане на прицелната тъкан. Най-често срещаният подход налага имплантирането на радиоактивни пелети (обикновено йод 125 или паладий 103) в прицелната тъкан с постепенно освобождаване с течение на времето [6]. Алтернативен метод включва използването на кухи катетри, които могат постепенно да се пълнят с нарастващи количества радиоактивни пелети с течение на времето. Брахитерапията намалява увреждането на експозицията на околната тъкан въз основа на внимателно позициониране на имплантираните пелети [6]. Честотата на колоректалните усложнения при брахитерапия обикновено е по-ниска в сравнение с външното лъчево лъчение. Изследване на Lesperance et al. показват намаление както за остри (6% срещу 43%), така и за хронични (2% срещу 21%) усложнения с брахитерапия в сравнение с външно лъчево лъчение [7, 8].
Радиационният проктит обикновено се класифицира като остър или хроничен, обикновено очертан от времевата рамка на симптомите по отношение на лечението, както и от наличните симптоми и признаци.
2. Остър проктит
Острият радиационен проктит се определя като възпалителен процес, включващ само повърхностната лигавица [2], който се случва почти непосредствено след започване на терапията или до 3 месеца след началото на терапията [16]. Симптоми, включително диария, гадене, спазми, тенезми, спешност, отделяне на слуз и незначително кървене ще се развият при до 20% от пациентите, което налага прекъсване на лечението [17]. Най-общо, радиационният проктит е възпалителен процес на ректалната лигавица, който изглежда едематозен, плътно червен и може да има язви или замърсявания. Микроскопски има загуба или изкривяване на архитектурата на микровилите с хиперемия, оток и улцерация [2]. Колоноскопската биопсия на възпалителната ректална лигавица обикновено не се препоръчва поради повишения риск от кървене и образуване на фистула. Острият лъчевен проктит не увеличава риска от хроничен лъчевен проктит [2] и обикновено се самоограничава с прекратяването на лъчетерапията.
3. Хроничен проктит
Времевата рамка на хроничния радиационен проктит може да започне рано, дори по време на острата фаза на радиационния проктит, но симптомите могат да станат очевидни едва месеци до години по-късно след спиране от терапията (медиана 8–12 месеца след завършване на терапията) [2]. Симптомите на хроничния проктит могат да включват тези на остър радиационен проктит, но освен това могат да включват тежко кървене, стриктури, перфорация, фистула и запушване на червата. Патологичният процес се различава от острата фаза и в крайна сметка включва компрометиране на кръвоснабдяването на ректалната стена, което води до исхемия с пълна дебелина и фиброзни промени [2]. Най-общо червата са бледи, несъвместими с телеангиектазии и могат да имат стриктури, улцерации, фистули или обилно кървене [18]. Микроскопски има фокално изкривяване и унищожаване на малки артерии и артериоли с интимна фиброза [18]. Хроничният радиационен проктит има значително по-голям ефект върху качеството на живот на хората, засегнати от това усложнение, в сравнение с пациентите с остър проктит [2].
Докато лечението и проследяването на ХИВ се подобри до степен, в която сега може да се счита за хронично състояние, редица злокачествени заболявания, свързани с ХИВ/СПИН, се увеличават. Някои от тези злокачествени заболявания включват рак на маточната шийка, анален рак и лимфоми, като всички те могат да изискват лъчева терапия, която може да засегне ректума. Има редица доклади, които предполагат по-висок процент на усложнения при пациенти със СПИН след лъчева терапия. Етиологията е неясна, но се предполага, че системният дефицит на глутатион, наблюдаван при пациенти с ХИВ, води до изчерпване на радиозащитните тиоли и повишено окислително увреждане. За ХИВ позитивни пациенти с анален рак и брой CD4 под 200, Hoffman et al. [22] съобщава за повишена токсичност (кървене и мукозит) и намален толеранс, като по този начин се предполага необходимостта от по-ниски дози на лечение. Други проучвания предполагат подобен профил на токсичност [23] и не препоръчват промяна в дозата на лечение. Понастоящем няма докладвани убедителни данни за радиационен проктит при пациенти с ХИВ/СПИН и рак на простатата.
4. Диагностика
Радиационен проктит трябва да се подозира при всеки пациент, който е бил изложен на тазова радиация и се проявява със симптомите, споменати по-горе. По-голямата част се диагностицират след колоноскопия или сигмоидоскопия с характеристики, демонстриращи бледност, ронливост и телеангиектазии. Обикновено трябва да се изключат други причини като инфекция или възпалително заболяване на червата. Фистулизиращо заболяване, включително ректовагинални, ректуретрални и ректовезикуларни фистули, може да закъснее и да представи симптоми на радиационен проктит, но обикновено ще бъде предшествано от други симптоми.
5. Превантивни мерки
Въпреки че модификациите на радиационните техники и дози непрекъснато се изучават, за да се намали честотата на радиационния проктит, опитите за разследване на превантивните методи досега са разочароващи. Малки двойно-слепи рандомизирани контролни проучвания не показват разлика в честотата или тежестта на хроничния радиационен проктит при използване на ректално (200 μg) мизопростол и орален (3 gm два пъти дневно) или ректален (3 gm дневно) сукралфат [24–27]. Амифостин, прилаган интравенозно (340 mg/m 2 дневно), показва някои обещания в малки проучвания за предотвратяване на симптоми на остър проктит, както и за намаляване на тежестта на симптомите на хроничен проктит. Периодът на проследяване обаче беше сравнително кратък [28–30]. Като цяло превантивните мерки не са допринесли значително за намаляване на честотата на радиационния проктит.
6. Лечения
6.1. Остър проктит
Докато острият проктит се самоограничава, до 20% от пациентите, подложени на външно лъчево лъчение, ще изискват кратки прекъсвания в лечението си, за да подобрят симптомите. Поддържащото медицинско лечение обикновено е единственото необходимо лечение и включва хидратация, антидиарейни средства и евентуално стероидни или 5-аминосалицилатни клизми. Прекратяването на терапията обикновено е окончателното лечение и рядко са необходими хирургични интервенции.
6.2. Хроничен проктит
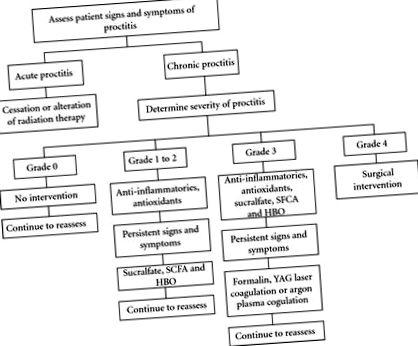
Управлението на хроничния проктит може да бъде разделено на неинвазивно лечение (противовъзпалителни средства, сукралфат, късоверижни мастни киселини, хипербарични, антиоксиданти) и инвазивно лечение (аблация и хирургия). Въпреки че има значителни различия в стратегиите за управление на хроничния проктит, обикновено има стратегия за използване на най-малко инвазивните интервенции първо с постепенно прогресиране, тъй като симптомите и признаците се влошават (Фигура 1).
6.3. Неинвазивни лечения
Неинвазивната терапия за хроничен радиационен проктит започва с използването на орални, ректални или газообразни средства. Тези средства се състоят от нестероидни противовъзпалителни лекарства, сукралфат, късоверижни мастни киселини (SCFA), хипербарен кислород (HBO) и антиоксиданти.
6.3.1. Противовъзпалителни средства
По-ново противовъзпалително средство на основата на хлорит, което съдържа активната съставка OXO-K993 и се прилага интравенозно, WF10, наскоро беше проучено за лечение на радиационно индуктиран проктит. Първоначално е разработен като допълнителна терапия за СПИН и се използва в комбинация с антиретровирусни и опортюнистични схеми за профилактика на инфекции [2]. Смята се, че механизмът му на действие е чрез модулация на клетъчно-медиираната имунна система чрез стимулиране на фагоцитозата и понижаване на представянето на антигена за намаляване на имунната активация [38]. Използва се за индуциран от радиация цистит, проктит и мукозит само в Европа. Предварителните проучвания показват, че контролът на симптомите на кървене в продължение на години (средно време за проследяване 55 месеца) е получен след две дози (0,5 ml/kg телесно тегло на ден); поддържането на ефективни резултати е постигнато с повторно лечение 1-2 пъти годишно [38]. Това противовъзпалително средство не е одобрено от FDA за употреба в Съединените щати.
6.3.2. Сукралфат
Постоянните симптоми след лечение с противовъзпалителни средства като 5-ASA за повече от пет месеца изискват лечение със сукралфат или пентозан полисулфат (PPS). Сукралфатът е силно сулфиран полианионен дизахарид (комплекс от сулфатирана захароза и алуминиев хидроксид) [39], за който се смята, че стимулира заздравяването на епитела и образуването на защитна бариера [40]. Няколко доклада, включително рандомизирано плацебо контролирано проучване, показват ползи както за клиничните, така и за лигавичните резултати с ректален сукралфат (2 g b.i.d.) [15]. Доказано е също, че ректалният сукралфат (3 gm) превъзхожда противовъзпалителните схеми при лечение на радиационен проктит [41] и може да доведе до облекчаване на симптомите при 75% от пациентите [21]. Смята се, че пентозан полисулфатът (PPS, синтетично производно на гликозаминогликан, който присъства в повърхността на пикочния мехур, съдовете и лигавицата на стомашно-чревния тракт) намалява епителната пропускливост и предотвратява прилепването подобно на сукралфат [42].
6.3.3. SCFA
Късоверижните мастни киселини (SCFA) са основното окислително гориво на лигавицата на дебелото черво и служат също за стимулиране на пролиферацията на лигавицата на дебелото черво [43]. Смята се, че те се произвеждат от анаеробните бактерии на дебелото черво от неабсорбирани въглехидрати. Най-значимият продукт на SCFA е маслената киселина [44]. SCFA също оказва съдоразширяващ ефект върху стените на артериолата, за да подобри притока на кръв [45]. Индуцираното от радиация увреждане води до исхемия и загуба на архитектурата на микровилите, което може да доведе до влошаване на абсорбцията на SCFA, като по този начин допринася за промените, наблюдавани при хроничен лъчев проктит [3]. Допълването с клизми на SFCA може да ускори заздравяването чрез подобряване на дефицита, изпитван от колоноцитите. Две рандомизирани проучвания разглеждат бутиратни клизми (40 mM бутират) и откриват незначително подобрение на симптомите и признаците, противно на съобщенията за случаи, предполагащи известна полза. И двете проучвания обаче бяха силно недостатъчни [46–48]. Необходими са допълнителни проучвания, за да се оценят възможните ползи от SCFA за хроничен проктит.
6.3.4. HBO
Хипербаричната кислородна терапия (HBO) произтича от патологичния процес на исхемия, включващ компрометиране на притока на кръв към ректалната стена. Ползата от HBO теоретично се постига чрез намаляване на тъканната хипоксия, вероятно чрез нейните ангиогенни и антибактериални ефекти [49, 50]. Данните за употребата на HBO при хроничен радиационен проктит са ограничени. Преглед от Bennett et al. [51] установи повишен шанс за подобрение с лечение с хипербарен кислород (RR 1,75, брой, необходим за лечение = 5). Степента на полза, кумулативните ефекти или продължителността на отговора обаче не могат да бъдат количествено определени поради методологията и качеството на данните. Едно рандомизирано контролирано проучване на Clarke сравнява пациенти, лекувани с 90 минути 100% кислород при 2 атмосфери, с пациенти, лекувани в продължение на 90 минути с 21% кислород при приблизително 1 атмосфера. Резултатите предполагат известна полза от подобряване на симптомите след 30 лечения [52]. Повечето проучвания показват, че HBO е скъп и не е лесно достъпен в повечето области, с изключение на високоспециализирани центрове поради изискването за множество лечения и специализирано оборудване.
6.3.5. Антиоксиданти
Счита се, че оксидативният стрес е основен механизъм в развитието на хроничен радиационен проктит; агенти с антиоксидантни свойства са използвани в опит да ограничат увреждането на тъканите при радиационно увреждане. В проучване на Kennedy et al., Което включва само 10 пациенти, употребата на витамин Е и С значително намалява степента на диария и спешност [19]. Ползата от витамин А е разгледана сама по себе си и в комбинация с други терапии. В двойно-сляпо проучване на Ehrenpreis, използването на витамин А значително намалява симптомите на проктит и ефектите, разширени върху пациенти в плацебо групата след кръстосване [53]. Patel съобщава, че добавянето на витамин А към лечение с 8% формалин увеличава степента на успех на формалина и съкращава времето, необходимо за постигане на подобрение [54].
6.4. Инвазивни лечения
6.4.1. Аблативни процедури
Аблативните техники са запазени за лечение на симптоми, рефрактерни на медицинското лечение и включват формалин, ендоскопска коагулация и коагулация на аргонплазма. Тези техники могат да бъдат свързани с усложнения, които включват кървене, перфорация, фистули и стеноза.
6.4.2. Формалин
6.4.3. Ендоскопска коагулация
Разнообразие от ендоскопски коагулационни устройства са ефективни за контрол на радиационно индуцирано кървене чрез коагулация на фокални кървещи телеангиектазии. Повечето от наличните в момента проучвания са ретроспективни и показват подобрение на симптомите и намален рецидив след лечение с YAG лазерна коагулация или аргонова плазмена коагулация [2]. И двата метода се основават на доставяне на термична коагулация и трябва да бъдат запазени за пациенти, страдащи от значителен хеморагичен проктит [59]. Често се изискват няколко лечебни сесии.
Плазмената коагулация на аргон използва високочестотна енергия (монополярна диатермия), предавана в тъканта чрез йонизиран газ по безконтактен начин [59]. Доказана е способността му да контролира кървенето в стомашно-чревния тракт и има много ограничено проникване в тъканите, което го прави привлекателен за лечение на повърхностно кървене. Наличните проучвания са ретроспективни и имат малък брой пациенти [60, 61]. Всички проучвания обаче показват по-висок хемоглобин и по-малко симптоми при пациенти с хеморагичен проктит, които не са се справили с медицинска терапия. Съобщава се, че единични сесии значително подобряват симптомите [62], но средно са необходими две до три лечения за постигане на този резултат. Подобренията продължиха няколко месеца след приключване на терапията [2, 63]. Повечето от докладваните усложнения са леки и включват спазми, отделяне на слуз и стриктура [2]. Съобщени са обаче значителни усложнения, включително големи язви, перфорации и ректуретрални и ректовагинални фистули.
YAG лазерите имат същите теоретични предимства като аргоновата плазмена коагулация с ограничена дълбочина на проникване и възможност за прецизно приложение. Доказателствата за тяхната употреба са подобни на тези за коагулация на аргон в плазмата, като са налице само няколко проучвания, включително тези с по-малко от 10 пациенти. [64, 65]. Въз основа на наличните в момента проучвания, YAG лазерите могат да бъдат полезни при лечението на радиационен проктит, но данните не са достатъчно силни, за да подкрепят широкото им използване. Както за аргоновата плазмена коагулация, така и за YAG лазерите, разходите и наличността също могат да представляват значителни пречки.
6.4.4. Хирургия
В случаите на тежко и нелечимо кървене хирургичните възможности са много ограничени, тъй като отклонението рядко ще контролира напълно кървенето. Колостомията за отклоняване на цикъла е описана в едно проучване като успешен начин за контролиране на кървенето [67], но в много случаи проктектомията може да бъде единствената налична опция. Когато стриктурите са проблем, отклоняването на потока на изпражненията често води до значително подобрение на симптомите. Други възможности включват резекция с реконструкция, когато стриктурата е по-висока в ректума или авансираща клапа (лигавица или кожа), когато ректалната стриктура е в ануса. Във всички случаи, предвид лошото качество на тъканите, трябва да се има предвид поне временно отклоняване. Когато е необходимо хирургично лечение, повечето проучвания показват лоши резултати с висок процент на усложнения (15% –80%) и смъртност от 3% –9% [66, 68–70].
7. Заключение
Препратки
- Последни стратегии за лечение на бъбречна ангиомиолипома Преглед на диагностичните и терапевтичните
- Перипроцедурно управление на пациента с диабет, подложен на коронарна ангиография в момента
- Дейности на открито като инструмент за управление на наднорменото тегло и затлъстяването при деца 78523
- Нормална органна радиационна дозиметрия и свързаните с нея несигурности в ядрената медицина, с акцент върху
- Метаболитни ефекти на упражненията върху детското затлъстяване съвременна перспектива - ScienceDirect