Майер Реми, д-р проф. Ем.
Гастроентерология, хепатология и хранене
Университет в Базел
CH-4416 Бубендорф, Швейцария
Стивън А. Макклав, д-р проф.
Професор по медицина
Медицински факултет на Университета в Луисвил
Луисвил, Кентъки, САЩ
Цели на обучението
- Да научите как да дискриминирате пациентите с лек или тежък панкреатит;
- Да се оцени въздействието на адекватна хранителна подкрепа върху клиничния резултат при пациенти с остър панкреатит;
- Да се запознаят с ползите и рисковете от ентерално и парентерално хранене при пациенти с остър панкреатит;
- Да се научи най-добрият подход за хранителна подкрепа при пациенти с тежък и сложен остър панкреатит.
Съдържание
- Въведение
- Предсказващи резултати 2.1 Оценка на тежестта на острия панкреатит 2.2 Хранителен статус
- Енергиен и субстратен метаболизъм при остър панкреатит 3.1 Метаболизъм на въглехидратите 3.2 Протеинов метаболизъм
- Екзокринна стимулация на панкреаса от макронутриенти
- Енергийни изисквания
- Ентерално или парентерално хранене
- Хранителна подкрепа при лек до умерен панкреатит
- Хранителна подкрепа при тежък остър панкреатит 8.1 Начин на хранене 8.1.1 Хеюнално, стомашно или перорално хранене 8.2 Коя ентерална и парентерална формула
- Перорално хранене
- Хранителна подкрепа при пациенти след операция на панкреаса
- Обобщение
- Клиничен случай
- Тест за самооценка
- Препратки
Ключови съобщения
- Тежестта на острия панкреатит и хранителният статус предсказват изхода, поради което и двете трябва да бъдат оценени при тези пациенти;
- Адекватната хранителна подкрепа е от решаващо значение при пациенти с тежък и сложен панкреатит. При тежък остър панкреатит отрицателният енергиен баланс има отрицателно въздействие върху хранителния статус и прогресията на заболяването;
- При лек панкреатит ентералното или парентералното хранене няма положително въздействие върху хода на заболяването, ако пациентът може да започне да се храни рано и е на пълноценна диета в рамките на пет до седем дни. Следователно не се препоръчва специфична хранителна подкрепа;
- При тежък остър панкреатит ранната хранителна подкрепа е от съществено значение;
- Не всички пациенти се нуждаят от хранителна поддръжка чрез сонда, някои толерират орално хранене;
- Ако храненето през устата не е възможно поради постоянна болка за повече от пет до седем дни, ентералното хранене трябва да започне незабавно;
- Стомашното хранене е приемлива и безопасна алтернатива на йеюналното хранене при липса на непоносимост;
- Ранното ентерално хранене с йеюнална тръба се понася добре и е безопасно при пациенти с остър тежък панкреатит. Поставянето на ендоскопска тръба е лесно за изпълнение;
- Непрекъснатото стомашно или йеюнално приложение на стандартна формула обикновено се опитва първо днес и продължава, ако те се понасят. Формули на основата на пептид могат да бъдат препоръчани, ако има непоносимост към полимерната формула. Те са безопасни и също така са доказано ефективни;
- Ранното ентерално хранене подобрява хода на тежкия панкреатит. Поради това се препоръчва непрекъснато ентерално стомашно или йеюнално хранене при всички пациенти според толеранса. Ако целта за калориите не може да бъде постигната с ентерално хранене, трябва да се добави парентерално хранене;
- Когато се дава парентерално хранене, трябва да се избягва прехранването;
- При парентерално хранене може да се обмисли прилагането на глутамин и n-3 мастни киселини;
- Хирургията за усложнения на остър панкреас предоставя важна възможност за получаване на ентерален достъп, или чрез игла катетър еюностомия, или назоеюнална тръба за хранене.
1. Въведение
2.2 Хранителен статус
Недохранването и затлъстяването често се наблюдават при пациенти с остър панкреатит. И двете са добре известни рискови фактори за повече усложнения и по-висока смъртност. Известно е, че недохранването се среща при 50-80% от хроничните алкохолици и алкохолът е основен етиологичен фактор при пациенти с остър панкреатит при мъжете (30-40%) (15). Пациентите с жлъчен панкреатит, по-доминиращ при жените, имат висока склонност към наднормено тегло.
Следователно за хранителна подкрепа е необходимо да се оцени тежестта на острия панкреатит и хранителния статус по време на приема и по време на заболяването. И двата фактора са необходими за планиране на интервенции в храненето при пациенти с остър панкреатит.
3. Енергия и субстратен метаболизъм по време на остър панкреатит
По време на остър панкреатит възникват специфични и неспецифични метаболитни промени. Разнообразие от възпалителни цитокини увеличава основния метаболизъм. Това може да доведе до увеличена консумация на енергия. Разходът на енергия в покой варира в зависимост от тежестта и продължителността на заболяването. Ако пациентите развият сепсис, 80% от тях показват повишаване на белтъчния катаболизъм и повишена нужда от хранителни вещества. Продължителният отрицателен азотен баланс определя отрицателния клиничен резултат (16). Не е ясно дали отрицателният азотен баланс е основният фактор за резултата. Връзката между азотния баланс и резултата може да отразява само връзката между азотния баланс и тежестта на заболяването. Няма налично проучване, при което пациентите да са били стратифицирани според тежестта на заболяването.
3.1 Метаболизъм на въглехидратите
Метаболизмът на глюкозата при остър панкреатит се определя от реакцията на SIRS, оксидативен стрес и инсулинова резистентност. Полученото безсмислено циклично движение на течности и среда на възпалителни цитокини може да доведе до увеличаване на енергийните нужди. Ендогенната глюконеогенеза се увеличава в резултат на метаболитния отговор на тежкия възпалителен процес. Глюкозата е важен източник на енергия и може частично да противодейства на присъщата глюконеогенеза от разграждането на протеините. Това може до известна степен да противодейства на вредния и нежелан ефект на протеиновия катаболизъм (17). Максималната скорост на окисляване на глюкозата е приблизително 4 mg/kg/min. Прилагането на глюкоза в излишък може да бъде разточително и дори вредно поради липогенезата и рециклирането на глюкозата. Освен това могат да се появят хипергликемия и хиперкапния. Хипергликемията е основен рисков фактор за инфекции и метаболитни усложнения. Следователно мониторингът и контролът на кръвната глюкоза са от съществено значение. Доказателства за непоносимост към глюкоза се срещат в повечето случаи (честота 85%) (18).
3.2 Метаболизъм на протеини
Отрицателният азотен баланс често се наблюдава при тежък остър панкреатит. Загубите на протеин трябва да бъдат сведени до минимум и увеличеният белтъчен оборот трябва да бъде компенсиран. Ако остър панкреатит се усложнява от сепсис, до 80% от пациентите са в хиперметаболитно състояние с увеличаване на енергийните разходи в покой. Отрицателният азотен баланс е свързан с неблагоприятни клинични резултати. Загубите на азот достигат до 20-40 g/ден при някои пациенти с остър панкреатит.
3.3 Липиден метаболизъм
Хиперлипидемията е често срещано откритие при остър панкреатит. Механизмът на променен липиден метаболизъм не е напълно ясен. След остър пристъп серумните концентрации на липиди се връщат към нормалните граници. Доказателствата за непоносимост към мазнини се срещат само в 12-15% от случаите (18). Известно е също така, че при някои пациенти с тежка хиперлипидемия може да се развие остър панкреатит (19).
4. Екзокринна стимулация на панкреаса от макронутриенти
5. Изисквания за енергия
6. Ентерално или парентерално хранене
В миналото се е използвало пълно парентерално хранене (TPN), за да се избегне стимулиране на екзокринната секреция на панкреаса. Проведени са няколко проспективни, рандомизирани клинични проучвания, сравняващи ентералното и парентералното хранене при пациенти с остър панкреатит (29-36). При лек до умерен остър панкреатит тези проучвания не показват ефект върху резултата (29, 30). TPN не променя хода на заболяването, но е по-скъп или е придружен от нарастване на свързаните с катетъра инфекции и по-дълъг престой в болница. През последните няколко години стана ясно, че тези усложнения често са следствие от прехранване. Ван ден Берге и др. показа, независимо от пътя на хранителната подкрепа, че контролът на хипергликемията с инсулин намалява смъртността при пациенти с критични грижи (37).
Наскоро управлението на храненето премина от парентерално към ентерално хранене. Ентералното хранене при остър панкреатит може да намали катаболизма и загубата на чиста телесна маса и може да модулира реакцията на острата фаза с потенциал за регулиране надолу на отговора на спланхничния цитокин (38) (Таблица 5).
7. Хранителна подкрепа при лек до умерен панкреатит
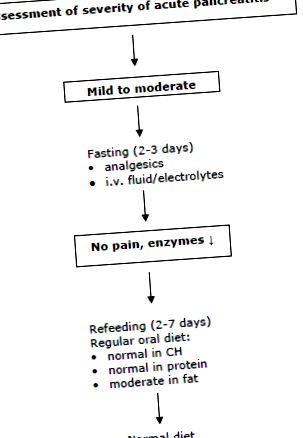
Няма доказателства, че хранителната подкрепа (ентерална или парентерална) има благоприятен ефект върху клиничния резултат при пациенти с лек остър панкреатит (44, 46). Ентералното хранене е излишно, ако пациентите ще могат да консумират нормална храна след 5 до 7 дни (Насоки на ESPEN: Степен B). Всъщност до 80% са на адекватна орална диета в рамките на 7 дни (29). За повторно хранене се препоръчва нормална диета с намалено съдържание на мазнини. Не е необходим преход с течна диета (43).
Ентерално или парентерално хранене в рамките на 5 до 7 дни няма положителен ефект върху хода на заболяването и поради това не се препоръчва (Насоки на ESPEN: Степен А).
Подкрепата за ранно ентерално хранене може да бъде от значение при пациенти с предшестващо тежко недохранване или при пациенти, когато ранното хранене за 5 до 7 дни не е възможно. Фиг. 1 показва често използван подход за тези пациенти
8. Хранителна подкрепа при тежък остър панкреатит
8.2 Коя ентерална и парентерална формула
9. Перорално хранене
12. Клиничен случай
48-годишен мъж с анамнеза за хронична злоупотреба с алкохол беше приет в болницата с остра коремна болка, която беше тъпа, скучна и постоянна. Болката започна след прекомерна консумация на алкохол през уикенда и се намираше в епигастриума, повече от лявата страна и излъчваше към гърба. Свързаните симптоми са анорексия, гадене и повръщане. Пациентът наистина не беше ял от пет дни.
Клинични находки:
Височина 174 см, телесно тегло 60 кг; ИТМ 20 kg/m 2
Треска 38,0 °
C Налягане на кръвта: 160/100 mmHg, Пулс 94 удара/мин
Коремна нежност, мускулна охрана и разтягане
Лабораторни находки: WBC 13x10e 9/l
Хематокрит: 40%
CRP 80 mg/l
Калций 2,1 mmol/l
Глюкоза 10 mmol/l
LDH 300 U/l
AST 70 U/l
Серумна амилаза 700 U/l
Серумна липаза 1000 U/l
Албумин 30g/l
Коремната ехография показва подуване на панкреаса и събиране на парапанкреатична течност.
Няма признаци на жлъчни заболявания.
Q1: Каква е вашата диагноза при този пациент? Колко тежка е болестта? Какъв е резултатът на Рансън? Q2: Дали пациентът е изложен на хранителен риск? Q3: Как ще управлявате този пациент; има ли нужда от хранителна подкрепа?
През следващите 48 часа хематокритът намалява с 15% и BUN е 3 mmol/l (8.4 mg/dl). Серумният калций спадна до 1,7 mmol/l (6,8 mg/dl), PO2 беше 59 mmHg (7,8 kPa) и дефицит на база> 5 mEq/l. Очакваното отделяне на течности е около 5 литра, като само 1,5 литра преминават като урина. CRP се е увеличил до 220 mg/l.
Q4: Как бихте анализирали сега тежестта на заболяването? Какъв е резултатът на Рансън сега? Трябва ли сега да започнете хранителна терапия? Ако да, кой маршрут бихте избрали? Q5: Как изчислявате калоричните нужди? Колко протеин/азот ще препоръчате? Q6: Коя формула ще изберете?
На 7-ия ден пациентът трябваше да бъде интубиран и да се започне механична вентилация поради прогресираща дихателна недостатъчност и повишаване на CRP до 300 mg/l.
Сканирането на КТ на корема потвърждава тежък остър некротизиращ панкреатит с оценка на Балтазар по Скала от 6 точки (Фиг. 1 - Клиничен случай).
След започване на механичната вентилация ентералното хранене стана трудно поради продължително разтягане на корема и повръщане.
Q7: Как бихте нахранили този пациент сега? Q8: Бихте ли използвали имуномодулираща ентерална и/или парентерална формула в тази ситуация?
След две седмици заразената панкреасна некроза се потвърждава от положителна аспирационна култура с фина игла (Pseudomonas aeruginosa). CRP се увеличава до 400 mg/l. Поради прогресиращата хемодинамична нестабилност въпреки всички медицински мерки, беше взето решение да се оперира. Направена е лапаротомия, дрениране на абсцес и перитонеална промивка (Фиг. 2 - Клиничен случай).
Инициирана е комбинирана хранителна подкрепа. Фина иглена йеюностомия (FNJ) беше поставена за ентерално хранене (Фиг. 3 - Clinical Case) и фураж също се дава по парентерален път.
Необходими са били няколко операции, преди пациентът да се възстанови. След три седмици парентералното хранене може да бъде спряно. След пет седмици пациентът започна да яде. След седем седмици FNJ може да бъде премахнат.
Q10: Как бихте планирали хранителна подкрепа в периода на възстановяване?
- Ролята на храненето в лечението на хронични мускулно-скелетни заболявания
- Тема 8 Подход към оралното и ентералното хранене при възрастни
- Изгубване при хронични стомашно-чревни заболявания The Journal of Nutrition Oxford Academic
- Център за болести на панкреаса на UCLA Agi Hirshberg
- Тема 8 Подход към оралното и ентералното хранене при възрастни