Кореспонденция на: д-р Uta Drebber, Институт по патология, Университет в Кьолн, Joseph-Stelzmann-Str. 9, D-59031 Кьолн, Германия. [email protected]
Телефон: + 49-221-4786370 Факс: + 49-221-4786360
Резюме
ЦЕЛ: Наследственият дефицит на човешка лизозомна киселинна липаза (LAL) води до редките състояния на болестта на Wolman и заболяването за съхранение на холестерилов естер (CESD). Искаме да представим редкия случай на CESD при възрастен.
МЕТОДИ: Ние докладваме за възрастен пациент от женски пол с тежка хронична диария и загуба на тегло в резултат на CESD. Клиничният преглед разкрива признаци на малабсорбция и леко повишени чернодробни ензими.
РЕЗУЛТАТИ: Хистопатологичните промени в чернодробната тъкан и анализът на ДНК последователността потвърждават диагнозата CESD поради хомозиготност за най-честата мутация на CESD, дефект на мястото на снаждане G934A, кодиран от екзон 8 на гена на лизозомната киселина липаза (LIPA).
ЗАКЛЮЧЕНИЕ: Това е първият случай в литературата с диария като предполагаем симптом на CESD при възрастни пациенти.
ВЪВЕДЕНИЕ
Болестта на Wolman и болестта за съхранение на холестерилов естер (CESD) са много редки наследствени нарушения на липидния метаболизъм. И двете са последиците от автозомно-рецесивните мутации, които водят до дефицитна или силно намалена активност на човешката лизозомна киселинна липаза (LAL) киселина естераза и холестерилов естер хидролаза, съответно [1]. Зрелият 378-аминокиселинен протеин с молекулни маси приблизително 43-54 ku се кодира от лизозомно-киселинната липаза (LIPA) гена на хромозома 10q23.2-q23.3, който съдържа 10 екзона, диспергирани в 38.8 kb регион [2 -4].
LAL е от съществено значение за интрализозомното разграждане на холестерилови естери и триглицериди, които се поемат от рецептор-медиирана ендоцитоза. Наследен дефицит или ниска активност води до интрализозомно съхранение на съответните липидни субстрати. Тъй като ензимът се синтезира от всички ядрени клетки, натоварените с липиди клетки се намират във всички органи, особено в черния дроб, далака, надбъбречната и хемопоетичната система, както и в червата, както и в лимфните възли, белите дробове, тестисите и яйчници [5-8].
Докато болестта на Wolman има infaust прогноза и води до хидропс феталис и вроден асцит, както и до ненормално неврологично развитие, CESD се представя като по-лека форма поради остатъчна ензимна активност от около 3%, което води до широко отлагане на липиди и може да предизвика симптоми при всяка възраст [9-13].
CESD рядко се диагностицира. Ние съобщаваме за необичайния случай на 41-годишна жена, която страда от повтаряща се диария от ранна детска възраст и е била насочена към болницата по време на тежък епизод на диария и последвала загуба на тегло. По време на клиничния преглед беше взета чернодробна биопсия, което доведе до предварителната диагноза на CESD. Това беше потвърдено чрез молекулярно-генетичен анализ.
ДОКЛАД ЗА СЛУЧАИ
41-годишна пациентка, която е възпитавана като приемно дете, е била насочена към болницата поради персистираща хронична диария, която е причинила влошаване, причинявайки загуба на тегло от 10 kg през последните 5 месеца (телесно тегло 44 кг, височина 168 см по време на постъпване в болница). Клиничният преглед разкрива намалено ниво на липидоразтворими витамини, както и патологичен толеранс към лактоза. Коремната ехография показва оток на лигавицата на тънките черва. Целиакия е изключена от нормални нива на антитела срещу ендомизий, тъканна трансглутаминаза и глиадин. Бяха изключени и други причини за диария-подобна инфекция или злоупотреба с лаксативи. Пациентът е повишил чернодробните ензими (AST 47 U/L, ALT 57 U/L). Нямаше обаче признаци на вирусен хепатит (HbsAg- и anti-HBc-). Стойностите на имуноглобулина също бяха нормални. За да се намери причина за повишените чернодробни ензими и диарията, са взети биопсии на черния дроб и тънките черва.
Патологични находки
За хистопатологични и имунистохимични анализи бяха подготвени формално фиксирани, вложени в парафин чернодробни тъкани и биопсии на тънките черва. Извършен е ултрастуктурен преглед на фиксирана на глутаралдехид чернодробна тъкан под електронен микроскоп.
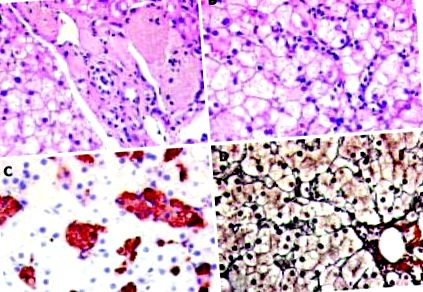
Светлинната микроскопия в черния дроб показва увеличаване на клетките на Купфер и макрофагите, които са открити в синусоидите, както и в порталните пътища. Макрофагите бяха забележими с цитоплазматичното съхранение на пенест, жълтокафяв, PAS-положителен материал. В имунохистохимията описаната клетъчна популация изразява специфичния за макрофаги маркер CD68. Разпределението на CD68-положителната популация е изобилно по целия ацинус без зонално акцентиране. Освен това, отделна паренхимна възпалителна активност с единични апоптотични тела, както и фина везикуларна стеатоза в около 40% от хепатоцитите. В петна от ретикулин се наблюдава дискретна перицелуларна фиброза (Фигура (Фигура 1 1).
Леки микроскопски находки в черния дроб. О: Пенлив материал с кафяв цвят се вижда в забележими макрофаги до и в портален тракт. HE петно × 400. Б: Част от ацинус с изявена интрасинусоидална клетъчна инфилтрация и микровезикуларна стеатоза на хепатоцитите. HE петно (× 400). В: Имунохистохимично оцветяване с CD68 положителни макрофаги, натоварени с пенест материал. D: Ретикулиново оцветяване (× 400). Няма забележителна фиброза.
Биопсиите на тънките черва разкриха единични макрофаги с цитоплазматично съхранение на PAS-положителен пенест, жълтеникавокафяв материал в апикалната част на вилите в подслазията на ламина (Фигура (Фигура 2). 2). Ултраструктурното изследване показа лизозомно съхранение на липиди в цитоплазмата на хепатоцити и макрофаги, както и наличието на единични кристали на холестерилов естер (Фигура (Фигура 3 3)).
Биопсията на тънките черва разкрива единични макрофаги с цитоплазматично съхранение на PAS-позитивен пенест, жълтеникавокафяв материал в апикалната част на ворсите в подслазията на ламина. PAS оцветяване се демонстрира с PAS-положителни макрофаги между стрелките (cd) (× 400).
О: Електронната микрофотография на чернодробна тъкан показва един холестеролен кристал в цитоплазмата на чернодробна клетка. Б: Триглицеридни капчици с различен размер в цитоплазмата на хепатоцитите (× 11000).
Като цяло хистопатологичните промени в чернодробната биопсия предполагат CESD. Следователно беше извършен анализ на ДНК последователност на гена LIPA на пробанда. Установено е, че пациентът е хомозиготен носител на най-честата мутация на CESD, обмен на G934A, засягащ последната кодираща база на екзон 8, като по този начин потвърждава диагнозата. Този генетичен дефект води до пропускане на екзон 8 от транскрипта на иРНК и до загуба на вътрешните аминокиселини 254-277 от зрелия ензим. Въпреки наличието на мутацията се случва приблизително 3% от нормалното снаждане, което осигурява оцеляване на засегнатия индивид [1,3].
ДИСКУСИЯ
Представяме необичайния случай на CESD при възрастна жена. CESD е рядко състояние, което обикновено се диагностицира през първото или второто десетилетие от живота поради съпътстващата хепатомегалия, често в комбинация с хиперхол-естеролемия, но рядко в по-късна възраст [7]. Въпреки че няма специфично лечение, облекчаването може да бъде предизвикано от инхибитори на 3-хидрокси-3-метилглутарил коензим А (HMG CoA) редуктаза като ловостатин [14-16]. В случай на чернодробна цироза е показана чернодробна трансплантация [17-19].
Клиничните симптоми на нашия пациент, страдащ от тежка диария и загуба на тегло, представляват забележителна разлика от типичния модел на заболяването при CESD, който обикновено показва чернодробна симптоматика с ранна прогресия към цироза [1]. Пациентът съобщава за хронична диария с появата през ранното детство, така че CESD изглежда играе причинно-следствена роля. Съответно лабораторните находки показват намалено ниво на липидоразтворими витамини като признак на хронична малабсорбция. За разлика от това, чернодробната симптоматика е дискретна. Взета е чернодробна биопсия поради леко повишени чернодробни ензими с неизвестна етиология. Хистопатологичните промени в черния дроб са характерни за CESD, но съществена фиброза не се е развила, което е отразено от лабораторните находки. Това е особено забележително поради дългия период от време на симптомите на заболяването и в сравнение с други съобщени случаи, при които се съобщава, че тежка фиброза е налице още в детството [20].
Анализът на ДНК последователността разкрива хомозиготност за мутация G934A в екзон 8 на гена LIPA. Това нуклеотидно заместване води до пропускане на екзон и последваща загуба на 24 аминокиселини от зрелия ензим. Това е най-честият генетичен дефект, наблюдаван при CESD, така че мутацията не обяснява необичайното клинично представяне [3].
В заключение, CESD е много рядка метаболитна грешка и се отличава с впечатляващо разнообразие от клинични симптоми, които затрудняват установяването на правилната диагноза. Пациентът, докладван тук, е първият случай в литературата с CESD и хронична диария като предполагаем симптом на CESD. Ето защо заключаваме, че CESD трябва да се вземе предвид при диференциалната диагноза на хронична диария, когато други причини за диария са изключени.
Бележки под линия
Научен редактор Li WZ Езиков редактор Elsevier HK
- Моето пътуване за отслабване с ревматоиден артрит, хроничен Айлин
- ReShape Отслабване без операция - Център за храносмилателни заболявания
- Обръщане на диабет тип 2 със загуба на тегло - Доклад за здравето - ABC Radio National
- Преднизон и загуба на тегло не се увеличават Crohn; s Болестен форум
- Доклад на работната група на NIH Иновативни изследвания за подобряване поддържането на загуба на тегло - PubMed