Грейм Р. Франк
Детски медицински център на Коен, Отдел по детска ендокринология, Ню Хайд Парк, NY 11042, САЩ
Джойс Фокс
b Детски медицински център Коен, Отдел по човешка генетика, Ню Хайд Парк, Ню Йорк 11042, САЩ
Нинфа Кандела
c Детски медицински център Коен, Отдел по детска гастроентерология, Ню Хайд Парк, NY 11042, САЩ
Зорика Йованович
d Университет в Кеймбридж Метаболитни изследователски лаборатории, Институт по метаболитни науки, болница Addenbrooke, Cambridge CB2 2QQ, Великобритания
Елена Бочукова
d Университет в Кеймбридж Метаболитни изследователски лаборатории, Институт по метаболитни науки, болница Addenbrooke, Cambridge CB2 2QQ, Великобритания
Jeremiah Levine
c Детски медицински център Коен, Отдел по детска гастроентерология, Ню Хайд Парк, NY 11042, САЩ
Петер Р. Папенхаузен
Национален директор, цитогенетика, Лабораторна корпорация на Америка, Изследователски триъгълник парк, NC 27709, САЩ
Стивън О'Рахили
d Университет в Кеймбридж Метаболитни изследователски лаборатории, Институт по метаболитни науки, болница Addenbrooke, Cambridge CB2 2QQ, Великобритания
И. Садаф Фаруки
d Университет в Кеймбридж Метаболитни изследователски лаборатории, Институт по метаболитни науки, болница Addenbrooke, Cambridge CB2 2QQ, Великобритания
Резюме
Несинонимните мутации, засягащи двата алела на PCSK1 (пропротеинова конвертаза 1/3), са свързани със затлъстяването и нарушената обработка на хормона. Ние съобщаваме за пробанд, който е бил хетерозиготен за майчина наследствена мутация на рамково изместване и бащино унаследена делеция от 474kb, която обхваща PCSK1, представляваща нов генетичен механизъм в основата на този фенотип. Въпреки че про-вазопресинът не е известен физиологичен субстрат на PCSK1, развитието на централен безвкусен диабет в този пробанд предполага, че дефицитът на PCSK1 може да бъде свързан с нарушена осморегулация.
1. Въведение
Пропротеиновите конвертази (PC) са семейство серинови ендопротеази, които разцепват неактивни пропептиди в биологично активни пептиди [1]. Двама членове на семейството, Proprotein Convertase Subtilisin/Kexin типове 1 и 2 (PCSK1 и PCSK2) селективно се експресират в невроендокринните тъкани, където те разцепват широк, но специфичен набор от прохормони, включително про-опиомеланокортин (POMC), протиротрофин освобождаващ хормон (TRH), проинсулин, проглукагон и прогонадотропин освобождаващ хормон (GnRH) [2–9]. По-рано се съобщава за вроден дефицит на PCSK1 при три несвързани пробанда с тежка хиперпроинсулинемия, малабсорбтивна диария, хипогонадотропен хипогонадизъм, частични централни дефекти в надбъбречната и щитовидната оси и тежко затлъстяване [10–12]. Поне някои от тези фенотипове могат да бъдат обяснени с известното или предполагаемо участие на PCSK1 в обработката на проинсулин, проопиомеланокортин, проглукагон, proGnRH и proTRH [1]. Описваме четвъртия пациент с дефицит на PCSK1, чийто фенотип, в допълнение към горния, включва централен безвкусен диабет.
2. Изследователски дизайн и методи
Директното нуклеотидно секвениране на гена PCSK1 беше проведено, както беше съобщено по-рано [10]. Анализът на микрочипове на SNP се извършва с помощта на платформата Affymetrix 6.0, като се използват 500 ng обща геномна ДНК. Данните бяха анализирани с помощта на Affymetrix Genotyping Console Browser v.3.01. Мултиплекс лигационно независими сонди за амплификация (MLPA) в генния регион PCSK1 (chr5: 95751875-95774445) са проектирани в съответствие с препоръките на MRC-Holland (Холандия) (http://www.mlpa.com/) и последователностите са достъпни след заявка. MLPA хибридизацията, лигирането и PCR се провеждат, като се използват 200 ng геномна ДНК и комплектът SALSA-MLPA (MRC-Holland, Холандия), съгласно инструкциите на производителя. Продуктите MLPA PCR (1 μl) бяха смесени с 0,5 μl GeneScan ™ -500 ROX ™ стандарт за размер (Applied Biosystems, UK) и 10 μl HiDi формамид (Applied Biosystems, UK) и разделени на генетичен анализатор ABI 3130 (Applied Biosystems, Великобритания) и данни за електрофореза, извлечени с помощта на софтуера GeneMapper v4.0 (Applied Biosystems, UK).
3. Резултати
От 12 месеца започна бързото напълняване въпреки очевидния среден калориен прием от
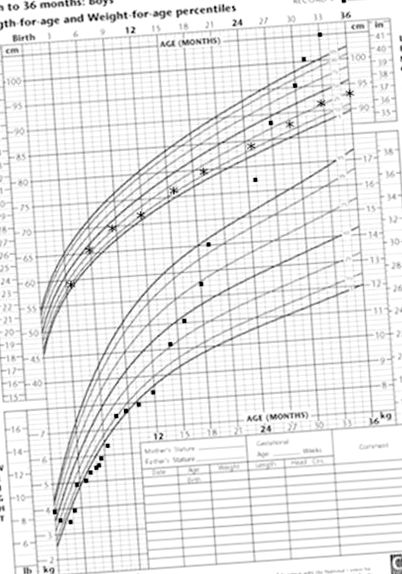
70 kcal/kg/ден. Някои твърди храни бяха въведени за първи път на около 14 месеца и това доведе до подобрена консистенция на изпражненията и по-рядка диария. До 24-месечно дете детето е било със затлъстяване (фиг. 1 А). Формулата на основата на аминокиселина е прекратена на 3-годишна възраст.
А. Диаграма на растежа на пробанда, демонстрираща изразен провал да процъфтява през първите 2 месеца; стабилизиране на наддаването на тегло от 2 месеца (с въвеждане на парентерално хранене и формула на основата на аминокиселина) и прекомерно наддаване на тегло от 1 година. Б. Родословно дърво с хроматограми. Див тип (Wt); изтриване (del). В. MLPA потвърждение на 474kb изтриване на 5q15-q15 (95669703-96143955). MLPA следите на пациента са в червено, насложени върху контролните MLPA следи в черно. MLPA сондите за гени в региона от интерес са подробно описани по-долу. Две от пробите MLPA са разположени в гена PCSK1 и изглежда са изтрити в пациента (стрелки), а две са от двете страни на изтрития регион на хромозома 5q15 (дистални и проксимални сонди) и са идентични с нормалните контрол.
4. Дискусия
Описваме четвъртия пациент с дефицит на PCSK1 поради комбинацията от наследствена по майчина мутация на рамково изместване, водеща до преждевременно спиране и делеция по бащина линия на хромозома 5, обхващаща PCSK1 и два съседни гена. Този пациент се различава значително от трите предишни случая, като всички те включват хомозиготност или съставна хетерозиготност за мутации на миссенс или места на снаждане [10–12]. В този случай единият алел беше изтрит, а другият нарушен чрез въвеждане на 91 аминокиселини, последвано от преждевременен стоп кодон, възникващ в каталитичния домен. Докато някои остатъчни ензимни активности на PCSK1 биха могли да продължат в трите докладвани по-рано случая, изглежда много вероятно този пациент да представлява нулевия фенотип на PCSK1.
Развитието на централен безвкусен диабет при нашия пациент предполага, че PCSK1 може да участва в пълноценното функциониране или централното усещане за осмолалност при хората. Дали това се дължи на неуспех в преработката на провазопресин или на някаква друга неизправност на осморецепцията или производството или освобождаването на вазопресин е неизвестно. Вазопресинът се синтезира в хипоталамусните неврони, експресиращи както PCSK1, така и PCSK2 [5]. При мишките PCSK1 и PCSK2 участват в обработката на про-вазопресин до вазопресин, което предполага, че може да съществува степен на излишък in vivo [6,14,15]. В обобщение докладваме четвъртия пациент с дефицит на PCSK1. Находката на безвкусен диабет при този пациент и клиничните характеристики, предполагащи тази диагноза при един пациент, докладван преди това от нас [12], предполагат, че тази потенциално клинично значима и лечима аномалия трябва да се търси при бъдещи пациенти с този синдром.
Конфликт на интереси
Нито един от авторите няма конфликт на интереси.
Благодарности
ISF и SOR бяха подкрепени от Trust Trust, MRC Центъра за затлъстяване и свързаните с тях разстройства и британския NIHR Cambridge Biomedical Research Center.
Бележки под линия
Article Това е статия с отворен достъп, разпространявана при условията на лиценза Creative Commons Attribution-NonCommercial-ShareAlike, която позволява нетърговска употреба, разпространение и възпроизвеждане на всякакъв носител, при условие че оригиналният автор и източник са кредитирани.
- Предотвратяване на затлъстяването и диабета при ученици WDF05-120 Световна фондация за диабет
- Средносрочна ефективност на поведенчески и психодинамични стационарни лечения при тежко затлъстяване
- Медицинските сестри помагат в борбата с „Епидемията от затлъстяване“, един пациент наведнъж
- Проект ECHO Детски диабет и затлъстяване Бирмингам, Алабама (Алабама) - Деца от Алабама
- Пропионат Може ли обикновена хранителна добавка да повиши риска от затлъстяване и диабет Chicago Sun-Times