Катедра по инфекциозни болести и клинична микробиология, Университетско медицинско училище Ondokuz Mayis, Самсун, Турция.
Отделение по инфекциозни болести и клинична микробиология, Анкара Numune образователна и изследователска болница, Анкара, Турция.
Отделение по инфекциозни болести и клинична микробиология, Анкара Numune образователна и изследователска болница, Анкара, Турция.
Катедра по инфекциозни болести и клинична микробиология, Медицинско училище в Университета Кумхуриет, Сивас, Турция.
Отделение по инфекциозни болести и клинична микробиология, болница за образование и изследвания Ataturk, Анкара, Турция.
Катедра по инфекциозни болести и клинична микробиология, Медицински факултет на Технически университет Карадениз, Трабзон, Турция.
Катедра по инфекциозни болести и клинична микробиология, Медицинско училище в Анкара, Анкара, Турция.
Отделение по инфекциозни болести и клинична микробиология, болница за образование и изследвания Diskapi Yildirim Beyazit, Анкара, Турция.
Резюме
Кримско-конгоската хеморагична треска (CCHF) е инфекция, пренасяна от кърлежи, която се увеличава в Турция и европейските страни от 2000 г. Заболяването е особено ендемично в Близкия изток и в някои африкански страни. В европейските страни се разглежда и като инфекция при пътуване. Пациентите с потвърдена диагноза обикновено се хоспитализират за наблюдение, докато пациентите с добро цялостно състояние могат да бъдат наблюдавани амбулаторно. Болниците, които управляват CCHF, трябва да имат лесен достъп до кръвна банка, а болниците за третична помощ трябва да имат добре оборудвано отделение за интензивно лечение. При постъпване трябва да започнат строги предпазни мерки за контрол на кръвта и телесните течности, за да се ограничи експозицията на CCHF. Периодът на проследяване за всеки пациент се определя въз основа на индивидуалното клинично състояние и лабораторните стойности. Тъй като няма специфично антивирусно лечение за CCHF, поддържащото лечение е от съществено значение. Този преглед подчертава някои от основните характеристики на наблюдението на случаите и поддържащото лечение при CCHF.
Въведение
Таблица 1. Подкрепяща грижа при кримско-конгоска хеморагична треска a
PT, протромбиново време; INR, международно нормализирано съотношение; aPTT, активирано частично тромбопластиново време; P ao 2, частично артериално налягане на кислород; F io 2, фракция на вдъхновен кислород; P aco 2, частично артериално налягане на въглероден диоксид.
Стандартен подход и управление на дела
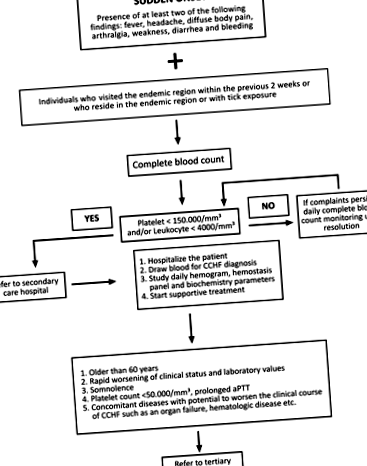
След дефинирането на CCHF през 2003 г., турският научен комитет на CCHF на Министерството на здравеопазването разработи алгоритъм за управление на случаите (фиг. 1; Министерство на здравеопазването на Турция 2011 г.). Според алгоритъма периодът на проследяване за всеки пациент се определя въз основа на индивидуалното клинично състояние и лабораторните стойности. Пациентите с потвърдена диагноза обикновено се хоспитализират за наблюдение, докато пациентите с добро цялостно състояние, които могат да се явяват редовно за посещения за наблюдение, могат да бъдат наблюдавани амбулаторно. Амбулаторното наблюдение трябва да включва серумни нива на аланин аминотрансфераза (ALT), аспартат аминотрансфераза (AST), креатин киназа (CK), лактат дехидрогеназа (LDH), международно нормализирано съотношение (INR), протромбиново време (PT), активирано частично тромбопластиново време (aPTT ) и пълна кръвна картина (CBC). Може да са необходими една до две седмици, за да се върнат ALT и AST до нормалните граници и тези параметри не изискват ежедневно наблюдение; измерванията на всеки 3-5 дни са достатъчни. Ако отклоненията в хемостатичните параметри (PT, aPTT и INR) продължават, дори ако общото състояние е добро, пациентът трябва да бъде хоспитализиран за наблюдение, докато стойностите се върнат към нормалните нива.
Фиг. 1. Алгоритъмът, използван за управление на случаите на CCHF (CCHF, хеморагична треска от Кримско-Конго; aPTT, активирано частично тромбопластиново време).
Съгласно алгоритъма за управление на случаите на турския научен комитет на CCHF (фиг. 1), пациентите могат да бъдат управлявани както в болници за вторични, така и в третични болници в Турция. Болниците, които управляват пациенти с CCHF, трябва да имат лесен достъп до кръвна банка за получаване на кръвни продукти (вътрешнофирмени или наблизо), а болниците за третична помощ трябва да имат добре оборудвана интензивна отделение. Трябва да присъстват адекватен брой лекари и друг персонал, който да се грижи за пациентите с CCHF, особено през лятото, и всички трябва да бъдат добре информирани за CCHF. При постъпване трябва да започнат стриктни предпазни мерки за контрол на кръвта и телесните течности и да продължат по време на хоспитализация при прехвърляне на пациента между отделения, за да се ограничи експозицията на CCHF. Всички пациенти трябва да бъдат изолирани в единична стая с прилежаща преддверия, която служи като единствен вход. Във всеки случай пациентите с CCHF трябва да бъдат изолирани от други пациенти.
Клиничният статус на пациента и лабораторните параметри са критични за мониторинга, включително тромбоцитите, PT, aPTT и INR, които определят следващите стъпки в лечението. Ежедневно при пациенти с кървене трябва да се оценява хемограма и хемостатични параметри. Може да е необходима оценка на хемограмата два или три пъти на ден, когато броят на тромбоцитите падне под 40 000/mm 3. Азот на уреята в кръвта, креатинин, ALT, AST и билирубин (ако има жълтеница) трябва да се преглеждат ежедневно или през ден, в зависимост от наличието на органна недостатъчност. По същия начин, когато клиничните състояния на пациента показват потенциална дисеминирана вътресъдова коагулация (DIC), могат да се оценят артериални кръвни газове, фибриноген, D-димер и продукти на разграждане на фибрин. Когато се покаже чрез мониторинг, може също да се направи анализ на урината и окултен анализ на фекална кръв.
Пациентите, чието общо състояние и лабораторните стойности започват да се нормализират и които вече не се нуждаят от хоспитализация, могат да бъдат преминати към амбулаторно наблюдение. Пациенти без констатирани кръвоизливи с нормални стойности на коагулация и нарастващ брой тромбоцити могат да бъдат изписани, при условие че нивото на тромбоцитите е приблизително 100 000/mm 3. Трябва да се избягват интрамускулни инжекции и инвазивни интервенции, доколкото е възможно.
Поддържащи лечения
Интравенозна течност
IV течности не са необходими, ако цялостното състояние на пациента е добро и има достатъчен прием през устата. В противен случай може да се даде, като се вземат предвид всички хронични състояния (напр. Сърдечна недостатъчност или хипертония), но трябва да се избягва ненужна подкрепа на течности. Могат да се прилагат изотонични течности (напр. Лактат на Рингер и изотоничен натрий). Не трябва да се използват хипотонични течности (напр. Декстроза 5%), тъй като те няма да останат в съдовете (Schierhout and Roberts 1998). Пациентите с ограничен перорален прием могат да бъдат подпомогнати от парентерално хранене.
Окачване на тромбоцитите (PS)
PS от единичен произволен донор се получават от цялата кръв чрез центрофугиране, докато PS за афереза се получават чрез отделяне само на тромбоцити от донорен материал чрез специални комплекти с помощта на устройства за афереза. Броят на тромбоцитите, получен от донорен материал, съответства на броя на тромбоцитите, съдържащ се в 5-6 единици произволен донорен PS (всяка единица PS съдържа приблизително 0,75 × 10 11/L тромбоцити, докато тромбоцитният концентрат, получен чрез тромбофереза, съдържа приблизително 3 × 10 11/L тромбоцити; McCullough 2010).
Клинично значимо кървене (напр. Хематемеза, мелена и епистаксис), с брой на тромбоцитите под 50 000/mm 3 (при пациенти с кървене, броят на тромбоцитите не трябва да пада под 50 000/mm 3), брой на тромбоцитите под 20 000/mm 3 плюс наличие на висока температура и индикации за системен хемостатичен дефицит, брой на тромбоцитите под 10 000/mm 3 при пациенти без температура или аномалии в параметрите на коагулацията и брой тромбоцити под 50 000/mm 3 при пациенти, които трябва да бъдат подложени на за инвазивна интервенция всички изискват трансфузия на PS (Британски комитет за стандарти в хематологията, Специална група за кръвопреливане 2003; Bosly et al. 2007).
По време на първите 15 минути на трансфузия на PS, скоростта не трябва да надвишава 5 mL/min. Препоръчителната продължителност на трансфузия за 6- до 8-единични концентрации на тромбоцити, получени или чрез случайна донорна суспензия, или чрез тромбофереза е 30 минути. Скоростта при педиатрични пациенти е 20–30 ml/kg/h. Пациентът трябва да се следи внимателно, тъй като по време на трансфузия могат да се развият алергични реакции и/или анафилаксия. Пурпурата след трансфузия е рядко, но фатално усложнение. Тази реакция, която се развива със специфични за тромбоцитите алоантитела, обикновено се проявява през първите 5-9 дни след започване на трансфузия (Bosly et al. 2007).
В зависимост от конкретната индикация могат да се прилагат 1 единица аферезни тромбоцити или 6 единици произволни тромбоцити. Една единица аферезни тромбоцити съответства на 6 единици произволни тромбоцити. Дозата на произволни тромбоцити се коригира в зависимост от телесното тегло, а добрата начална доза е 1 единица произволни тромбоцити/15 kg телесно тегло (Британски комитет за стандарти в хематологията, Работна група за кръвопреливане 2003; Bosly et al. 2007).
Ако PS е бил прилаган за спиране на съществуващо кървене, може да се наблюдава подобрение въз основа на клиничния отговор. В общата практика кръвните стойности на пациента се изследват около 24 часа след приложението. Пациентите с кървене обаче изискват по-често наблюдение на контролните параметри. Особено в случаите без увеличаване на броя на тромбоцитите въпреки трансфузията, може да се извърши повторна оценка на 60 минути след приложението на тромбоцитите (Spiess 2010; McCullough 2010; Refaai et al. 2011). Очаква се всяка единица PS да повиши нивата на тромбоцитите в кръвта поне с 2000/mm 3 (5000–10 000/mm 3 при идеални концентрации; за концентрация от 8 единици тромбоцити очакваният добив е 50 000–80 000/mm 3). При деца 1 единица тромбоцитен концентрат трябва да доведе до добив 3500/mm 3 (Bosly et al. 2007; Refaai et al. 2011).
Рефрактерността на тромбоцитите се определя като неуспех за постигане на адекватно увеличение на броя на тромбоцитите на 1 h и 24 h след преливане на 3-4 единици. Сепсисът, DIC, масивно кървене, инфекция, треска и хиперспленизъм са сред основните причини за алоимунизация, която се развива срещу човешки левкоцитен антиген (HLA) или антигени на тромбоцитите. Анти-HLA антителата трябва да се оценяват в случаите, при които рефрактерността на тромбоцитите не може да бъде обяснена с клинични находки (Британски комитет за стандарти в хематологичната работна група за кръвопреливане 2003) При повтарящи се кръвопреливания, тромбоцитните концентрати трябва да се преминават през левкоцитен филтър преди приложение, за да се предотврати алоимунизация. По отношение на превенцията на алоимунизация, не е доказано превъзходството на произволен или аферезен PS. Препоръчва се левкоцитна филтрация, за да се сведе до минимум рискът от алоимунизация. Левкоцитната филтрация води до 25–35% загуба на тромбоцити (Spiess 2010; McCullough 2010).
Прясно замразена плазма (FFP)
Плазмата е безклетъчна течност, съставена от вода, електролити и протеини, включително глобулин и албумин, приготвена чрез отделяне на кръв, получена от донори на кръв. Получава се чрез плазмафереза или центрофугиране на образувани елементи от 1 единица пълноценна кръв (O'Shaughnessy et al. 2004; Simon et al. 2009). След като се приготви и съхрани, факторите на кръвосъсирването и антикоагулантите, съдържащи се в кръвната торбичка, съставляват основната част от протеиновия сегмент. Плазмата не съдържа тромбоцити, еритроцити или левкоцити (Simon et al. 2009). Съдържа всички лабилни фактори на коагулация. Нивото на калий в течността е на нормалното серумно ниво и няма агрегати (O'Shaughnessy et al. 2004). В допълнение към коагулационните фактори, плазмата съдържа и приблизително 500 mg фибриноген (Simon et al. 2009).
Плазмата се отделя при стайна температура в рамките на 6-8 часа след даряването на кръвта и се определя като FFP, ако се съхранява замразена при -18 ° C или по-ниска. FFP може да се съхранява 12 месеца под -18 ° C (O'Shaughnessy et al. 2004; Simon et al. 2009).
Всяка единица FFP има обем от 200–250 ml и може да бъде подготвена до обеми до 800 ml (джъмбо единица) чрез афереза. Дневната доза FFP, която трябва да се прилага на възрастен пациент, е приблизително 10–15 ml/kg или 2–4 единици/ден, въпреки че дозата може да се увеличи при пациенти с масивно кървене, в зависимост от индивидуалното клинично състояние. Дневната доза се прилага в две разделени дози. Отговорът на пациента към приложената трансфузия на FFP трябва да бъде оценен въз основа на клиничния статус и стандартните лабораторни тестове, показващи коагулационната активност (O'Shaughnessy et al. 2004).
FFP не трябва да се използва при неконтролиран белодробен оток или застойна сърдечна недостатъчност като плазмен разширител или заместител на протеини, или при коагулопатии, които могат да бъдат коригирани чрез лечение с витамин К. По време на инфузията с FFP може да се наблюдават треска и студени тръпки. Могат да се развият редки алергии (1–3%) и свързано с трансфузия остро нараняване на белите дробове (O’Shaughnessy et al. 2004).
Суспензия на еритроцитите (ES)
Всяка единица ES (150–200 ml) съдържа 100 ml физиологичен разтвор, аденин, глюкоза, манитол (SAG-M) или еквивалентни допълнителни разтвори, минимална плазма, 45 g/единица хемоглобин и 50–70% хематокрит. След като цялата кръв се центрофугира, се отделят еритроцитите и плазмата. След това се въвеждат допълнителни разтвори (напр. SAG-M) и се разбърква внимателно. Суспензията се съхранява при 2–6 ° C. Трябва да се използва в рамките на 30 минути след изваждането от хладилника и преливането трябва да приключи в рамките на 4 часа (Световната здравна организация, 2001).
Условията на студената верига трябва да се запазят, докато не се приложи ES и методът трябва да бъде бавна трансфузия. Ако по време на трансфузия възникнат проблеми с потока във венозния катетър, оптималният подход би бил разреждането на компонента за трансфузия. За разреждане на кръвната съставка трябва да се използва само нормален физиологичен разтвор и при неизбежни обстоятелства 5% разтвор на албумин. Трансфузията трябва да бъде бавна (2–5 ml/min) по време на първоначалните 5–10 min администриране, за да се позволи наблюдение на всякакви възможни трансфузионни реакции. След това скоростта на преливане трябва да се коригира въз основа на допустимата скорост от пациента с почасово проследяване на жизнените показатели до завършване на преливането. Продължителността на трансфузията за пълна кръв и ES обикновено е 1–3 часа, въпреки че може да варира в зависимост от клиничния статус на отделния пациент. При спешни случаи 1 единица кръв може да бъде прелята само за няколко минути, при условие че пациентът е внимателно наблюдаван. Преливането на 1 или 2 единици кръв, извадена от хладилника в рамките на нормалния период, не включва недостатъци. Кръвта обаче не трябва да се нагрява, ако скоростта на трансфузия е над 50 mL/kg/h (Uluhan et al. 1998; McCullough 2005).
- FDA одобрява Saxenda на Novo Nordisk като лечение за хронично управление на теглото diaTribe
- Доклад за успешно лечение на интраоперативна руптура на трахеята по време на торакоскопия
- Случай 1 Треска и лимфаденопатия
- Диетични капани - Управление на теглото
- Причини за косопад при жени и лечение Здраве и благосъстояние The Guardian