Резюме
Експериментален дизайн.
Всички експериментални процедури бяха одобрени от Институционалния комитет за грижа и употреба на животните в Калифорнийския държавен университет в Нортридж и бяха съобразени с насоките за използване на лабораторни животни, публикувани от Министерството на здравеопазването и човешките ресурси на САЩ.
Перфузии на задните крайници.
Животните бяха анестезирани с интраперитонеална инжекция на пентобарбитал натрий (6,5 mg/100 g телесно тегло) и хирургически подготвени за перфузия на задните крайници, както е описано по-рано от Ruderman et al. (47) и модифициран от Ivy et al. (28). След хирургическа подготовка, канюли се вкарват в коремната аорта и кухата вена и животните се убиват чрез интракардиална инжекция на пентобарбитал, като задните крайници се измиват с 30 ml буфер на Krebs-Henseleit (KHB; рН 7,55). Веднага канюлите бяха поставени на една линия с нерециркулираща перфузионна система и задните крайници бяха оставени да се стабилизират по време на 5-минутен период на измиване. Перфузатът непрекъснато се газира със смес от 95% O2-5% CO2 и се затопля до 37 ° С. Скоростта на потока на перфузат беше зададена на 7,5 ml/min по време на стабилизацията и последващата перфузия, по време на която бяха определени скоростите на транспортиране на глюкоза.
Перфузиите бяха извършени в присъствието (н = 8/група) или отсъствие (н = 8/група) от 500 μU/ml инсулин. Основната перфузатна среда се състои от 30% измити човешки еритроцити с изтекъл срок на годност (Ogden Medical Center, Ogden, UT), KHB, 4% диализиран говежди серумен албумин (Fisher Scientific, Fair Lawn, NJ) и 0,2 тМ пируват. Задните крайници бяха измити с перфузат, съдържащ 1 тМ глюкоза в продължение на 5 минути в подготовка за измерване на транспорта на глюкоза. Транспортът на глюкоза се измерва за период от 8 минути, като се използва 8 mM концентрация на неметаболизиран глюкозен аналог 3-О-метилглюкоза (3-MG; 32 μCi 3- [3 H] MG/mM; PerkinElmer Life Sciences, Бостън, Масачузетс) и 2 mM манитол (60 μCi [1- 14 C] манитол/mM; PerkinElmer Life Sciences). Веднага след периода на транспортиране, части от RG бяха изрязани от двата задни крайника, попити върху марля, навлажнена със студен KHB, замразени в течност N2 и съхранявани при -80 ° C за по-късен анализ.
3-MG транспорт.
Степента на инсулин-стимулиран скелетен мускул 3-MG транспорт се изчислява, както е описано по-рано (39, 56, 57).
Мускулна хомогинизация за Western blotting.
Частите се изрязват от RG, претеглят се замразени и се хомогенизират в ледено студен хомогенизационен буфер (1:10 тегл./Об.), Съдържащ 50,0 mM HEPES (pH 7,6), 150 mM NaCl, 20 mM Na пирофосфат, 20 mM β-глицерофосфат, 10 mM NaF, 2 mM ортованадат, 2 mM EDTA, 1% IGEPAL, 10% глицерол, 2 mM фенилметилсуфонил-хлорид, 1 mM MgCl2, 1 mM CaCl2, 10 μg/ml левпептин и 10 μg/ml апротинин. След това хомогенатът се прехвърля в епруветка за микроцентрифуга и се центрофугира (19 600 ж, 4 ° C) в хладилна микроцентрифуга (Micromax RF; International Equipment, Needham Heights, MA) за 15 минути. Супернатантата беше събрана, белязана като лизат и изследвана за концентрация на протеин, използвайки метода на Брадфорд (5), адаптиран за използване с Benchmark четец за микроплаки (Bio-Rad, Richmond, CA).
Фракциониране на плазмената мембрана.
Фракциите на плазмената мембрана се приготвят, както е описано по-горе (42). Тази процедура осигурява обогатена фракция на плазмената мембрана и цитозолна фракция, която е лишена от плазмени мембрани (46). Накратко, част от RG беше хомогенизирана в 8 × (тегл./Об.) Ледено студен буфер, съдържащ 20 mM HEPES (pH 7.4), 2 mM EGTA, 50 mM β-глицерофосфат, 1 mM дитиотреитол, 1 mM Na3VO4, 10% глицерол, 3 тМ бензамидин, 10 цМ левпептин, 5 цМ пепстатин А и 1 тМ фенилметилсулфонилфлуорид. Хомогенатът се центрофугира при 100 000 ж за 30 минути при 4 ° С и супернатантата се събира като цитозолна фракция. Пелетата се ресуспендира чрез разбъркване в 4 х (тегл./Об.) Ледено студен хомогенизационен буфер, към който се добавя 1% Triton X. След това ресуспендираната пелета се центрофугира при 15 000 ж за 10 минути при 4 ° С. Супернатантата, представляваща фракцията на плазмената мембрана, беше събрана.
Уестърн блотинг.
Акт2 киназна активност.
активност aPKCζ/λ.
Петстотин микрограма или RG цитозолни или плазмени мембранни протеини се добавят към 4 μg анти-aPKCζ/λ (sc-216; SCBT) и се инкубират една нощ при 4 ° С. Сто микролитра от суспензия, съдържаща зърна Pro-A, се комбинира с всяка от пробите и се инкубира с въртене при 4 ° С в продължение на 1,5 часа. След инкубация пробите се центрофугират (18 300 ж, 4 ° С) в продължение на 10 минути и имунокомплексът се измива, като се използва същия протокол, както е описан за активността на PI 3-киназата (49). След протокола за измиване пробите се центрофугират (18 300 ж, 4 ° С) за 10 минути и супернатантата се изхвърля. След това Pro-A зърната бяха ресуспендирани в 75 μl киназен буфер. Киназната реакция започва чрез комбиниране на 5 μCi [γ- 32 P] ATP (PerkinElmer Life Sciences), 40 μM ATP и 5 μl основен протеин на миелина (M8-184; Sigma-Aldrich, St. Louis, MO). Пробите се завихряха периодично, докато се инкубираха в продължение на 12 минути при 37 ° С. Реакциите бяха спрени чрез добавяне на буфер Laemmli (1: 1). За анализ, 15 μl от пробата/буфер Laemmli се подлагат на SDS-PAGE серия при редуциращи условия на 20% трис-трицинов разделител гел. След електрофорезата геловете бяха увити в найлоново фолио и изложени на фосфорно сито за 8 h. Изображенията бяха заснети и количествено определени, както е описано по-горе.
IRS-1 тирозин и сериново фосфорилиране.
Шестдесет микролитра от суспензия Pro-A, покрита с анти-IRS-1 антитяло (кат. № 06-248; UBT), бяха добавени към 500 μg RG лизатен протеин и инкубирани с ротация при 4 ° C за 2 h . След инкубация пробите се центрофугират (18 300 ж, 4 ° С) за 10 минути и имунокомплексът се промива. Зърната Pro-A се суспендират отново в 30 μl буфер Laemmli, подлагат се на SDS-PAGE върху 7,5% разделителен гел и се прехвърлят в мембрани от поливинилиден дифлуорид, както е описано по-горе. След това мембраните се подлагат на Western blot и протеините се визуализират и определят количествено, както е описано по-горе, като се използва или анти-фосфотирозин (кат. № 02-247; UBT), или анти-фосфо IRS-1 Ser 307 (кат. № 02- 247; UBT) като първично антитяло.
Статистически анализ.
Използван е еднопосочен дисперсионен анализ на всички променливи, за да се определи дали съществуват значителни разлики между групите. Когато значим F е получено съотношение Tukey HSD post hoc, за да се идентифицират статистически значими разлики (P
маса 1. От тази таблица бяха премахнати липидите за телесна маса и мазнини
Стойностите са средни стойности ± SE. NORCON, нормална диета, контролни животни; HFC, диета с високо съдържание на мазнини, контролни животни; HFX, диета с високо съдържание на мазнини, тренирани животни; HFRSG, диета с високо съдържание на мазнини, животни, третирани с розиглитизон; HFRX, диета с високо съдържание на мазнини, третирани с розиглитизон, тренирани животни.
* Значително различен от NORCON (P # значително различен от HFC (P 307 фосфорилирането беше увеличено в сравнение с другите животни (P 307 фосфорилиране беше изразено спрямо концентрацията на IRS-1 протеин беше установено, че сериновото фосфорилиране е повишено (P 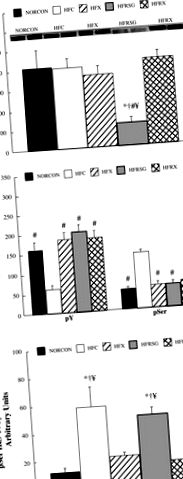
Фиг. 1.Концентрация на протеин на инсулинов рецептор субстрат-1 (IRS-1) (A), IRS-1 тирозин (pY; Б.) и Ser 307 (pSer) фосфорилиране и съотношението на pSer към концентрацията на IRS-1 протеин (° С) в стимулирани от инсулин скелетни мускули, получени от нормална диета, контрол (NORCON); диета с високо съдържание на мазнини, контрол (HFC); диета с високо съдържание на мазнини, тренирана с упражнения (HFX); диета с високо съдържание на мазнини, третирана с розиглитизон (HFRSG); и диета с високо съдържание на мазнини, третирани с розиглитизон, тренирани с упражнения (HFRX) животни. * Значително различен от NORCON (P
Концентрация на протеин Akt2.
Концентрацията на цитозолен Akt2 протеин не се различава при липса или наличие на инсулин сред групите (Фиг. 2A). В допълнение, концентрацията на протеин Akt2 в плазмената мембрана не се различава сред групите нито в отсъствието, нито в присъствието на инсулин (фигБ.).
Фиг. 2.Концентрация на цитозолен Akt 2 протеин (A) и концентрация на протеин Akt2 в плазмената мембрана (Б.), получени от животни от NORCON, HFC, HFX, HFRSG и HFRX. Стойностите са средни стойности ± SE.
aPKCζ и -λ концентрация на протеин.
Концентрацията на цитозолен aPKCζ протеин е сходна сред групите при отсъствие или присъствие на инсулин (Фиг. 3A). По същия начин, концентрацията на цитозолен PKCλ протеин не се различава между групите в отсъствието или присъствието на инсулин, като изключението е HFRX, което е по-голямо от това на групата NORCON при базови условия (P
Фиг. 3.Цитозолна атипична протеинкиназа Cical (aPKCζ) концентрация на протеин и (A) плазмена мембрана aPKCζ протеин концентрация (Б.) от животни от NORCON, HFC, HFX, HFRSG и HFRX. * Значително различен от NORCON (P
Фиг. 4.Концентрация на цитозолен aPKCλ протеин (A) и концентрация на протеин aPKCλ в плазмената мембрана (Б.), получени от животни от NORCON, HFC, HFX, HFRSG и HFRX. * Значително различен от NORCON (P
При липса на инсулин, свързаната с плазмената мембрана aPKCζ протеин концентрация на HFC животни е по-ниска (P
Фиг. 5.Цитозолна активност Akt2 (A), активност на Akt2 на плазмената мембрана (Б.), цитозолна активност на aPKCζ/λ (° С) и активността на aPKCζ/λ на плазмената мембрана (д), получени от животни от NORCON, HFC, HFX, HFRSG и HFRX. * Значително различен от NORCON (P
активност aPKCζ/λ.
Цитозолната активност на aPKCζ/λ при базални условия е сходна сред NORCON, HFC и HFX (Фиг. 5° С). Базалната цитозолна активност на aPKCζ/λ в групите HFRSG и HFRX е повишена (P
Фиг. 6.Концентрация на протеин в цитозолен глюкозен транспортер 4 (GLUT4) (A) и концентрация на протеин GLUT4 в плазмената мембрана (Б.), получени от животни от NORCON, HFC, HFX, HFRSG и HFRX. * Значително различен от NORCON (P
Стимулираният от инсулин метаболизъм на въглехидратите е значително нарушен в скелетните мускули от животни с високо съдържание на мазнини, както се вижда от намалените нива на 3-MG транспорт (43) и концентрацията на протеин GLUT4 в плазмената мембрана в сравнение с животните с нормална диета. Тези наблюдения са в съгласие с редица предишни доклади, които също показват, че диетата с високо съдържание на мазнини намалява транспорта на глюкоза, стимулиран от инсулин (4, 8, 20, 21, 37, 39, 49, 54, 56), PI-3 киназна активност (39, 49, 52, 57) и концентрация на протеин GLUT4 в плазмената мембрана (21, 49, 52, 56, 57) в скелетните мускули на гризачи. Освен това, стимулираните от цитозолен инсулин активности на Akt2 и aPKCζ/λ бяха намалени при животни с високо съдържание на мазнини, въпреки че концентрациите на цитозолни скелетни мускули Akt2, aPKCζ и aPKCλ бяха непроменени. Освен това тези наблюдения са в съответствие с нашия неотдавнашен доклад (23) и тези на други изследователи (30, 39, 52), които също показват, че дейностите на Akt2 и aPKCζ/λ трябва да бъдат намалени при липса на промени в общата концентрация на протеин и фосфорилиране.
По отношение на концентрацията на протеин в плазмената мембрана и активирането на Akt2, не установихме, че инсулинът повишава нито свързаната с плазмената мембрана концентрация на протеин Akt2, нито активността над базалните нива. За разлика от тях, концентрацията на протеини в плазмената мембрана и активирането на aPKCζ и -λ протеин в скелетната мускулатура, хранена с високо съдържание на мазнини, бяха повишени над базалните нива в отговор на инсулин, но стимулираното от инсулин увеличение на плазмената мембрана aPKCζ и -λ и aPKCζ/λ активността в скелетните мускули с високо съдържание на мазнини е по-малка от тази на животните с нормална диета. Тези открития са в съответствие с предишните ни наблюдения (23).
В заключение предоставяме нови доказателства, че храненето с високо съдържание на мазнини не променя концентрациите на цитозолен Akt2 или aPKCζ и -λ протеин в сравнение с консумацията на нормална диета. По-скоро, стимулираните от инсулин цитозолни Akt2 и aPKCζ/λ активности, стимулирани от инсулин плазмени мембрани, свързани с aPKCζ и -λ белтъчни концентрации, aPKCζ/λ активност и концентрация на GLUT4 протеин са намалени при животни с високо съдържание на мазнини. По-специално трябва да се отбележи, че тренировките за аеробни упражнения обръщат ефектите от диетата с високо съдържание на мазнини, така че стимулираното от инсулин разделяне и активирането на компонентите на инсулиновата сигнална каскада са подобни на тези при контролните животни с нормална диета. Розиглитазон не е преодолял индуцираните от диетата увреждания върху метаболизма на глюкозата в скелетните мускули, не е увеличил ефекта от упражненията, а в някои случаи дори е инхибирал положителните ефекти от тренировките. Тези открития предполагат, че хроничните тренировки за упражнения, но не и розиглитазон, могат да преодолеят уврежданията, причинени от високо съдържание на мазнини, в разделянето и активирането на компонентите на инсулиновата сигнална каскада в скелетните мускули.
Това проучване беше подкрепено с безвъзмездни средства от Австралийския изследователски съвет (J. A. Hawley; DP0663862) и Националните здравни институти (B. B. Yaspelkis; GM-48680, GM-08395 и DK-57625).
СТЪПКИ
Разходите за публикуване на тази статия бяха покрити отчасти чрез плащането на такси за страница. Следователно статията трябва да бъде маркирана с „реклама”В съответствие с 18 U.S.C. Раздел 1734 единствено, за да посочи този факт.
Благодарим на GlaxoSmithKline (Stevenage, Великобритания) за подаръка на розиглитазон.
Настоящ адрес за Д. А. Ривас: Група за метаболизъм на упражнения, Факултет по медицински науки, Университет RMIT, Бундура, Виктория, Австралия.
- Ефекти от хранителните добавки с женшен върху затлъстяването, предизвикано от диета с високо съдържание на мазнини, при мишки C57BL6 -
- Обучението за упражнения променя ефекта на храненето с високо съдържание на мазнини върху реакцията на стрес при ACTH при свинете - PubMed
- Улесняване на упражненията Тази 30-минутна тренировка е идеална за начинаещи
- Упражнявайте 15 минути на ден, увеличавайки продължителността на живота с 3 години - Harvard Health
- Упражнение 1 час на ден, за да се избегне увеличаване на теглото
