Субекти
Резюме
Заболяване за съхранение на гликоген (GSD) тип III (OMIM 232400) се дължи на дефицит на гликоген деранширащ ензим (GDE; EC 3.2.1.33), кодиран от AGL ген. Очакваната честота на заболяването се оценява на 1: 100 000 живородени деца. Клиничните форми на заболяването включват предимно чернодробна форма (хепатомегалия, хипогликемия и хипертриглицеридемия) и мускулна форма (миопатия и кардиомиопатия) (1).
Въпреки че понастоящем липсват доклади от естествената история, заболяването за съхранение на гликоген тип III (GSD III) е свързано с благоприятен резултат за чернодробните форми, тъй като диетичното управление е по-малко строго от другите GSD, като GSD тип I (глюкоза-6-фосфатаза дефицит), докато мускулните форми са свързани с висока заболеваемост и смъртност главно поради кардиомиопатия, източник на сърдечна недостатъчност и внезапна смърт (1–3).
Няма консенсус относно управлението на GSD III. Обичайните препоръки обаче включват често хранене с високо съдържание на въглехидрати през деня и сурово царевично нишесте или непрекъснато хранене през нощта (4), които предотвратяват ефективно хипогликемия на гладно, но не влияят обикновено върху хода на сърдечните и мускулните прояви.
Целта на това проучване е да се оцени потенциалът на d, l-3-хидроксибутират (3OHB) заедно с кетогенна и високо протеинова диета по време на 24 месеца за подобряване на тежката кардиомиопатия, дължаща се на GSD III, при бебе на 2 месеца.
Търпелив.
2-месечно мъжко бебе от африкански произход, представено с хипертрофична кардиомиопатия. Поради родителско кръвно родство и фамилна анамнеза за сестра, починала на 11 месеца от тежка кардиомиопатия поради GSD III, диагнозата бързо се установява при раждането. По-голямата му сестра представи на възраст 8 месеца хипогликемия, хепатомегалия, свързана с повишаване на аспартат трансаминаза (AST) и аланин трансаминаза (ALT), и хипертрофична кардиомиопатия, свързана с високи нива на креатин киназа (CK). Тя е била лекувана с често хранене и непрекъснато ентерално хранене през нощта, за да се предотврати хипогликемия. Кардиомиопатията се влошава бързо през първия месец от лечението. Поради няколко епизода на тахикардия, тя е била лекувана с ацебутолол. Месец по-късно кардиомиопатията остава непроменена, но тахикардията отзвучава. В крайна сметка тя почина на 11 месеца от сърдечен арест.
Измерването на ензимната активност показва липса на GDE активност в пресни левкоцити, докато молекулярният анализ идентифицира c.2157 + 1G> T хомозиготна сплайсинг мутация в интрон 16-17 от AGL ген. Тази вариация на последователността не е докладвана преди, но се предвижда да повлияе на мястото на донора на снаждане и по този начин да бъде патогенна.
Освен асимптоматичната хипертрофична кардиомиопатия, момчето, подобно на сестра си, показва хепатомегалия, хипогликемия на гладно и хипертриглицеридемия, които се управляват от конвенционален диетичен подход с чести хранения и непрекъснато нощно хранене през назогастрална сонда. 24-часов запис на Холтер-ЕКГ не показва нарушение на сърдечния ритъм.
Тъй като състоянието на сестрата се влошава бързо при високо въглехидратна диета, ние предположихме, че последната може да влоши кардиомиопатията при GSD III чрез засилване на натрупването на гликоген, както се съобщава в литературата (5,6).
Освен това предположихме, че високата секреция на инсулин, предизвикана от диета с високо съдържание на въглехидрати, може да инхибира липолизата и по този начин енергийната наличност за сърцето чрез намаляване на образуването на ацетил-КоА и кетонни тела чрез окисляване на мастните киселини (FAO). Следователно решихме да намалим приема на въглехидрати, за да ограничим натрупването на гликоген и да увеличим приема на липиди, за да подобрим FAO и кетогенезата. За да се поддържат нормални нива на глюкоза в плазмата, ние предложихме да засилим неоглюкогенезата чрез увеличаване на наличността на глюконеогенни субстрати като глицерол (от кетогенната диета) и аминокиселини чрез високо протеинова диета. И накрая, въведохме d, l-3-хидроксибутират като алтернативен енергиен субстрат за сърцето.
МЕТОДИ
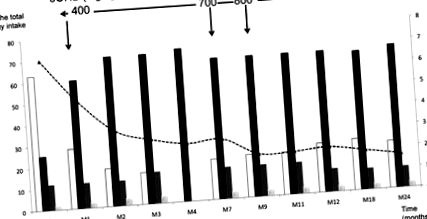
Започнахме пациента на диета, осигуряваща 65% енергия от липиди, 15% от протеини и 20% от глюкоза (за подробен състав на диетата, вижте Таблица 1). Използвахме непрекъснато хранене през назогастрална сонда през първите 6 месеца, за да избегнем хипогликемия поради ниския прием на глюкоза. От месец 7 въведохме орално хранене и до месец 12 детето получи четири хранения и нощно хранене. 3OHB е започнал с доза 400 mg/kg/d, давана на всеки 3 часа, както беше съобщено по-рано (7). Фигура 1 показва модификациите на диетата по време на проучването при прием на въглехидрати, липиди и протеини, изразени в% от общия енергиен прием (TEI) по време на 24 месеца от проучването и прогресивното увеличаване на дозата на 3OHB до 800 mg/kg /д. Приемът на въглехидрати е драстично намален от 65 на 20% от TEI (4 g/kg/d), докато приемът на липиди и протеини е увеличен до 65% (6 g/kg/d) и 15% (3 g/kg/г) съответно.
Промяна в приема на въглехидрати (□), липиди (▪) и протеини (), изразени в% от общия енергиен прием (лява ос), в протеини, изразени в g/kg (излюпени колони, лявата ос) и в скоростта на глюкозата в mg/kg/min (черна пунктирана крива, дясна ос) по време на изпитанието. Стрелки посочете дозите на 3OHB по време на изпитването.
Клинични и биологични оценки се провеждат на всеки 3 месеца, включително растеж, размер на черния дроб (клинично и чрез ултразвук), чернодробни трансаминази, креатин-киназа, плазмена глюкоза, лактат, 3-OH бутират, ацетоацетат, FFA и серумни нива на инсулин. Сърдечната оценка е направена чрез ултрасонография, стандартна ЕКГ и 24-часов монитор с Холтер-ЕКГ. A Z.-резултатът се изчислява за всяко измерване на интервентрикуларната преграда.
Получено е информирано съгласие от родителите и проучването е одобрено от нашия Институционален съвет за преглед (Conseil d'Ethique, Necker-Enfants Malades).
РЕЗУЛТАТИ
Диетата и лечението с 3OHB се понасят добре. Не се наблюдава по-нататъшна хипогликемия, въпреки че нощната скорост на глюкоза е спаднала под 2 mg/kg/min по време на 24-месечно проследяване.
Кардиомиопатията се подобри. Дебелината на интервентрикуларната стена (IVW) значително намаля от a Z.-резултат от 7,4 до a Z.-резултат от 3,6 в края на изследването (фиг. 2). Въпреки това между mo 6 и mo 14 се наблюдава преходно увеличение на дебелината на IVW. Това съвпадна с намаляване на плазмените кетонни тела и беше обърнато след увеличаване на добавките с 3OHB от 400 на 800 mg/kg/ден. На ЕКГ амплитудата на Q вълните и индексът на Sokolow намаляват и не се наблюдава нарушение на сърдечния ритъм.
Промяна в дебелината на интервентрикуларната стена, изразена в mm (черна крива) и като Z.-оценки на резултатите (тъмносива пунктирана крива). Показани са средни, -2 SD и +2 SD криви (светлосиви пунктирани извивки).
Мускулният тонус остава нормален, както и мускулната сила и детето показва нормално двигателно развитие и ходи неподдържано на 12 месеца. Соматичният растеж остава нормален (на 2 години).
Размерът на черния дроб се увеличава през първите 6 месеца от лечението и след това остава стабилен по време на проучването. Чернодробните ензими, въпреки че са повишени (2,5 пъти както за ALT, така и за AST), остават стабилни по време на проучването. Не се наблюдава промяна в гама глутамил транспептидаза (gGT) и алфа-фетопротеин и не са открити ехографски промени в черния дроб.
Първоначално нивата на креатин-киназата бяха повишени (520 U/L; горен референтен диапазон, 180) и се увеличиха до максимум 720 U/L през първите 3 месеца и след това намаляха през следващите 9 месеца до първоначалните нива. Стойностите на глюкозата и инсулина в плазмата намаляват по време на проучването (медиана на глюкозата: 4,5 тМ преди и 3,8 тМ след лечение; инсулин: 4 mU/L преди и 1,8 mU/L след лечение), докато средните нива на лактат остават стабилни (медиана 1,4 тМ) въпреки че преди лечението не са регистрирани високи стойности, за разлика от това, което обикновено се наблюдава при пациенти, засегнати с GSD III. Кетонните тела (3-OH бутират и ацето-ацетат) и FFA се увеличават в плазмата, както се очаква (Фиг. 3). Холестеролът е нормален, но първоначално стойностите на триглицеридите са повишени (холестерол: 3 тМ; горен референтен диапазон: 4,5 тМ; и триглицериди: 2,9 тМ; горен референтен диапазон: 1 тМ) и остават стабилни по време на проучването.
Промяна в общите кетонни тела (KB, mmol/L, черна пунктирана крива) и FFA (FFA, g/L, сива крива) нива по време на проучването.
ДИСКУСИЯ
Ние съобщаваме за използването на синтетични кетонни тела във връзка с кетогенна и високопротеинова диета при бебе на 2 месеца, носещо тежка фамилна хепатомускулна форма на GSD III, усложнена с кардиомиопатия и водеща до ранна смърт при неговия брат или сестра. Наблюдавахме подобрение на кардиомиопатията при нашия пациент и никакви допълнителни усложнения, свързани със сърцето, през 24 месеца от проучването. Освен това нашият пациент не е развил никакви мускулни симптоми до момента.
Кетогенната диета и добавките с кетонни тела доведоха до постоянна кетоза при нашия пациент. d, l-3-хидроксибутират преди това успешно се използва за лечение на кардиомиопатия при множествен дефицит на ацил-КоА дехидрогеназа, нарушение на окисляването на мастните киселини, свързано с липса на кетоза (7). Други доклади подчертават значението на кетонните тела за сърдечния метаболизъм чрез увеличаване на активността на сукцинат дехидрогеназата и по този начин изхода на дихателната верига (8) или техните кардиопротективни ефекти след коронарна исхемична болест (9). Предполагаме, че диетата и d, l-3-хидроксибутират, като по този начин улесняват генерирането на АТФ от FAO и кетолизата, може да са допринесли за подобряване на кардиомиопатията.
Преходното увеличение на дебелината на IVW, което се наблюдава между mo 6 и mo 14, е свързано с намаляване на нивата на кетоза, което се коригира от увеличаването на дозите d, l-3-хидроксибутират (от 400 на 800 mg/kg/г) докато диетата остава непроменена. Последното предполага, че кетозата може да намали прогресията на кардиомиопатията.
Диетата с ограничена глюкоза доведе до намалени нива на инсулин и вероятно до намаляване на натрупването на гликоген в сърцето, както е показано в животински модел на инхибиране на GDE, където високите нива на инсулин и лактат водят до увеличаване на 50% от съхранението на гликоген ( 10).
Плазмените нива на глюкоза остават в рамките на нормалните граници, въпреки драматичното намаляване на приема на въглехидрати, вероятно поради засилване на глюконеогенезата от високите нива на глицерол и протеини, осигурени от диетата и постоянната кетоза. Интересното е, че в скорошен доклад кардиомиопатията също се е подобрила при пациент с GSD III, когато е започнал да получава богата на протеини диета (11). Това е така и при мускулните симптоми, подобряващи се при богата на протеини диета в предишни доклади (12,13).
Не са отбелязани странични ефекти, включително нива на холестерол и триглицериди, които остават стабилни по време на проучването. Размерите на черния дроб и чернодробните ензими остават стабилни и не се наблюдават промени при ултразвуково изследване, което показва, че диетата може да бъде полезна и за черния дроб.
CK намалява, но остава повишен, въпреки че изглежда не съществува никаква връзка между патологичните промени в мускулите и нивата на CK при GSD III (14).
В заключение докладваме за нова концепция за лечение на GSD III с d, l-3-хидроксибутират, кетогенна и високобелтъчна диета, която е свързана с подобряване на кардиомиопатията, тежко и фатално усложнение на заболяването, настъпило при брат или сестра. Тъй като обаче това е проучване с един пациент, не можем да потвърдим, че нашите открития се дължат единствено на нашите терапевтични интервенции и не могат да бъдат свързани с вариабилността на заболяването дори в рамките на едно и също семейство. По този начин тези обнадеждаващи данни трябва да бъдат потвърдени при повече пациенти с GSD III с кардиомиопатия или мускулни симптоми.
- Paget; s костно заболяване - Лечение - NHS
- PRIME PubMed Метаболитна дисфункция, свързана с мастна чернодробна болест, увеличава риска от тежък Covid-19
- Млечен трън за лечение на безалкохолна мастна чернодробна болест Хепатит Месечен пълен текст
- Симптоми, лечение и профилактика на болестта на малките съдове
- Смесени симптоми на болестта на съединителната тъкан, причини и лечение