От Ксавие Фиорамонти и Люк Пенико
Изпратено: 16 октомври 2018 г. Преглед: 3 юли 2019 г. Публикувано: 8 август 2019 г.
Резюме
Дори размерът му да е сравнително малък (около 2% от телесното тегло), мозъкът консумира около 20% от цялата телесна енергия. Докато органи като мускули и черен дроб могат да използват няколко източника на енергия, при физиологични условия мозъкът зависи главно от глюкозата за своите енергийни нужди. Това включва необходимостта нивото на глюкоза в кръвта да бъде строго регулирано. По този начин, в допълнение към ролята си на гориво, глюкозата играе роля на сигнална молекула, информираща мозъка за всяка малка промяна в нивото на кръвта, за да осигури глюкозната хомеостаза. В тази глава ще опишем горивните и чувствителни свойства на глюкозата и другите въглехидрати в мозъка и ще представим някои физиологични мозъчни функции, повлияни от тези захари. Също така ще подчертаем научните въпроси, на които трябва да се отговори, за да се разбере по-добре въздействието на захарите върху мозъка.
Ключови думи
- мозък
- глюкоза
- фруктоза
- прием на храна
- глюкозо-чувствителни неврони
информация за глава и автор
Автори
Ксавие Фиорамонти *
- Университет на Бордо, INRA, Бордо INP, NutriNeuro, UMR 1286, Франция
Люк Пенико
- UMR STROMALab, Университет на Тулуза, CNRS ERL5311, EFS, INP-ENVT, Inserm U1031, UPS, Франция
* Адресирайте цялата кореспонденция на: [email protected]
От редактирания том
Редактирани от Clémentine Bosch-Bouju, Sophie Layé и Véronique Pallet
1. Въведение
Мозъкът на бозайниците по същество зависи от глюкозата за своите енергийни нужди. Тъй като невроните имат най-голямо енергийно търсене в мозъка на възрастните, те се нуждаят от непрекъснато доставяне на глюкоза от кръвта. При човека мозъкът представлява
2% от телесното тегло, но използва
20% от енергията, получена от глюкоза, което я прави основният консуматор на глюкоза [1]. В резултат на това строгата регулация на метаболизма на глюкозата е от решаващо значение за мозъчната физиология. Демонстрирана е фина верига за обратна връзка между мозъка и различните органи и тъкани, която позволява при нормални условия да поддържа нивото на глюкозата в кръвта доста постоянно около 1 g/l (7-8 mM) в кръвта и
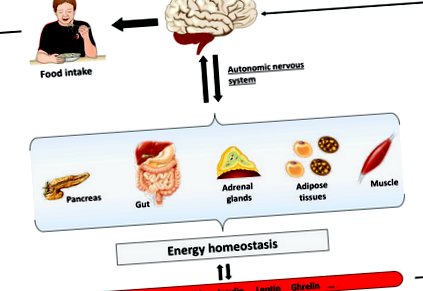
2 mM в мозъка (вж. По-долу раздел 5) [2, 3]. Мозъкът се нуждае от точна и ясна обратна връзка за метаболитното състояние на цялото тяло [4]. За да се постигне тази цел, различни мозъчни области, особено мозъчния ствол и хипоталамуса, интегрират периферни сигнали, доставяни от невронния вход от различни органи, както и от метаболити (глюкоза, мастни киселини) и хормони (лептин, инсулин, грелин) чрез кръвта [2, 3, 4]. По този начин са описани специализирани чувствителни на хранителни вещества и хормони неврони, при които скоростта на стрелба варира в отговор на промените в извънклетъчните хранителни вещества или концентрацията на хормони. В отговор мозъкът ще генерира подходящ отговор чрез модулиране на приема на храна и активността на периферните органи чрез автономната нервна система, за да поддържа енергийния статус и хомеостазата на глюкозата (Фигура 1). По този начин в тази глава ще опишем, че в централната нервна система глюкозата има двойна роля и се счита за подхранващ, както и за чувствителен метаболит за осигуряване на глюкозната хомеостаза и подходящо зареждане на мозъчните клетки.
Фигура 1.
Роля на мозъка в контрола на енергийната хомеостаза. Мозъкът интегрира периферни сигнали, доставяни чрез невронни входове от различни органи, както и от метаболити (глюкоза и мастни киселини) и хормони (лептин, инсулин и грелин) чрез кръвта. В отговор мозъкът генерира подходящ отговор чрез модулиране на приема на храна и активността на периферните органи чрез автономната нервна система, за да поддържа енергийната хомеостаза.
Трябва обаче да се има предвид, че предвид диетичните мутации, настъпили през последните десетилетия, захарите, различни от глюкозата, са част от нашата диета и могат да повлияят на зареждането и усещането на мозъка. Такъв е случаят например с фруктозата. Фруктозата и глюкозата са доста прости молекули, но има разлики в начина, по който тялото ги обработва. Това определено е вярно за начина, по който мозъкът използва и реагира на тях. Тези разлики могат да обяснят последствията, наблюдавани след висока консумация на фруктоза, върху приема на храна и метаболизма на глюкозата в цялото тяло.
2. Мозъчен контрол на гликемията
При хората стойността за нормогликемия е около 1 g/l. Въпреки че ендокринният панкреас е основният регулатор на нивото на глюкозата в кръвта чрез секрецията на инсулин и глюкагон, мозъкът играе основна роля в контрола на гликемията. Това се постига чрез различни пътища, включващи вегетативната нервна система и нейната проекция към няколко органа и тъканите, като ендокринната панкреаса, надбъбречната жлеза, черния дроб, скелетните мускули и белите и кафявите мастни тъкани. Както е илюстрирано на фигура 2, в случай на спад в кръвната глюкоза, има активиране на симпатиковите нерви и следователно увеличаване на секрецията на глюкагон от алфа клетките и намаляване на тази на инсулина от бета клетките на панкреаса, както и като увеличаване на секрецията на епинефрин и кортизол от надбъбречната жлеза. Тези промени в нивата на хормоните, заедно с директен ефект на симпатиковата система, ще доведат до повишено производство на глюкоза от черния дроб и намалено използване на глюкоза от мастните натрупвания и мускулите, което води до нормализиране на кръвната захар.
Фигура 2.
Невроендокринни пътища, участващи в контрарегулаторния отговор на хипогликемия. Намалената кръвна глюкоза се открива от централните (хипоталамус и заден мозък) и периферните (панкреас, хепатопортална вена и каротидно тяло) глюкозни сензори. Заедно тези глюкозни сензори координират физиологичните реакции, които повишават нивата на кръвната захар. Първоначалният отговор на хипогликемия включва активиране на автономната нервна система (ANS), инхибиране на секрецията на инсулин и стимулиране на хипофизната секреция на ACTH. Активирането на автономната нервна система увеличава секрецията на глюкагон и епинефрин от панкреаса и надбъбречната медула, съответно. ACTH стимулира освобождаването на кортизол от надбъбречната кора. Повишеният глюкагон, епинефрин и кортизол заедно с намаления инсулин стимулират производството на чернодробна глюкоза и намаляват усвояването на мастна и мускулна глюкоза. Нетният резултат от невроендокринния контрарегулаторен отговор на хипогликемия е повишаване на нивата на кръвната глюкоза и възстановяване на евгликемията.
3. Глюкоза: горивото на мозъчните неврони
Мозъчната функция и метаболизмът на глюкозата са тясно свързани [1]. Всъщност глюкозата е основният, ако не и единственият енергиен субстрат на този орган. Хипогликемията (под 0,7 g/l) причинява бързи мозъчни последици, но за щастие, по-голямата част от времето бързо се възстановява след корекция на хипогликемията. По отношение на хипергликемията, остри ситуации като кетоацидоза и хиперосмоларност могат да доведат до кома със значителна смъртност. Хроничните ефекти на хипергликемията върху мозъка остават неясни, освен риска от исхемичен инсулт. Микроангиопатията обаче е тясно свързана с хронична хипергликемия и може да причини необратими дифузни съдови лезии и церебрална исхемия, което води до атрофия на кората и диабетна енцефалопатия.
Мозъкът използва глюкозата като основен източник на енергия, въпреки че може да използва други метаболити (главно кетонни тела) в специални ситуации като гладуване. Той има много висока консумация на енергия за своя размер, главно поради голямото енергийно снабдяване, необходимо за поддържане на функциите му (потенциална разлика между мембраните на нервните клетки, транспорт по аксони и дендрити, пластичност на тъканите и възстановяване).
След като се транспортира в клетката, глюкозата се фосфорилира от хексокиназа, ензим с толкова висок афинитет към глюкозата, че бързо трансформира глюкозата в глюкозо-6-фосфат. Глюкоза-6-фосфатът се метаболизира допълнително, главно в гликолитичния път, където се превръща в пируват. Глюкоза-6-фосфатът също е субстрат за пентозофосфатния шунт и генерирането на гликоген само в глиалните клетки. Пируватът се метаболизира или в цикъла на Кребс след транспортиране в митохондриите, или се превръща в лактат с помощта на лактат дехидрогеназата. Голяма част от пирувата, транспортиран в мозъчните митохондрии, е посветен на окислителното фосфорилиране на ADP до ATP.
Енергийното снабдяване на мозъка се осигурява от кръвоносните съдове. В повечето мозъчни структури тези съдове са заобиколени от кръвно-мозъчна бариера, която не позволява на молекулите да преминат през нея и като следствие изолира мозъка от кръвоносната мрежа. При тези условия вложената енергия е отчасти непряка и отчасти преминава през клетките, които съставляват тази бариера, а именно астроцитите [9]. Тези клетки могат да съхраняват енергия като гликоген или да я трансформират като лактат. Тази енергия се освобождава при поискване, когато невроните се нуждаят от нея [10]. Този лактат се произвежда в астроцитите чрез разграждане на глюкозата в пируват, когато невроните се нуждаят от него. След това лактатът се изпраща до неврони, които синтезират пируват и го използват в цикъла на Кребс. Тази роля на астроцитите и лактата като основен енергиен субстрат на невроните все още е предмет на дискусии.
4. Глюкоза: сигнална молекула за мозъка
В предишната част обсъдихме факта, че мозъкът разчита на глюкозата, за да функционира. Това предполага, че нивото на глюкозата в кръвта трябва да остане стабилно. Всяко намаляване на нивото на глюкозата в кръвта би имало непосредствени последици върху мозъчните функции. Повишеното ниво на кръвта няма да има остри последици, но продължителната хипергликемия ще бъде вредна в дългосрочен план, както се наблюдава при пациенти с неконтролиран захарен диабет. Мозъкът играе критична роля в регулирането на нивото на глюкозата в кръвта, за да осигури хомеостаза на глюкозата в цялото тяло. По този начин, за да може да контролира нивото на кръвната глюкоза, мозъкът трябва да може да усети всяка промяна. В тази част ще обсъдим идеята, че глюкозата е повече от зареждаща молекула и тя е в състояние да играе ролята на сигнална молекула в някои неврони или мозъчни клетки, наречени глюкозо-чувствителни клетки.
Глюкозосензорни неврони: Първата хипотеза, че специализираните клетки в мозъка могат да открият промени в нивото на глюкозата, произхожда от проучвания на групите на Oomura 'и Anand, в които те показват, че невроните в хипоталамуса имат електрическа активност, модифицирана в отговор на интравенозно инжектиране на глюкоза [11, 12]. Въпреки че тези проучвания предполагат, че невроните, способни да откриват глюкоза, присъстват в мозъка, те не доказват, че глюкозата може директно да повлияе на тези неврони, тъй като глюкозата се инжектира интравенозно. Така по-късно Oomura демонстрира присъствието на специализирани глюкозо-чувствителни неврони, показвайки, че директното прилагане на глюкоза в страничния хипоталамус на плъхове променя активността на специфични неврони [13]. Тези така наречени глюкозо-чувствителни неврони сега се определят като клетки, способни да адаптират своята електрическа активност в отговор на промените в извънклетъчното ниво на глюкоза. По дефиниция глюкозно-възбудените (GE) неврони увеличават своята електрическа активност, докато инхибираните от глюкоза (GI) неврони намаляват своята активност, когато нивото на глюкозата се повиши. Като противопоставяне, когато нивото на глюкозата намалява, GE невроните намаляват своята електрическа активност, докато GI невроните я увеличават (Фигура 3).
Фигура 3.
Схематично представяне на електрическата активност на глюкозо-чувствителните неврони в отговор на промените в нивото на глюкозата. Възбудените с глюкоза (GE) неврони увеличават своята електрическа активност (деполяризация и повишена честота на потенциал за действие), докато инхибираните от глюкоза (GI) неврони намаляват своята активност (хиперполяризация и намалена скорост на изгаряне), когато нивото на глюкозата се повиши. Като противопоставяне, когато нивото на глюкозата намалява, GE невроните намаляват своята електрическа активност, докато GI невроните я увеличават. Съкращения: глюкоза или glc, извънклетъчно ниво на глюкоза; Vm, базален мембранен потенциал.
Важно е да се отбележи, че глюкозо-чувствителните неврони използват глюкозата не само като гориво, но и като сигнална молекула, която модулира тяхната електрическа активност. Освен това трябва да се спомене, че глюкозо-чувствителните неврони директно откриват промени в нивото на глюкозата, а не чрез непряка пресинаптична модулация. И накрая, отговорите им на намаленото ниво на глюкоза се различават от заглушаването на „изчерпаното гориво“ на всеки неврон от нефизиологични ниски нива на глюкоза.
Ниво на глюкоза в мозъка: Идеята, че по дефиниция глюкозо-чувствителните неврони реагират на физиологични промени в нивото на глюкоза в мозъка, повдига въпроса за нивото на глюкозата в мозъка. Нивото на мозъчната глюкоза е процес, фино регулиран от GLUT1, глюкозният транспортер, изразен в BBB. Високият афинитет на този транспортер (KM = 2-3 мМ) към глюкозата оправдава нивото, открито в мозъка, което е около 30% от нивото в кръвта. По този начин, няколко проучвания, използващи методи за електроди с глюкоза оксидаза или метод за нулев нетен поток за микродиализа, постоянно показват, че физиологичните нива на глюкоза в мозъка варират в доста тесни граници от 0,7 до 2,5 mM. От друга страна, извънклетъчните нива на глюкоза в мозъка под 0.7 mM и над 2.5 mM са свързани съответно патологична хипо- и хипергликемия. Такъв е случаят във всички мозъчни области, където е измерен, включително хипоталамус, хипокампус и стриатум например [14, 15, 16, 17, 18] (Фигура 4).
Фигура 4.
Извънклетъчни нива на глюкоза в мозъка спрямо нивата на глюкоза в плазмата. Плазмените нива на глюкоза от около 2–4 mM (50–80 mg/dl), наблюдавани по време на хипогликемия, корелират мозъчните нива от около 0,1–1 mM. Плазмените нива от около 5–8 (80–120 mg/dl) са свързани с нивата, наблюдавани по време на вариация между храненията и се свързват с мозъчните нива от около 2–2,5 mM. Плазмените нива на глюкоза над 8 mM или 140 mg/dl се наблюдават по време на неконтролирана хипергликемия и корелират с мозъчно ниво над 3 mM, но не надвишаващо 4,5–5 mM. Адаптирано от Реф. [19].
Глюкозно-чувствителните неврони могат да бъдат намерени в извънхипоталамусните области (Фигура 5). Доколкото ни е известно, HGE и HGI невроните са открити само в така наречените циркумтрикуларни органи, мозъчни области, където BBB се фенестрира, включително областта на пострема на задния мозък, субфоничния орган и съдовия орган на lamina terminalis. Всички останали мозъчни области, където е открито глюкозно засичане, представят неврони, модулирани от глюкозни промени под 2,5 mM глюкоза. Това повдига въпроса за физиологичната роля на тези неврони в тези извънхипоталамусни области. Една от хипотезите е, че тези неврони, намиращи се на различни места в мозъка, откриват намалено ниво на глюкоза, което може да бъде свързано с хипогликемия. Те могат да играят ролята на детектори за наличност на енергия и да информират за потенциална „криза“, тъй като глюкозата е основното гориво на невроните и нейното мозъчно ниво трябва да бъде контролирано фино. Независимо от това, не можем да изключим тези неврони да участват във физиологични функции, включително памет, обоняние на мотивацията, с оглед на тяхното местоположение в области като хипокампус, стриатум, обонятелна крушка например. Все още е необходима значителна работа, за да се разберат напълно функциите, контролирани от тези хипоталамусни или екстра-хипоталамусни неврони.
Фигура 5.
Местоположение на мозъчните глюкозо-чувствителни неврони. Схематично представяне на сагитален парче на мозъка на гризач с различни области, където са открити глюкозо-чувствителни неврони. Съкращения: AMG, амигдала; AP, област postrema; ARC, дъговидно ядро; DMNX, дорзално двигателно ядро; DMN, дорзомедиално ядро; HippoC, хипокампус; LC, locus coeruleus; LH, страничен хипоталамус; NTS, единично ядро; OB, обонятелна крушка; PBN, парабрахиално ядро; PFC, префронтална кора; PO, преоптична зона; PVN, паравентрикуларно ядро; RP, Raphe pallidus; SFO, подформен орган; VMN, вентромедиално ядро; VTA, вентрална тегментална област.
Глиалните клетки също са способни да откриват глюкозата: Астроцитите представляват основния клас макроглиални мозъчни клетки и заемат около 50% от общия мозъчен обем. Отвъд ролята си на структурни невронални поддържащи клетки, астроцитите вече са признати да участват действащо в мозъчната хомеостаза и да участват във все по-голям брой функции, включително невронална пролиферация, синаптогенеза, синаптично предаване и невротрансмитерна хомеостаза, както и невронално зареждане и чувствителност на хранителни вещества.
5. Въздействието на други захари върху мозъка: пример за фруктоза
Моделите на консумация на захар се промениха значително през последните десетилетия. Глюкозата не е единственият монозахарид, присъстващ в храната ни, който може да премине чревната бариера и да присъства в кръвния поток. Фруктозата е другият основен монозахарид, който ядем. Фруктозата е партньор на глюкозата в захарозата, която консумираме. В допълнение към естественото си присъствие в плодовете и меда, той присъства и в содата, бисквитите и всички видове преработени храни. По този начин, докато консумацията на фруктоза беше
- Мозъчно стареене, познание и диета Преглед на нововъзникващите роли на хранителни ноотропи в
- 7 начина, по които вашият ИТМ може да повлияе на резултатите от пластичната хирургия
- 30-дневно приложение за отслабване Трябва да загубя 20 кг бърза военна диета 4 дни почивка 1200 калории Въздействието
- 30 паунда за 2 седмици Най-добрите диетични хапчета The Impact Genome Project®
- Алергична тревожност, мозъчна мъгла, ГЕРБ, здраве на червата и периодично гладуване Свързване на точките по време