Алексей Гладчук
1 Институт по токсикология, Федерална медико-биологична агенция на Русия, 192019 г. Санкт Петербург, Русия; moc.liamg@42dalgela (A.G.); ur.liam@tkelana (I.A.); [email protected] (E.P.)
Юлия Шумилина
3 Катедра по биоорганична химия, Лайбниц институт по растителна биохимия, 06120 Хале, Германия
Алена Куснецова
Ксения Бурейко
3 Катедра по биоорганична химия, Лайбниц институт по растителна биохимия, 06120 Хале, Германия
Сюзън Билиг
4 Институт по аналитична химия, Факултет по химия и минералогия, Университет Лайпциг, 04103 Лайпциг, Германия; ed.gizpiel-inu@gillib (S.B.); ed.gizpiel-inu.eimehc@reyemekrib (C.B.)
Александър Царев
3 Катедра по биоорганична химия, Лайбниц институт по растителна биохимия, 06120 Хале, Германия
Ирина Александрова
1 Институт по токсикология, Федерална медико-биологична агенция на Русия, 192019 г. Санкт Петербург, Русия; moc.liamg@42dalgela (A.G.); ur.liam@tkelana (I.A.); [email protected] (E.P.)
Лариса Леонова
Владимир А. Жуков
5 Всеруски изследователски институт по селскостопанска микробиология, 196608 Санкт Петербург, Русия; [email protected] (V.A.Z.); ur.xednay@8002mairra (I.A.T.)
Игор А. Тихонович
5 Всеруски изследователски институт по селскостопанска микробиология, 196608 Санкт Петербург, Русия; [email protected] (V.A.Z.); ur.xednay@8002mairra (I.A.T.)
6 Катедра по генетика и биотехнологии, Държавен университет в Санкт Петербург, 199034 Санкт Петербург, Русия
Клаудия Биркемайер
4 Институт по аналитична химия, Факултет по химия и минералогия, Университет Лайпциг, 04103 Лайпциг, Германия; ed.gizpiel-inu@gillib (S.B.); ed.gizpiel-inu.eimehc@reyemekrib (C.B.)
Екатерина Подолская
1 Институт по токсикология, Федерална медико-биологична агенция на Русия, 192019 г. Санкт Петербург, Русия; moc.liamg@42dalgela (A.G.); ur.liam@tkelana (I.A.); [email protected] (E.P.)
7 Институт за аналитична апаратура, Руска академия на науките, 198095 Санкт Петербург, Русия
Андрей Фролов
3 Катедра по биоорганична химия, Лайбниц институт по растителна биохимия, 06120 Хале, Германия
Свързани данни
Резюме
1. Въведение
Мастните киселини (FA) представляват един от най-важните класове метаболити в живите организми [1]. Всъщност, от една страна, тези съединения лесно участват в широк спектър от ензимни реакции, като се получават естери на алифатни, циклични и ароматни алкохоли, определящи структурата на мембранните и съхраняващи липиди [2]. От друга страна, в неестерифицираната форма, ФА служат като предшественици на хормони и модулатори - ключови играчи на регулаторните пътища на растенията [3] и животните [4], участващи във всички жизненоважни физиологични реакции. Не по-малко важна е ролята на свободните мастни киселини (FFA) като нискомолекулни ефектори, участващи пряко в имунните реакции във всички царства на живите организми [4]. Следователно FFAs привличат специално внимание на много биолози и анализатори [5].
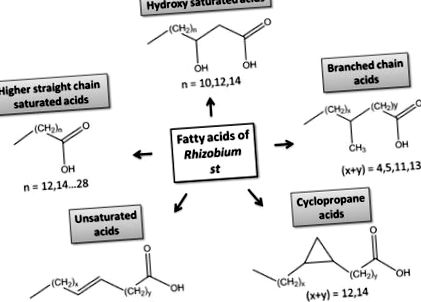
Структурни класове на бактериални мастни киселини.
В съвременната биоаналитична химия анализът на състава на FFA най-често разчита на газова хроматография - масспектрометрия (GC-MS) [11]. Докато летливите киселини с къса верига могат да бъдат анализирани чрез техники за инжектиране в главното пространство [12], дълговерижните киселини могат да бъдат оценени чрез инжектиране на течност след подходяща дериватизация [13]. Последният подход, разчитащ на откриване на метилови или триметилсилилови естери, се оказа ефективен при анализ на разклонени мастни киселини в бактериалните мембрани [14]. Прилагането на процедури за дериватизация в експериментални работни процеси намалява драстично пропускливостта на пробите и може да предизвика трансестерификация на липидите, както и изомеризация и окисление на ненаситени FFA [15,16]. Въпреки че хидрофилно взаимодействие [17] и течностна хроматография с обърната фаза (HILIC и RP-LC, съответно) [18], свързани онлайн с електроспрей йонизационна масспектрометрия (ESI-MS) или тандем MS (MS/MS) в множество режим на мониторинг на реакцията (MRM) [19] може да се използва и за количествено определяне на FFAs, тези техники нямат чувствителност или покритие на метаболоми на мастни киселини в сравнение с традиционните работни процеси, базирани на GC-MS [20].
Тези тесни места на GC-MS- и LC-MS-базирани подходи за FA анализ могат да бъдат ефективно преодолени чрез прилагане на матрично подпомогната лазерна десорбция/йонизация-време на полетна масова спектрометрия (MALDI-TOF-MS) в комбинация с Langmuir-Blodgett технология [21]. Наскоро показахме, че филмите на Лангмюр – Блоджет могат не само да бъдат ефективно приложени при селективно обогатяване на фосфопептиди [22], протеинови адукти на органофосфорни съединения [23] и хлорирани инсектициди [24], но също така се оказаха ефективно средство за високо -пропускливост и чувствителни пръстови отпечатъци на свободни мастни киселини като техните бариеви монокарбоксилати в режим на положителен йон [25]. Следователно тук ние прилагаме този подход в новоразработен протокол за анализ на състава на FFA при ризобиални бактерии и предлагаме цялостно количествено решение за пръстови отпечатъци на FFA в култивирани клетки от MALDI-TOF-MS. По този начин демонстрираме за първи път приложимостта на подхода Langmuir/MALDI-TOF-MS за отговори на реални биологични въпроси.
2. Експериментален дизайн
Въпреки че условията на мека реакция правят технологията на Лангмюр обещаващ инструмент при подготовката на пробите за масспектрометричен анализ, нейното прилагане в аналитичната практика обаче изисква основни промени в стратегията за еднослойно приготвяне. Първо, както показахме в скорошната ни работа [21], катионният компонент трябва да бъде заменен с двувалентен метал, в идеалния случай барий. В действителност, тези катиони образуват предимно монокарбоксилати и без смесени соли, т.е. давайки ефективно йонизиращи се монослоеве. Такива монокарбоксилатни монослоеве могат да бъдат десорбирани от повърхността на конвенционална MALDI мишена чрез UV лазер и следователно могат да бъдат анализирани чрез MALDI-TOF-MS апаратура. Ефективността на йонизацията може да бъде допълнително увеличена чрез допълване на водната фаза с конвенционални MALDI матрици, базирани на заместени бензоени или канелени киселини, които подобряват разпределението на енергията в пробата при лазерно изстрелване [28]. В този контекст 2,5-дихидроксибензоената киселина (DHB) се оказа най-добрият избор за ФА поради добрата си разтворимост във вода [25]. Получените спектри са добре интерпретируеми и могат да се използват за количествени оценки.
За съжаление, късоверижните и ненаситени ФА не образуват твърди монослоеве; техните соли остават на повърхността на водната фаза, когато такива монослоеве се разрушат. Това и няколко други ограничения могат да бъдат преодолени чрез прехвърляне на технологията Langmuir от равнинната настройка (например в чаша на Петри) в капков формат [25]. Това позволява образуването на монослоеве директно върху мишена MALDI без загуби на пробата. На второ място, поради изпъкналата форма на повърхността на капката, могат да се постигнат по-високи концентрации на металните йони в интерфазата. По този начин консумацията на проба е доста ниска (не повече от 1 µL на проба). И накрая, структурата на монослоевете остава редовна, което води до висока възпроизводимост на анализа. В допълнителни експерименти разгледахме ограниченията на метода в контекста на дължината на киселинната верига. Установихме, че C6: 0 и C8: 0 киселините не се откриват по този протокол, докато сигналът на C10: 0 показва по-ниска интензивност в сравнение с по-високите хомолози (C12: 0 и по-високи).
Цялостната експериментална настройка зад предложения протокол включва няколко основни стъпки (Фигура 2): култивиране на ризобия върху агар и във водна хранителна среда, предварително почистване на бактериалните клетки, екстракция с хексан на водната суспензия от бактериалната пелета, прилагане на пробата върху целта на MALDI, масспектрометричен анализ, качествен и количествен анализ и статистическа интерпретация (последваща обработка).
- Влияние на захарен диабет и инсулин върху неалкохолната мастна чернодробна болест при болестно затлъстяване
- Hale Yeah Meal Prep предлага бързи, питателни ястия Chattanooga Times Free Press
- Чернодробно заболяване, каква диета работи и защо зехтин - Фондация за мастен черен дроб
- Подобряване на безалкохолната мастна чернодробна болест след бариатрична хирургия при болно затлъстели китайци
- Бонбони без твърда захар