Парк Союнг
1 Департамент по храните и храненето, Колеж по човешка екология, Национален университет в Сеул, 1 Gwanak-ro, Gwanak-gu, Сеул 151-742, Корея.
Йесео Лим
1 Департамент по храните и храненето, Колеж по човешка екология, Национален университет в Сеул, 1 Gwanak-ro, Gwanak-gu, Сеул 151-742, Корея.
Sunhye Shin
1 Департамент по храните и храненето, Колеж по човешка екология, Национален университет в Сеул, 1 Gwanak-ro, Gwanak-gu, Сеул 151-742, Корея.
Сун Ним Хан
1 Департамент по храните и храненето, Колеж по човешка екология, Национален университет в Сеул, 1 Gwanak-ro, Gwanak-gu, Сеул 151-742, Корея.
2 Изследователски институт по човешка екология, Национален университет в Сеул, Сеул 151-742, Корея.
Резюме
Съобщава се, че маслото от корейски борови ядки (PNO) има благоприятно въздействие върху липидния метаболизъм и контрола на апетита. Проучихме дали консумацията на PNO може да повлияе на наддаването на тегло и дали PNO-индуцираният ефект ще доведе до подобряване на имунната функция при индуцирани с високо съдържание на мазнини диети (HFD), индуцирани със затлъстяване Мишките C57BL/6 бяха хранени с контролни диети с 10% енергийни мазнини или от PNO, или от соево масло (SBO), или с HFD с 45% енергийна мазнина от 10% PNO или SBO и 35% свинска мас, 20% PNO или SBO и 25% свинска мас, или 30% PNO или SBO и 15% свинска мас за 12 седмици. Пролиферативните отговори на спленоцитите при стимулация с конканавалин А (Con A) или липополизахарид (LPS), Con A-стимулирано производство на интерлевкин (IL) -2 и интерферон (IFN) -γ, и LPS-стимулирано производство на IL-6, IL-1β и простагландин Е2 (PGE2) чрез спленоцити бяха определени. Консумацията на HFD, съдържащи PNO, доведе до значително по-малко наддаване на тегло (17% по-малко, P Ключови думи: Масло от кедрови ядки, затлъстяване, диета с високо съдържание на мазнини, имунен отговор, възпалителен цитокин
Въведение
Кедровите ядки, които са мазни семена от рода pinus, се използват за кулинарни цели по целия свят от векове. Pinus koraiensis, местно растение в Източна Азия и често наричано корейски кедрови ядки, е един от основните видове търговски кедрови ядки. Съдържанието на липиди в корейския кедров орех съставлява 62% от общото тегло на ядката [1]. Кедровите ядки съдържат мастни киселини с необичайна структура, например Δ5-ненаситени полиметиленови прекъснати мастни киселини (Δ5-UPIFA). Тези мастни киселини са характерните компоненти на липидите, получени от иглолистни семена и листа [2]. Пиноленовата киселина (18: 3, Δ5,9,12) е основният Δ5-UPIFA, присъстващ в кедровите ядки. Корейското масло от кедрови ядки (PNO) съдържа 5% палмитинова киселина (16: 0), 2% стеаринова киселина (18: 0), 27% олеинова киселина (18: 1, Δ9), 45% линолова киселина (18: 2, Δ9,12), 1% ейкозенова киселина (20: 1, Δ11), 15% пиноленова киселина и 3% други Δ5-UPIFA [2].
Ползите за здравето на PNO са изследвани в няколко проучвания. Asset et al. [3,4] съобщават, че PNO понижава общите нива на холестерола и триглицеридите в животински модели. В проучване на Sugano et al. [5], консумацията на PNO (22% енергия) облекчава високото кръвно налягане при спонтанно хипертонични плъхове след пет седмици хранене. Хюз и др. [6] показа, че осигуряването на PNO капсула преди обяд ad libitum на шведска маса води до намален прием на храна при жени с наднормено тегло. Пасман и сътр. [7] наблюдава, че холецистокинин и глюкагон-подобен пептид-I секреция са по-високи при субекти, които са получили PNO капсула, отколкото при тези, които са получавали плацебо, като по този начин подкрепят констатациите на Hughes et al. [6].
Диетичните мастни киселини, особено полиненаситените мастни киселини (PUFAs), играят основна роля в регулирането на имунната функция, като модулират производството на липидни медиатори, участващи в различни сигнални пътища. Като цяло, n-6 PUFAs са известни, че насърчават хиперактивни имунни отговори, като осигуряват субстрати за провъзпалителни липидни медиатори; като има предвид, че консумацията на n-3 PUFAs води до облекчаване на проинфламаторните реакции [8]. Съобщава се обаче, че γ-линоленова киселина (18: 3, Δ6,9,12), която е n-6 PUFA, потиска хроничното възпаление чрез повишаване на клетъчните нива на дихомо-γ-линоленова киселина (20: 3, Δ8, 11,14) [9]. Дихомо-γ-линоленова киселина може да се конкурира с арахидонова киселина (20: 4, Δ5,8,11,14) като субстрат за циклооксигеназа и липоксигеназа.
Пиноленова киселина, която е позиционният изомер на у-линоленова киселина, също може да бъде погълната и удължена, за да образува ейкозатриенова киселина (20: 3, Δ7,11,14) [10]. Chuang et al. [11] съобщава, че погълнатата от клетките пиноленова киселина модифицира състава на мастните киселини на клетъчните фосфолипиди, което води до намалено производство на провъзпалителни ейкозаноиди в клетъчната линия на миши макрофаги. За разлика от резултатите in vitro, производството на възпалителни липидни медиатори е повишено при животни, хранени с PNO [5,12]. В проучване, което изследва ефектите от петседмична PNO диета (22% енергия) върху имунните параметри [12], относителното съотношение на CD4 + Т лимфоцитите на далака, производството на далак на имуноглобулин G и E и освободеният левкотриен B4 от перитонеални ексудатни клетки са по-високи при плъхове, хранени с PNO, в сравнение с тези, хранени с масло от шафран (източник на линолова киселина; n-6, 18: 2, Δ9,12) или масло от вечерна иглика (източник на γ-линоленова киселина) киселина; n-6, 18: 3, Δ6,9,12). Следователно, пиноленова киселина има потенциала да модулира имунния отговор чрез механизъм, който може да се различава от този на други n-6 PUFAs in vivo. Информацията относно ефекта на PNO върху имунната функция обаче е ограничена.
Затлъстяването е свързано с нарушена имунна функция. Съобщава се, че пациентите със затлъстяване имат повишен риск от инфекция [13] и слаб отговор на антитела към ваксинацията [14]. Предполага се, че променените нива на циркулиращите хормони и хранителни вещества, като глюкоза и липиди, могат да допринесат за дисрегулация на имунните клетки [15]. Няколко проучвания показват, че адекватното намаляване на теглото може да коригира променения имунен отговор [16,17], което предполага, че имунният отговор може да се подобри чрез намаляване на теглото при затлъстели лица.
Изследване на Ferramosca et al. [18] показа, че консумацията на PNO води до по-малко наддаване на тегло при мишки, хранени с 29% енергийна мазнина, съдържаща PNO (17% енергия). Тук изследвахме дали PNO намалява наддаването на тегло при индуцирани с високо съдържание на мазнини диета (HFD), индуцирани от затлъстяване и дали този ефект води до подобряване на имунната функция. За да се тества дозозависим ефект, 10%, 20% и 30% от енергията се осигурява от PNO в HFD (45% енергийни мазнини). Изследван е и ефектът от заместването на PNO в контролната диета (10% енергийни мазнини) върху имунните отговори. Доколкото ни е известно, това е първото проучване, което изследва ефекта на PNO както в контролната диета, така и в HFD върху имунната функция при животински модел.
Материали и методи
Животни и диети
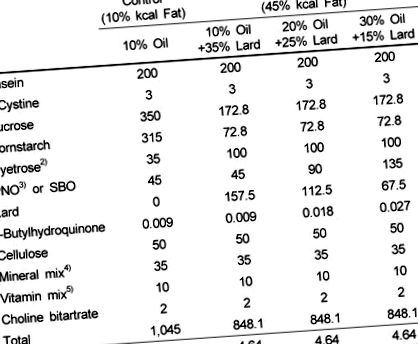
маса 1
Състав на експериментални диети (g) 1)
1) Ресурс: Dyets, Inc, Витлеем, Пенсилвания, САЩ.
2) Dyetrose (Dyets) е декстринизирано царевично нишесте, съдържащо 90-94% тетразахариди.
3) PNO беше подарък от Dubio Co., Ltd. (Gyeonggi-do, Корея).
4) Тридесет и пет грама минерална смес (Dyets, # 210099) осигурява 5.1 g калций, 4 g фосфор, 3.6 g калий, 1 g натрий, 1.6 g хлорид, 0.5 g магнезий, 0.3 g сяра, 59 mg манган, 46 mg желязо, 25 mg цинк, 5 mg мед, 0,2 mg селен, 0,2 mg йод и 4,2 g захароза.
5) Десет грама витаминен микс (Диети, # 300050) осигуряват 4000 IU витамин А, 1000 IU витамин D3, 50 IU витамин Е, 30 mg ниацин, 16 mg пантотенова киселина, 7 mg витамин B6, 6 mg витамин B1, 6 mg витамин В2, 2 mg фолиева киселина, 0,8 mg менадион, 0,2 mg биотин, 10 µg витамин В12 и 9,8 g захароза.
Таблица 2
Състав на мастни киселини на експериментални диети (% мастни киселини) 1)
ND, не се открива.
1) Съставът на мастните киселини се определя чрез метод на газова хроматография.
Изолиране на спленоцити
Слезките се смилат с матираните краища на микроскопските стъкла (Fisher Scientific, Waltham, MA) в пълна RPMI. След центрофугиране, червените кръвни клетки се лизират с помощта на разтвор на Gey, а останалите левкоцити се промиват два пъти с пълна RPMI. Жизнеспособните клетки бяха преброени чрез изключване на трипаново синьо на хемацитометър (Fisher Scientific). Изолираните спленоцити бяха ресуспендирани в пълен RPMI, съдържащ 10% топлинно инактивиран фетален говежди серум (Gibco) за култура.
Пролиферация на лимфоцити
Пролиферацията на лимфоцити се определя, като се използва анализ на включване на [3Н] тимидин. Спленоцитите (4 × 105 клетки/ямка) се култивират в три екземпляра с конканавалин А (Con A) (Sigma Aldrich) при 0,5 или 1,5 mg/L (крайна концентрация) или липополизахарид (LPS) (Sigma Aldrich) при 5, 15, или 30 mg/L (крайна концентрация) в плоча с плоско дъно с 96 ямки (Becton Dickinson, Franklin Lakes, NJ) за 72 часа при 37 37 в присъствието на 5% CO2. Всяка ямка беше пулсирана с 18,5 kBq [3Н] тимидин (Perkin Elmer, Бостън, Масачузетс) за последните 4 часа инкубация. Клетките се събират на филтърна хартия с помощта на клетъчен комбайн (FilterMate; Perkin Elmer) и радиоактивността се измерва с помощта на течен сцинтилационен брояч (MicroBeta; Perkin Elmer). Резултатите се отчитат като коригирани дезинтеграции в минута (dpm), което е средното dpm на стимулираните от митоген кладенци минус средното dpm на кладенци без митогени.
Производство на цитокини и простагландин Е2 (PGE2)
Спленоцитите (5 × 106 клетки/ямка) бяха стимулирани с 5 mg/L Con A в продължение на 48 часа или 10 mg/L LPS за 24 часа в 24-ямкови плаки при 37 ℃ в 5% CO2 атмосфера. Безклетъчните супернатанти се събират и съхраняват при -80 ° С. Нивата на интерлевкин (IL) -2, интерферон (IFN) -γ, IL-6 и IL-1β бяха измерени чрез ELISA (BD OptEIA набор; BD Pharmingen, Сан Диего, Калифорния) в съответствие с инструкциите на производителя. Нивата на PGE2 бяха измерени, като се използва състезателен комплект ELISA (комплект PGE2 EIA; Cayman Chemicals, Ann Arbor, MI).
Серумен лептин
Нивата на серумен лептин се определят чрез ELISA (комплект Quantikine® ELISA; R&D системи, Минеаполис, MN).
Статистически анализ
Таблица 3
Телесно тегло, наддаване на тегло, тегло на бялата мастна тъкан, прием на храна и енергиен прием на мишки, хранени с диети за контрол или HFD, съдържащи PNO или SBO
Стойностите са представени като средната стойност ± SE. За определяне на ефекта от количеството и вида на мазнините е използван двупосочен ANOVA, последван от LSD post-hoc тест. Средствата подред без общ индекс представляват значителни разлики (P 1) Теглото на бялата мастна тъкан е сумата от теглото на епидидималните, подкожните и периренално-ретроперитонеалните депа.
2) Среден дневен енергиен прием (kcal/d) = Среден дневен прием на храна (g/d) × Калории на g диета (kcal/g диета).
Таблица 4
Пролиферативните отговори на спленоцитите от мишки, хранени с контролни диети или HFD, съдържащи PNO или SBO (× 10 3 dpm)
Стойностите са представени като средната стойност ± SE. За определяне на ефекта от количеството и вида на мазнините е използван двупосочен ANOVA.
Спленоцитите (4 х 105 клетки/ямка) бяха стимулирани с Con A или LPS в 96-ямкови плоски дънни плаки за 72 часа при 37 ° С в присъствието на 5% СО2. Крайните концентрации на митогени са 0,5 и 1,5 mg/L за Con A и 5, 15 и 30 mg/L за LPS. Пролиферацията на лимфоцити беше измерена чрез оценка на включването на [3Н] тимидин през последните 4 часа инкубация. Резултатите се отчитат като dpm, което е средното dpm на стимулирани от митоген кладенци минус средното dpm на кладенците без митогени.
Производство на цитокини и PGE2
Като цяло, производството на IL-1β от спленоцити, стимулирано с 10 mg/L LPS, е значително по-високо при мишки, хранени с PNO (P = 0,04); като има предвид, че количеството мазнини не е имало значителен ефект (Таблица 5). Няма значително влияние върху количеството или вида мазнини върху производството на IL-2, IFN-γ, IL-6 или PGE2.
Таблица 5
Производството на цитокини и PGE2 от спленоцити от мишки, хранени с контролни диети или HFD, съдържащи PNO или SBO
Стойностите са представени като средната стойност ± SE. За определяне на ефекта от количеството и вида на мазнините е използван двупосочен ANOVA, последван от LSD post-hoc тест. Средства подред без общ индекс представляват значителни разлики (P 6 клетки/ямка) са стимулирани с Con A (5 mg/L, крайна концентрация) за 48 часа или LPS (10 mg/L, крайна концентрация) за 24 часа в 24-ямкови плочи при 37 ℃ в 5% CO2 атмосфера. Бяха събрани безклетъчни супернатанти и нивата на IL-2, IFN-y, IL-6, IL-1β и PGE2 бяха измерени чрез ELISA.
Дискусия
Съобщава се, че PNO има благоприятни ефекти върху липидния метаболизъм [10,19], кръвното налягане [5], контрола на апетита [6,7] и производството на ейкозаноиди [11]. Проведени са обаче няколко проучвания за определяне на ефектите на PNO върху имунната функция [12]. Ние се фокусирахме върху това дали консумацията на PNO може да повлияе на наддаването на тегло и дали въздействието на PNO върху намаленото наддаване на тегло е довело до подобряване на имунната функция при HFD-индуцирани затлъстели мишки. Ние показахме, че мишките, хранени с PNO-съдържащ HFD, са спечелили по-малко телесно тегло и са имали по-малко мастна тъкан от тези, хранени със SBO-съдържащ HFD. Въпреки това, дозозависимите ефекти на PNO върху наддаването на тегло и теглото на бялата мастна тъкан не са наблюдавани сред различните дози PNO, тествани в това проучване.
Консумацията на PNO има тенденция да увеличава пролиферацията на лимфоцити, когато клетките се стимулират с Con A при 0,5 mg/L; въпреки това, той не е оказал значително влияние върху пролиферацията на лимфоцити, когато клетките са били стимулирани с Con A при 1.5 mg/L или с LPS при 5, 15 или 30 mg/L. По този начин е неубедително дали консумацията на PNO ще доведе до подобрена пролиферация на лимфоцити. Освен това не можем да заключим, че по-висока пролиферация на лимфоцити, наблюдавана при стимулация на Con A при 0,5 mg/L при мишки, хранени с PNO, се дължи на по-малко наддаване на тегло и по-ниско тегло на мастната тъкан, тъй като затлъстелите мишки, в сравнение с контролните мишки, имат тенденция да имат по-висок лимфоцит пролиферация при лечение с Con A при 0,5 mg/L също.
Ахмед и сътр. [16] съобщават, че 7% и 10% намаление на теглото след 10% и 30% рестрикция на енергия, съответно, засилват медиираните от Т клетки имунни отговори при затлъстели пациенти. Tanaka et al. [17] съобщават, че променената функция на Т-клетките, наблюдавана при затлъстели лица, е била коригирана след 26% намаляване на теглото. В настоящото проучване мишките, хранени с HFD с PNO, консумират 4% по-малко енергия и тежат 10% по-малко от тези, хранени с HFD, съдържащ SBO. Намаленото наддаване на тегло обаче не води до цялостно подобряване на пролиферативните отговори на лимфоцитите към Т-клетъчните митогени. В повечето проучвания, използващи животински модели, се наблюдават благоприятни ефекти от ограничаването на енергията върху имунния отговор, когато животните се хранят с 20% до 60% по-малко храна [25]. Степента на намаляване на енергийния прием и наддаването на тегло в това проучване изглеждаше недостатъчна, за да окаже значително влияние върху пролиферацията на лимфоцитите.
В настоящото проучване показахме, че консумацията на HFD, частично заместена с PNO в продължение на 12 седмици, води до намалено наддаване на тегло, което се дължи главно на по-малко бяла мастна тъкан при мишките. Ефектът от по-ниското наддаване на тегло не води до цялостно подобряване на пролиферативните отговори на спленоцитите. Тъй като производството на IL-1β от спленоцитите е по-високо при мишки, хранени с PNO, съществува вероятност PNO да има ефект на активиране на имунния отговор; необходими са обаче допълнителни проучвания, за да се определят механизмите на ефекта на PNO върху производството на IL-1β и дали PNO влияе върху производството на други възпалителни маркери.
Бележки под линия
Тази работа беше подкрепена с грант от Националната изследователска фондация (NRF) на Корея, финансиран от Министерството на образованието, науката и технологиите (грант номер 2010-0024878).
- Влияние на загубата на тегло върху целостта на ДНК на сперматозоидите при затлъстели мъже - Mir - 2018 - Andrologia - Wiley Online
- То; Доказано е, че времето ни на хранене оказва влияние върху нашето наддаване на тегло Web24 News
- Тук е наддаване на тегло или подуване на корема; s Как да разберете да ядете това не това
- Възможно ли е да отидете в Париж за 8 дни и да не напълнеете Форумите на Фодор за пътуващи разговори
- Как мога да помогна на дъщеря ми, зависима от хероин, да наддаде на тегло