Резюме
Заден план
Солта е основно хранително вещество за всички клетки и намаляването на приема на сол води до колапс на сърдечно-съдовата циркулация. Хората притежават повече системи за задържане на сол, например хемодинамични, хормонални и ренин ангиотензинови системи, отколкото механизми за отделяне на сол. Ето защо се смята, че дисбалансът между приема на сол и системите за задържане на сол е отговорен за появата на сърдечно-съдови заболявания в зряла възраст.
По отношение на вътрематочната среда обаче, ефектите от приема на сол от майките върху растежа на плода все още не са разгледани. Всъщност феталните механизми за справяне с среда с ниско съдържание на сол или въздействието на прекомерното ограничаване на солта върху растежа и здравето на плода не са изследвани. Като се има предвид техният вътрематочен статус, плодовете са по-обект на въздействие от възрастните на среда с ниско съдържание на сол и са повлияни от свързаните с ограничаването на солта хемодинамични и хормонални промени при майките си, както и от собствените си хомеостатични промени.
Последните проучвания са установили връзка между забавяне на вътрематочното развитие и сърдечно-съдова дисфункция със структурни промени както при животните, така и при хората. В този смисъл би било интригуващо да се определи патофизиологичната роля на метаболизма на майчината сол във феталния растеж и да се изследва дали забавянето на растежа поради прекомерно ограничаване на солта е свързано със заболявания в зряла възраст.
Съответно, този преглед се фокусира върху скорошни проучвания относно ефектите от прекомерното ограничаване на солта върху растежа на плода и разглежда възможния механизъм, лежащ в основата на този риск. В обхвата ни също е да обсъдим връзката на забавяне на растежа поради ограничаване на солта с хипертония и метаболитни заболявания в зряла възраст, със специално позоваване на епигенетичните и свързаните с гените механизми.
Ограничаване на солта и прекомерен прием на сол
Констатациите от проучвания върху животни са много ясни. Съдържанието на сол в обикновената чау, използвана за поддържане на колония на гризачи, е приблизително 0,75% (т/т). В областта на изследванията на хипертонията диетата с ниско съдържание на сол съдържа 0,3% сол (т/т), а диетата без сол съдържа по-малко от 0,1% сол (т/т) [5, 6]. С други думи, животните, хранени с диета с ниско съдържание на сол, консумират по-малко от половината от обичайния прием на сол. В проучвания, използващи плъхове, чувствителни към сол на Dahl (Dahl S), диетата с високо съдържание на сол се определя като съдържаща 4 или 8% сол (тегло/тегло), съгласно определението, дадено от Съвета за хипертония на Американската сърдечна асоциация [5, 6]. Плъх Dahl S с тегло 300 g обикновено консумира приблизително 30 g чау на ден или приблизително 0,3 g сол/kg BW на ден за диета с 0,3% ниско съдържание на сол и 8 g сол/kg BW на ден за 8% с високо съдържание на сол диета.
Освен това по-специално няма стандартни методи, с които да се оцени приема на сол в клинични условия. В малки клинични проучвания приемът на сол се оценява точно чрез определяне на съдържанието на сол в храните; въпреки това, при големи популационни епидемиологични проучвания е невъзможно да се получат проби от 24 часа урина, за да се определи отделянето на натрий с урината като индекс на прием на сол. По този начин приемът на сол обикновено се изчислява от интервюта относно погълнати храни или чрез точково събиране на урина, което може да доведе до променливост в отчетените количества прием на сол в литературата [7, 8]. Съответно, в този преглед ние предоставихме информация за методите, използвани за определяне на приема на сол, доколкото е възможно.
Ограничаване на солта и риск за здравето при потомството
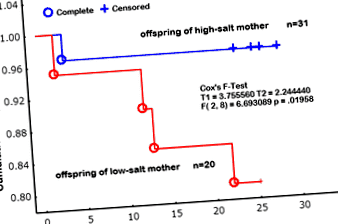
Освен това процентът на преживяемост на малките по време на кърмене е бил 95% за майките на диета с високо съдържание на сол по време на бременност, докато е бил толкова нисък, колкото 64% за майките на диета с ниско съдържание на сол (0,3% NaCl, w/w) (фиг. 1) [13]. Не е ясно дали това е свързано с промени в поведението на майките поради ограничаване на солта или с бебета, които евентуално имат дефекти, критични във вътрематочната среда. Както е показано в анализа на Каплан Майер, има два вида смърт, т.е. смърт след раждането и тази по време на нормален растеж на малките, докато приемат мляко. Тъй като смъртта е свързана с канибализъм, се отбелязва, че ограничаването на солта може да причини промени в поведението на майките. Необходимо е по-точно разследване. Освен това, de Siqueira et al. също така съобщава, че плъховете Wistar с нисък прием на сол (0,15% NaCl, w/w) през втората половина на бременността имат ниско тегло и размер при раждане, като по този начин се предполага, че ограничаването на солта (0,15% NaCl, w/w) е по-вероятно засяга вътрематочното развитие на органите на плода, отколкото нормалната натриева диета (1,3% NaCl, т/т) [15].
Кумулативен дял на оцеляването на потомството (анализ на Каплан Майер). Прогнозата за оцеляване се оценява от раждането на малките плъхове до отбиването. Отворените кръгове се отнасят до смъртта (пълна) на малките от прием на майки с високо съдържание на сол (4% NaCl, w/w); плътни кръгове се отнасят до (пълните) малки на малки майки с ниско съдържание на сол (0,3% NaCl, w/w). плюс (+), цензор. Разликата е анализирана чрез F-тест на Cox (T1 = 3.755, T2 = 2.244, F (2, 8) = 6.6930, стр = 0,01958). Цитирано от Chou R et al. (2014) Journal of Nutrition and Metabolism том 2014. Article ID 212089, (ref # [13]).
Механизъм на нарушен растеж поради ограничаване на солта
Причините за по-малко или малки бебета с малко тегло се раждат от бременни майки с ограничения на солта остават неясни. Въпреки това, ниското тегло при раждане в отговор на ограничаването на солта по време на бременност се дължи на промени в маточно-плацентарната перфузия [25]. Съобщено е също, че солта е от решаващо значение за развитието на глиалните (имунни) клетки в мозъка. В действителност се съобщава, че ограничаването на солта от 0,022–0,04% натриева диета причинява забавяне на развитието на мозъка във връзка с по-малко консумация на диета, ниско тегло и ниска степен на преживяемост по време на лактация при плъхове Sprague Dawley [26]. Бебетата с нисък прием на натрий могат да получат лоша неврологична функция в ранна юношеска възраст, а ниският прием на сол нарушава нормалното развитие на нервната обвивка на плода. Инхибирането на растежа на астроцитите в новородения мозък, което се случва поради ниския прием на сол по време на бременност, вероятно е свързано с дисфункцията на вегетативната система в зряла възраст, като по този начин засяга хемодинамичните или метаболитните промени в зрялата възраст. Въпреки че тази хипотеза е интересна, за потвърждаване са необходими допълнителни клинични изпитвания.
Гестационен прием на сол и хипертония при възрастни
Тъй като Баркър и изследователи от други лаборатории съобщават за връзката между теглото при раждане и смъртта поради исхемична болест на сърцето [36], има много доказателства в проучвания върху животни, които предполагат, че ниското тегло при раждане определя началото на хипертонията, инсулиновата резистентност и липидите дисфункция [37, 38]. Връзката се потвърждава последователно и при хората [39–41]. Много голямо надлъжно проучване на 13 517 субекти, родени в Университетската болница в Хелзинки между 1924 и 1944 г., ясно показва, че малките размери при раждането и по време на ранна детска възраст с ускорено наддаване на тегло от 3 до 11 години предсказват по-висока честота на коронарни сърдечни заболявания, диабет тип 2 и хипертония 42]. Тези заболявания са неразделни компоненти на метаболитния синдром и предполага, че вътрематочният процес при такъв плод с ниско тегло при раждане програмира групирането на тези нарушения в зряла възраст.
Проучванията върху животни предоставят известна информация за механизма, който лежи в основата на асоциацията. Наскоро Бенц и Аман направиха преглед на ролята на развитието на нефрона във връзка с майчиното хранене и хипертонията [43]. При хората нефрогенезата настъпва от 5 до 36 гестационна седмица, като най-критичният период е средата на втория триместър до 36 седмици; плодовете са много чувствителни към генетични и екологични фактори като майчината диета през този 16-седмичен период. Този критичен период е в съответствие с данните от de Siqueira et al. предполагайки, че приемът на ниско съдържание на сол през втората половина на бременността е свързан с ниско тегло и размер при раждане [15]. Такива леки промени във вътрематочните обстоятелства, които причиняват ниско тегло при раждане, възпрепятстват нормалното развитие на бъбреците [44, 45]. Намаленият брой нефрони би могъл да причини чувствителност към солта и по този начин да развие хипертония при възрастни потомци. Всъщност Simonetti et al. установи, че децата с ограничение на растежа имат риск от намалена бъбречна маса, както се определя от ултразвук и повишена чувствителност към сол [46]. Намаленият брой нефрони по време на гестационното развитие или при придобитите бъбречни заболявания намаляват способността на нефроните да се справят с екскрецията на натрий, което води до развитие на хипертония.
Освен това, ограничаването на солта по време на бременност засилва желанието за сол при малките Dahl след отбиване [13]. Ограничаването на солта (0,3% NaCl, тегло/тегло) при бременност причинява повишаване на апетита за сол, но вкусът на солта не се променя. Асоциацията на ограничаване на солта с повишен апетит към сол се наблюдава както при мъжки, така и при женски малки. За разлика от това, приемът на високо съдържание на сол (4% NaCl, тегло/тегло) при майки по време на кърмене повишава апетита за сол при малките след отбиването. Загубата на сол при бременни плъхове в резултат на прием на полиетилен гликол, който предизвиква извънклетъчна дехидратация, повишава апетита за сол [21]. При хората е добре документирано, че сутрешното гадене и загубата на сол поради хормонална дисфункция при новородените от своя страна повишава апетита за сол по-късно при техните бебета [16–20]. Интересното е, че Shirazki et al. ясно демонстрира, че при деца с ниско тегло при раждане апетитът към солта при деца на възраст 10 години е отрицателно свързан с неонаталния серумен натрий [20]. По принцип при животните и при хората жаждата и апетитът към натрий се програмират от средата за развитие [47]. Повишеният апетит към сол и повишената чувствителност към сол поради ограничаване на солта едновременно повишават кръвното налягане [46]. Добре известно е, че бебетата Dahl, чувствителни към сол, са по-чувствителни към натоварване на сол, отколкото възрастните плъхове.
Ограничаването на солта намалява бъбречния кръвоток и предизвиква секрецията на ренин от бъбреците. Повишените плазмени концентрации на ренин инициират разграждането на рениновия субстрат, ангиотензиноген и накрая, произвеждат октапептида, ангиотензин II. Повишеното регулиране на ангиотензин II вероятно влияе върху хранителните предпочитания. При много млади, нормални жени, консумацията на общи липиди, холестерол и ненаситени свободни мастни киселини е по-висока при тези с MM/MT генотип на AGTMet235 [48]. В този контекст са проведени някои проучвания, за да се постулира ролята на интрацеребралния ангиотензин II при пиене на вода и сол и е установено, че инфузията на ангиотензин II в церебралната течност подобрява поведението на питейната вода и апетита за сол [49–51]. Рестрикцията на солта предизвиква активност на ренин ангиотензиновата система и нейното регулиране поради ограничаване на солта по време на растежа на плода може да бъде свързано с повишен апетит за сол. По-директно, изчерпването на натрий води до значително увеличение на плазмените концентрации на ангиотензин II и алдостерон в язовира. По време на пренаталното изчерпване на натрия, активирането на ренин ангиотензиновата система, а не загубата на самия натрий е отговорно за модифицираното поведение на прием на сол [52].
Такива промени в ренин ангиотензиновата система повишават кръвното налягане чрез вазоконстрикция, намаляване на екскрецията на натрий в бъбреците, засилена адренергична нервна система и ремоделиране на сърдечно-съдовата структура [22]. Съществуват много доказателства, които предполагат, че вътрематочното забавяне на растежа (IUGR) или прееклампсията е свързано с повишаване на ангиотензин II и че ренин ангиотензиновата система играе критична роля в недостатъчното развитие на вътрематочния растеж [27, 53–57]. Връзката между ренин ангиотензиновата система и растежа на органите обаче е малко противоречива. За функционирането на бъбреците е необходима непокътната ренин ангиотензинова система, а генетичните дефекти на ренин ангиотензиновата система са свързани с бъбречни аномалии [58–61]. По-директно, потискането на ренин ангиотензиновата система от лосартан малко след раждането е свързано със значително по-нисък нефронен брой с хипертония [62, 63]. Взети заедно, промените в вътрематочната среда могат да бъдат свързани или с потискане или свръхекспресия на компоненти на ренин ангиотензиновата система, които след това потенциално допринасят за хипертония, като пречат на нефрогенезата.
Ограничаване на солта и инсулинова резистентност
Ренин ангиотензинова система и инсулинова чувствителност
Механизъм на инсулинова резистентност чрез ограничаване на солта
Епигенетика и ограничаване на солта
Епигенетиката, вариациите в моделите на метилиране на ДНК и ремоделирането на хроматин, предоставят интригуващо обяснение за това как факторите на околната среда или вътрематочното хранене променят риска от развитие на метаболитни заболявания в зряла възраст. Има обаче ограничени данни за влиянието на ранното хранене върху модификациите на епигенетиката [86]. Един пример за епигенетичен механизъм е, че индуцирана от утероплацентарната недостатъчност вътрематочна рестрикция на растежа (IUGR), която предразполага към инсулинова резистентност при възрастни, намалява вариантите на мРНК, подобен на инсулиноподобен растежен фактор-1 (IGF-1) и удължаването на гена хистон 3 триметилиране на лизин 36 от IGF-1 гена (H3Me3K36). H3M e3K36 е чувствителен към нивото на глюкозата в пренаталната среда с произтичаща промяна на експресията на IGF-1 mRNA и в крайна сметка уязвимост към инсулинова резистентност при възрастни [87–89].
Епигенетичният механизъм е много обещаващ за обяснение на ролята на ограничаването на солта в развитието на инсулинова резистентност в зряла възраст. Не е доказано дали засилената активност на ренин ангиотензиновата система, дължаща се на ограничаване на солта, действително медиира епигенетичния механизъм. Освен това, ако се появят епигенетични модификации на ДНК, досега има малко изследвания върху фенотипната експресия в резултат на епигенетичните промени. Ренин ангиотензиновата система засилва проинфламаторните цитокини или кислородния стрес и свързания с nFkB транскрипционен процес [81, 83, 90–92]. В този смисъл изглежда доста интересно да се определи дали ангиотензин II участва в епигенетичния механизъм с промени в кислородния стрес. Взети заедно, епигенетичната хипотеза обещава да обясни късното начало на заболяванията в зряла възраст. Изследванията обаче са в зародиш и последиците от епигенетичното участие във фенотипни промени в зряла възраст поради ограничаване на солта при бременни майки все още предстои да бъдат изяснени.
Заключения
Смята се, че излишният прием на сол представлява риск за човешкото здраве, но неотдавнашни проучвания насочиха вниманието към ролята на вътрематочната среда на плода за растежа на бебетата и развитието на заболявания в зряла възраст. Има все по-голям брой проучвания, които предполагат, че ограничаването на солта по време на бременност има критично влияние върху вътрематочния растеж и развитие на органите на плода и вероятно включва важни фактори, участващи в появата на заболявания от възрастен тип чрез анатомични промени и хемодинамични или хормонални контрол, включително вътреклетъчна трансдукция на сигнал и модификация на гена. Тези връзки са илюстрирани на фиг. 3. Солта е един от неразделните компоненти за нормален растеж на плода. Ограничаването на солта по време на бременност е свързано с IURD или смърт, ниско тегло при раждане, недоразвитие на органите и дисфункция в зряла възраст вероятно чрез генетично медииран механизъм. Понастоящем хипотезата изглежда по-сложна, но въпреки това се очаква разбирането на механизмите, които програмират фетусите, водещи до заболявания на възрастни, да даде нова представа за патогенезата на сърдечно-съдовите и метаболитните заболявания.
Перспективен механизъм за развитие на болест в зряла възраст. RAAS, ренин ангиотензин алдостеронова система; IUGR, забавяне на вътрематочния растеж; LBW, ниско тегло при раждане.
- Растеж и развитие 2 седмици Райли Детско здраве
- Модели на растеж и развитие на затлъстяване при 13-годишни юноши с наднормено тегло или с нормално тегло
- Влияние на циклоспорин А върху гломерулния растеж и ефекта на мизорибин и лозартан върху
- Как да увеличим височината Фактори, които влияят върху растежа
- Има ли някакво влияние диетата върху развитието на метаплазията на Барет