Катедра по акушерство и гинекология, Здравен и научен университет в Орегон, Портланд, Орегон
Резюме
Вътреутробната среда е ключов фактор, определящ дългосрочните здравни резултати; лошото метаболитно състояние на майката и плацентарната недостатъчност са силно свързани с тези дългосрочни рискове за здравето. Човешките епидемиологични проучвания свързват затлъстяването на майките и сърдечно-съдовите заболявания при потомците в по-късен живот, но механистичните проучвания при животински модели са ограничени. Тук правим преглед на литературата, свързана с последствията от затлъстяване при майката по време на бременност и последващото въздействие върху сърдечно-съдовото развитие на плода.
Ендотелните клетки играят решаваща роля в регулацията на съдовия тонус (30) и затлъстелите жени влизат в бременност с хронично предварително съществуващо ендотелно активиране, водещо до ендотелна дисфункция (10), което е централен патологичен статус в ранното развитие на атеросклерозата (33). Ендотелната дисфункция се отнася до променената способност на ендотела да поема и метаболизира L-аргинин, субстрата за синтез на азотен оксид (NO) (50). Затлъстяването е свързано с променен транспорт на L-аргинин и производство на NO в резултат на променено усвояване и метаболизъм на ендогенния вазодилататор аденозин (82). В допълнение към вазодилататорите, съдовият тонус се поддържа и от вазоконстриктори като ендотелин-1 (ET-1) (86). Нивата на ендогенния ET-1 са повишени в условията на затлъстяване и това вероятно допринася за ендотелната дисфункция при затлъстели индивиди (прегледано в Реф. 6).
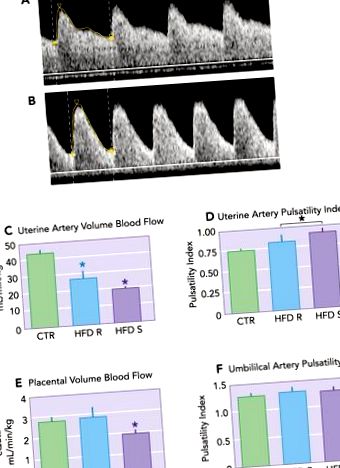
ФИГУРА 1.Намалена маточноплацентарна перфузия при японски макаци, хранени с диета с високо съдържание на мазнини
Диетата с високо съдържание на мазнини при майките (HFD) води до повишен индекс на пулсативност на маточната артерия (PI). A: PI на маточната артерия (Uta) е 0,74 при представително контролно животно. Б.: Uta PI е 1,17 при представително HFD-чувствително (HFD-S) животно с доплерова форма на вълната, което демонстрира намален диастоличен поток, съобразен с повишен съдов импеданс в сравнение с A. ° С: изчисленият Uta кръвен поток (cQUta), нормализиран до теглото на майката, е значително намален при HFD-R и HFD-S животни в сравнение с CTR. д: Uta PI се увеличава при HFD-S животни в сравнение с CTR. Като група HFD (HFD-R + HFD-S) има значително увеличение на Uta PI в сравнение с CTR. Е.: изчисленият кръвен поток от пъпна вена (cQUV), нормализиран до коремната обиколка на плода, е намален при HFD-S животни в сравнение с контролите. Няма разлика в HFD-R животни в сравнение с контролите. F: PI на пъпната артерия (UA) не е засегната от групата на диетата. * Значителна разлика (P
Това, което отличава затлъстелите жени от слабите им колеги, е излишъкът от мастна тъкан. Вместо просто да бъде депо за съхранение на мазнини, мастната тъкан е метаболитно активна тъкан, която допринася значително за ендокринната функция чрез производството на различни адипокини, включително лептин (77), което е важно при регулирането на множество аспекти на бременността (1, 71). Доказано е при in vitro проучвания на артериални съдови гладкомускулни клетки, че лептинът инхибира клетъчния растеж (5). Можем да предположим, че in vivo лептинът може да възпрепятства ангиогенезата и впоследствие да повлияе на обмена между майката и плода чрез регулиране на плацентарния транспорт на хранителни вещества (напр. Усвояване на аминокиселини), въпреки че това остава да бъде доказано.
Регулирането на растежа на кардиомиоцитите в утробата е ключов фактор, определящ здравето на сърцето в по-късния живот, тъй като броят на клетките при раждането определя броя на миоцитите за цял живот (73). Миокардът на сърцето на плода се разширява чрез репликация на кардиомиоцити под регулацията на медиатори като инсулиноподобен растежен фактор (69), ангиотензин II (70) и кортизол (20), както и механични стимули като натоварване на артериалното налягане ( 19). Супресорите на пролиферацията на миоцитите включват три-йод-1 -тиронин (Т3) (8), предсърден натриуретичен пептид (ANP) (55) и намалено сърдечно систолно натоварване (54). Освен това, повишеният стрес на вентрикуларната стена влияе негативно върху пролиферацията на кардиомиоцитите, което може да доведе до ограничено сърдечно разширяване и регенерация на миоцитите, както е необходимо за нормалната сърдечна функция през целия живот. Ако общият брой на миоцитите е намален, тежестта от механични напрежения и генериране на съкратителна сила е по-голяма от нормалната, което води до увеличаване на миоцитите, придружено от хипертрофия на стената на камерата като компенсаторен механизъм за нормализиране на напрежението на стената (73).
Данните от модели на овце за плацентарна недостатъчност показват намален, отсъстващ или обърнат диастоличен поток в пъпната артерия (75, 51), които са модели на потока, характерни за плацентите с висок импеданс на пулсиращия поток. Доплеровите ултразвукови проучвания при хора показват, че при плацентарна недостатъчност фетусите с нормален модел на кръвен поток от пъпна вена са увеличили секрецията на ANP (44), докато ненормалните модели на пъпната вена са свързани с увреждане на феталните миокардни клетки (43). В допълнение, увреждането на миокарда е свързано с повишено системно венозно налягане, преразпределение на сърдечния дебит в полза на лявата камера (главно отговорно за кръвоснабдяването на коронарната и мозъчната циркулация) и повишаване на дясното вентрикуларно допълнително натоварване (45). Тъй като сърдечните миоцити на плода са чувствителни към продължителни условия на натоварване, се предполага, че плацентарната съдова недостатъчност би увеличила систолното натоварване на сърцето на плода и би причинила хипертрофия на миоцитите (74). Освен това предполагаме, че ендотелната дисфункция при жени със затлъстяване може да доведе до неоптимална инвазия на трофобласти, което води до плацентарна съдова недостатъчност и че това може да осигури връзка между затлъстяването на майката и сърдечно-съдовите заболявания на плода.
При овчи модел на прехранване е доказано, че вентрикуларната тъкан на плода има забележимо натрупване на липидни капки и неправилна ориентация на миофибър, в допълнение към повишени нива на подобен на такса рецептор 4, интерлевкин-1α, интерлевкин-1β и IL-6, заедно с възпалителна клетка инфилтрация. Авторите предполагат, че прехранването на майката преди и по време на бременността насърчава сърдечния растеж и морфометричните промени (32). В нашия модел на NHP за консумация на HFD, ние наблюдаваме промени в индекса на сърцето/теглото (HWI) при непълнолетни потомци на възраст от 13 месеца. По-конкретно, потомството, родено от язовири, хранени с HFD, поддържани на HFD след раждането, имат повишен HWI в сравнение с потомство, хранено с контрол, от язовири, хранени с контрол. Потомците с повишен HWI имат ненормална експресия на сърдечна хипертрофия и гени, свързани със съкратимостта (Fan L, Grove KL, непубликувани наблюдения).
По-голямата част от данните, отнасящи се до липотоксичността в сърцето, са демонстрирани при модели на недохранване на майките, но скорошно проучване при мишки показа, че излагането на HFD на майката, последвано от HFD в постнаталния период, води до намалена митохондриална цялост в сърцето и повишено сърдечно липидно съдържание . В допълнение, това проучване съобщава за намалена инсулинова чувствителност на сърцето с намалена сърдечна функция и увеличаване на хипертрофия, апоптоза и фиброза (76). Миокардната фиброза, наблюдавана при гризачи, подкрепя по-ранни данни от модел на овце за индуцирано от майката затлъстяване, което демонстрира трансформиращ растежен фактор бета като основен сигнален път, водещ до сърдечна фиброза във феталното потомство (29).
Интересното е, че в проучване на овце върху потомство, родено от майки със затлъстяване, сърдечната функция е била нормална на изходно ниво, но е била нарушена с нарастващо сърдечно натоварване (80). Непълнолетни потомци от нашия NHP модел на диета, индуцирано затлъстяване по време на бременност, демонстрират значително намаляване на ендотел-зависимата вазорелаксация в коремната аорта, 90% увеличение на дебелината на интимата и увеличена пролиферация на гладкомускулни клетки, отложени под ендотела (11). Тези проучвания показват, че затлъстяването при майките допринася за вредния ефект на инсулиновата резистентност върху вазорелаксанта и сърдечната функция при потомството.
Таблица 1 Майчините и фетални последици от затлъстяването и лошото хранене по време на бременност
Тревожното нарастване на нивата на затлъстяване при майките изисква увеличаване на научните усилия за разбиране и разглеждане на вътреутробните взаимоотношения между състава на майчиното тяло, адаптациите на плацентата и развитието на сърдечно-съдовата система на плода. Уязвимостта на потомството към по-късна болест е резултат от несъответствие между вътреутробната среда, в която сигналите и сигналите за развитие се адаптират към неблагоприятните стимули, като се получава фенотип, който може да не е идеален за промяна в начина на живот в бъдещите поколения. Механизмите, свързани с майчиното затлъстяване и сърдечно-съдовите заболявания на потомството, са многофакторни и сложни. Този преглед обобщава промените в бременността, усложнени от майчиното затлъстяване, и настоящите познания за механистичните връзки, лежащи в основата на сърдечно-съдовото развитие на плода и по-късните заболявания, но в тази област трябва да се разбере много.
СТЪПКИ
Авторите на този преглед са получили финансова подкрепа от Националните институти по здравни помощи (R24-DK-090964, (R21-HD-076265 и (P51-OD-011092) .
Не се декларират конфликти на интереси, финансови или други, от автора (авторите).
- Влияние на майчиното затлъстяване и намерението за кърмене върху интензивността и продължителността на лактацията -
- Последици от затлъстяването в началото на бременността върху здравето на майката, плода и новороденото
- Влияние на затлъстяването, предизвикано от майката със западната диета, върху смъртността на потомството и периферните
- Затлъстяването на майката по време на бременност се свързва с преждевременна смъртност и големи сърдечно-съдови заболявания
- Затлъстяването при майки нарушава съкратителната функция на кардиомиоцитите на плода при овцете - Wang - 2019 - The