Резюме
мастната тъкан класически се разглежда като инертен склад за излишни калории. Сега обаче е широко признато, че мастната тъкан е активен ендокринен орган и че нарушенията във функцията и морфологията на мастната тъкан са тясно свързани с нарушената глюкозна хомеостаза (24). Например, все повече доказателства предполагат, че намаляването на съдържанието на митохондрии в мастната тъкан участва в патогенезата на диабет тип 2. В подкрепа на тази хипотеза е показано, че съдържанието на протеини в митохондриалните ензими на дихателната верига като убихинон: цитохром ° С субединица на ядро I на оксидоредуктаза (CORE I), цитохром ° С оксидазна субединица IV (COX IV) и цитохром ° С са намалени в епидидималната мастна тъкан и адипоцитите на генетично модифицирани, устойчиви на инсулин гризачи (4, 13, 29, 30). Подобен модел на намалено съдържание на митохондрии се съобщава в проби от подкожна мастна тъкан, получени от лица с диабет тип 2 (1). Интересното е, че инсулиновите сенсибилизиращи ефекти на тиазолендионите (TZD) са тясно свързани със силни увеличения в биогенезата на митохондриалната мастна тъкан (1, 4, 30).
Намаляването на митохондриалното съдържание на мастната тъкан в инсулинорезистентни състояния може да е резултат от намаляване на експресията на активирания от пероксизом пролифератор рецептор-γ (PPARγ) коактиватор-1α (PGC-1α), транскрипционен коактиватор, който е показал, че контролира експресията на митохондриални гени в бели адипоцити (27). Например, експресията на PGC-1α е намалена в коремната мастна тъкан от инсулиноустойчиви гризачи (29) и в проби от подкожна мастна тъкан от инсулиноустойчиви субекти (12) и лица с диабет тип 2 (1).
Изглежда вероятно, че намаляването на експресията на PGC-1α може да бъде резултат от намаляване на сигналните пътища, които индуцират експресия на PGC-1α и реципрочни увеличения в активирането на процеси, които понижават регулирането на този транскрипционен коактиватор. Например ендотелната азотна оксидна синтаза (eNOS) (18, 29) и 5'-AMP-активирана протеин киназа (AMPK) (20, 22) са свързани с индукцията на експресия на PGC-1α в бяла мастна тъкан и съдържанието и/или активността на тези протеини са намалени в мастната тъкан от силно инсулиноустойчиви гризачи (21, 29). От друга страна, наскоро се твърди, че хипергликемията, повишаването на свободните мастни киселини и/или индуцирането на оксидативен стрес могат да доведат до намаляване на експресията на PGC-1α и намаляване на митохондриалното съдържание (2, 7).
Материали.
Лечение на плъхове.
Всички протоколи следват насоките на Канадския съвет за грижа за животните и са одобрени от Комитета за употреба и хуманно отношение към животните към Университета на Алберта. Мъжките плъхове Wistar (Чарлз Ривър, Уилмингтън, Масачузетс) с тегло g200 g са настанени по две на клетка с 12: 12-часов цикъл светлина-тъмнина и са снабдени с вода и стандартна чау-чау ad libitum. Плъховете се аклиматизират в помещението за отглеждане на животни в продължение на 1 седмица преди началото на диетичната манипулация. Плъховете продължават да получават или стандартна чау-чау, или са били хранени с високо съдържание на мазнини диета ad libitum за 2, 4 или 6 седмици. Стандартната чау-диета съдържа 28,5% протеини, 13,5% мазнини и 58,0% въглехидрати, изразени като процент от общата енергия. Диетата с високо съдържание на мазнини съдържа 21% протеин (казеин), 59% мазнини (21,07% царевично масло, 37,92% свинска мас) и 20% въглехидрати, изразени като процент от общата енергия. Диетите бяха обогатени по подобен начин с протеини, витамини, фибри и минерали.
Тестове за интраперитонеален глюкозен толеранс.
След 12-часово гладуване през нощта животните получиха интраперитонеална инжекция с глюкоза (2 g/kg телесно тегло) между 8:00 и 10:00. Кръв се събира в хепаринизирани епруветки (Fisher Scientific, Edmonton, AB, Канада) от вените на опашката за 0 минути (преди инжектиране) и 15, 30, 45, 60, 90 и 120 минути след инжектирането. Пълна кръв се поставя върху лед и се центрофугира за разделяне на плазмата и плазмата се съхранява при -20 ° C до по-нататъшен анализ. Начертани са промени в глюкозата и инсулина с течение на времето и площта под кривата (AUC) е изчислена за всеки. Продуктът на AUC на глюкозата и инсулина беше изчислен, тъй като това може да се използва като маркер за системно инсулиново действие (6, 26).
Определяне на плазмената глюкоза, инсулин, лептин, адипонектин и NEFA.
Плазмената глюкоза се анализира, използвайки метода на глюкозната оксидаза. Пробите се анализират в три екземпляра върху четец за микроплаки. Средният коефициент на вариация (CV) за този анализ в нашата лаборатория е метод (праг на цикъла) (15). Извършени са стандартни анализи на кривата за бета актин и гените, които представляват интерес. Ефективността на усилване на гена, който ни интересува, и β-актина са еквивалентни, както е определено, използвайки уравнението 10 (-1/наклон) - 1. По същия начин, когато се начертава разреждане на log cDNA спрямо ΔCT (CT ген от интерес - CT β-актин), наклонът на тази връзка е, както е описано от Nicklas et al. (17). Накратко, CT за β-актин беше изваден от CT за митохондриалната D-верига, за да генерира ΔCT. Хранените с чау плъхове действат като контролен стандарт и ΔΔCT се определя като ΔCT от хранени с високо съдържание на мазнини - ΔCT от хранени с чау. Митохондриалната D-верига и β-актинът се усилват с еднаква ефективност (наклон на разреждане на ДНК спрямо ΔCT
маса 1. Времеви ход на промени в телесното тегло, епидидимална мастна тъкан и плазмени хормони и метаболити, предизвикани от диета
Стойностите са средни стойности ± SE за 8-14 плъхове на група. NEFA, нестерифицирана мастна киселина; ND, понастоящем няма налични данни. Инсулинът, глюкозата, лептинът и адипонектинът бяха измервани след едно нощно гладуване, докато NEFA беше измерен в хранено състояние.
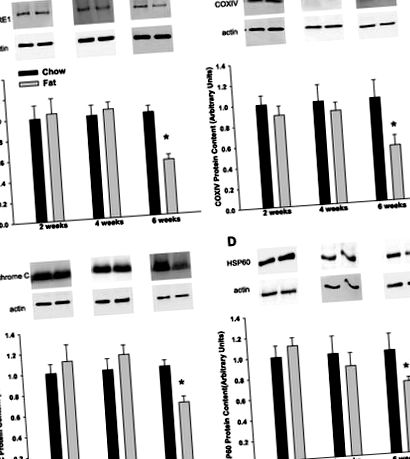
Фиг. 1.Храненето с високо съдържание на мазнини води до намаляване на съдържанието на протеин в митохондриалните маркери протеини убихинон: цитохром ° С субединица на ядро I на оксидоредуктаза (CORE I; A), цитохром ° С оксидазна субединица IV (COX IV; Б.), цитохром ° С (° С) и протеин от топлинен шок (HSP) 60 (д) в епидидимална мастна тъкан. Данните са представени като средни стойности + SE за 8–13 проби на група. Стойностите, хранени с високо съдържание на мазнини, се изразяват по отношение на контролните стойности, хранени с чау в същото време. Представени са представителни петна за всеки протеин от интерес и за β-актин, който е използван като вътрешен контрол на натоварването. *P
Фиг. 2.Шест седмици хранене с високо съдържание на мазнини води до намаляване на относителния брой на копията на ДНК на митохондриите (mt) и експресията на PGC-1α иРНК. Данните са представени като средни стойности + SE за 6-8 проби на група се изразяват по отношение на стойностите, подадени в чау в една и съща точка от времето. *P
Индуцирани от диетата промени в AMPK сигнализирането, съдържанието на eNOS протеин и оксидативен стрес.
След като определихме най-ранния момент от време, в който се наблюдава намаляване на съдържанието на митохондрии в мастната тъкан при хранене с високо съдържание на мазнини, искахме да определим дали тези промени са свързани с паралелни намаления на AMPK и eNOS, известни медиатори на митохондриалната биогенеза в бялата мастна тъкан. Шест седмици хранене с високо съдържание на мазнини не води до намаляване на фосфорилирането на AMPK или общото съдържание на протеин. По същия начин eNOS протеинът в епидидималната мастна тъкан не е намален. Храненето с високо съдържание на мазнини в продължение на 6 седмици не е довело до увеличаване на образуването на протеин карбонил или MDA, маркери на оксидативен стрес (фиг. 3).
Фиг. 3.Храненето с високо съдържание на мазнини не води до намаляване на фосфорилирането на AMPK (A), Съдържание на AMPKα протеин (Б.), съдържание на протеин в ендотелната NO синтаза (eNOS) (° С) или увеличаване на веществата, реагиращи с тиобарбитурова киселина (TBARS; д) и липидни пероксиди (Е.) в мастната тъкан на епидидима на плъх. Данните са представени като средни стойности + SE за 6–11 проби на група. За Western blot данни стойностите на хранене с високо съдържание на мазнини се изразяват по отношение на стойностите за контрол на хранене в чау в същото време. Представени са представителни петна за всеки протеин, който представлява интерес и за β-актин, използван като вътрешен контрол на натоварването.
Палмитатът намалява експресията на PGC-1α в мастната тъкан.
Капките от мастна тъкан от епидидима се инкубират в M-199, допълнени със или без 500 μM палмитат в продължение на 24 часа. Това лечение доведе до ∼50% намаляване на експресията на PGC-1α. Хиперинсулинемията (24-часова инкубация с 2 mU/ml инсулин) няма ефект върху експресията на PGC-1α (данните не са показани). Индуцираното от палмитат намаляване на експресията на PGC-1α е свързано с намаление на съдържанието на COX IV и CORE I протеин (Фиг. 4).
Фиг. 4.Палмитат намалява експресията на PPARγ коактиватор-1α (PGC-1α; A) и митохондриални протеини (Б.) в епидидимална мастна тъкан ex vivo. Данните са представени като средни стойности + SE за 4–6 проби на група. За Western blot данни са показани представителни петна за всеки протеин, който представлява интерес и за β-актин, използван като вътрешен контрол на натоварването. *P
Времеви ход на промени в диетата с високо съдържание на мазнини в глюкозната хомеостаза.
Храненето с високо съдържание на мазнини води до увреждане на глюкозния клирънс и преувеличен инсулинов отговор на интраперитонеално предизвикателство за глюкоза при плъхове, хранени с диета с високо съдържание на мазнини в продължение на 4 и 6 седмици (фиг. 5). AUC индексът на глюкоза-инсулин (интегриран AUC) може да се използва като заместител на цялото тяло на инсулиновото действие (6, 26) с увеличаване на тази стойност, представляваща влошаване на системното инсулиново действие. Както се вижда на фиг. 5° С, храненето с високо съдържание на мазнини доведе до значително увеличение на AUC индекса на глюкоза-инсулин.
Фиг. 5.Храненето с високо съдържание на мазнини причинява нарушен глюкозен толеранс и намаляване на действието на инсулин в цялото тяло. Показва се площ под кривата (AUC) за глюкозния и инсулиновия отговор при интраперитонеален тест за толерантност към глюкоза след 2, 4 или 6 седмици хранене с високо съдържание на мазнини за 3–8 животни на група. Индексът AUC на глюкоза-инсулин се използва като маркер за действието на цялото тяло на инсулина и е продукт на AUC на глюкозата и инсулина. *P
Мастната тъкан все повече се признава като важен играч в регулирането на метаболизма на глюкозата в цялото тяло. От интерес за изследването на диабет тип 2 се съобщава за силна връзка между намаляването на митохондриалното съдържание на мастната тъкан и системната инсулинова резистентност. Данните от тези изследвания са генерирани предимно с помощта на мастна тъкан или адипоцити от генетично модифицирани гризачи като db/db мишки и фа/фа плъхове (4, 13, 29, 30). За съжаление, поради подчертаната инсулинова резистентност и хипергликемия, налични при тези животни, е трудно да се идентифицират специфичните механизми, които предизвикват намаляване на митохондриалното съдържание на мастната тъкан и дали намаляването на митохондриите в мастната тъкан са потенциално начално събитие в патогенезата на системната инсулинова резистентност и непоносимост към глюкоза. Имайки предвид тези точки, ние се опитахме да определим колко бързо се намалява съдържанието на митохондрии в мастната тъкан при хранене с високо съдържание на мазнини, често използван подход за причиняване на коремно затлъстяване и инсулинова резистентност при гризачи.
В сравнение с контролите, хранени с чау, 6 седмици хранене с високо съдържание на мазнини води до – 30–50% намаление на съдържанието на митохондриални протеини на дихателната верига CORE I, COX IV и цитохром ° С. По същия начин открихме подобно намаляване на mtHSP60, протеин на шаперон, участващ в сгъването на митохондриални протеини, за който по-рано е доказано, че намалява в епидидималната мастна тъкан от ob/ob (30) и db/db мишки (19). Потвърждавайки нашите Western blot данни, открихме намаляване на относителния брой на mtDNA копие, маркер на броя на митохондриите на клетка. Важно е, че нашите данни показват, че 6 седмици хранене с високо съдържание на мазнини е най-ранният момент, в който е очевидно намаляване на съдържанието на митохондриален протеин в мастната тъкан. Мащабът на това намаление е подобен на този, докладван в db/db мишки и фа/фа плъхове (4, 13, 29, 30), но се развива при липса на продължителна хипергликемия и хиперинсулинемия.
PGC1-α е транскрипционен коактиватор и главен регулатор на митохондриалната биогенеза (8). Съобщава се за намаляване на експресията на PGC-1α при резистентни на инсулин гризачи (23, 29) и при затлъстели и диабет тип 2 (1, 25). По същия начин индуцирането на митохондриална биогенеза в мастната тъкан от тиазолидиендиони е придружено от повишаване на експресията на PGC-1α (1, 30). В съответствие с тези констатации, ние открихме намаление на експресията на PGC-1α едновременно с намаляване на митохондриалните маркери на мастната тъкан. Тези резултати са в съответствие с представата, че намаляването на експресията на PGC-1α може да бъде включено в медиирането на индуцирано с диета намаление на митохондриалните протеини в мастната тъкан.
Регулирането на експресията на PGC-1α и митохондриалната биогенеза в мастната тъкан е сложен процес, включващ множество фактори. При модели на тежка инсулинова резистентност положителните ефектори на митохондриалната биогенеза в мастната тъкан като AMPK (21) и eNOS (29) са намалени. От друга страна отрицателните модулатори на митохондриалното съдържание (2), като оксидативен стрес, се увеличават в мастната тъкан от мишки с диабет (11). В настоящото разследване оценихме дали промените в тези променливи са настъпили едновременно с първоначалните намаления на маркерите на митохондриалното съдържание, причинени от храненето с високо съдържание на мазнини. След 6 седмици хранене с високо съдържание на мазнини, времеви момент, в който маркерите на митохондриалното съдържание бяха намалени, AMPK фосфорилирането и съдържанието на eNOS бяха непроменени. В съответствие с неотдавнашен доклад при мишки, хранени с високо съдържание на мазнини (16), не открихме никакви разлики в съдържанието на протеинов карбонил или MDA в мастната тъкан от плъхове с високо съдържание на мазнини. Колективно нашите резултати показват, че промените в AMPK, eNOS и оксидативният стрес не са иницииращи събития в процеса, медииращи намаляването на съдържанието на митохондриален протеин в мастната тъкан.
Като се имат предвид тези резултати, ние се опитахме да идентифицираме потенциални механизми, които биха могли да помогнат да се обясни намаленото съдържание на митохондрии в мастната тъкан, предизвикано от диета В нашия модел на хранене с високо съдържание на мазнини плъховете поддържат нормални нива на глюкоза, но са едновременно хиперинсулинемични и хиперлипидемични. Като се има предвид факта, че палмитатът преди това е показал, че намалява експресията на PGC-1α в скелетните мускулни клетки (5, 7), искахме да установим дали ex vivo третирането на мастната тъкан на плъхове с палмитат може да възпроизведе ефектите от високо съдържание на мазнини хранене с експресия на PGC-1α от мастна тъкан и маркери за митохондриално съдържание. Установихме, че палмитатът, но не и високите нива на инсулин, водят до намаляване на експресията на PGC-1α и съдържанието на COX IV и CORE I протеин. Тези открития, в комбинация с наблюдаваните повишения на нивата на NEFA след хранене с високо съдържание на мазнини, предполагат потенциална причинно-следствена роля на мастните киселини при понижаването на експресията на PGC-1α в мастната тъкан и съдържанието на митохондриите.
Това изследване е първото, което характеризира времевите връзки между намаляването на митохондриалното съдържание на мастната тъкан, потенциалните медиатори на този процес и промените в хомеостазата на глюкозата в цялото тяло в модел на затлъстяване, предизвикано от диета. Установихме, че намаляването на митохондриалното съдържание на мастната тъкан е свързано с намаляване на експресията на PGC-1α и че тези ефекти могат да бъдат възпроизведени ех vivo чрез обработка на култури от мастна тъкан с палмитат. Най-важното откритие на това проучване е, че промени в PGC-1α и митохондриални маркери са настъпили след началото на нарушената глюкозна хомеостаза. Въпреки че настоящите открития в подложките на епидидимални мазнини при плъхове не могат непременно да бъдат екстраполирани към висцерални мастни депа при хора, нашите резултати аргументират, че намаляването на съдържанието на митохондрии в мастната тъкан е първоначално събитие в развитието на нарушена глюкозна хомеостаза.
D. C. Wright е стипендиант на Фондация за медицински изследвания в Алберта, нов изследовател на Канадските институти за здравни изследвания (CIHR) и стипендиант на Канадската асоциация по диабет. Това изследване беше подкрепено от грант за откритие от Съвета за естествени науки и инженерни изследвания на Канада за R. C. Bell и оперативен грант за D. C. Wright от CIHR.
СТЪПКИ
Разходите за публикуване на тази статия бяха покрити отчасти чрез плащането на такси за страница. Следователно статията трябва да бъде маркирана с „реклама”В съответствие с 18 U.S.C. Раздел 1734 единствено, за да посочи този факт.
Благодарим на Donna Taylor и Abha Hoedel за изключителна техническа помощ при тестовете за глюкозен толеранс.
- Ролята на липопротеиновата липаза в развитието на мастната тъкан и метаболизма International Journal
- Висцерален индекс на затлъстяване Индикатор за дисфункция на мастната тъкан
- Защо е време да започнете да подменяте ежедневната си сода; Здравни основи от клиника в Кливланд
- Какво казват експертите за модерните диети - Time & Money - The Times-News - Burlington, NC
- Защо сега е най-доброто време да се подложите на диета или науката за отслабване след празниците