Резюме
Цели/хипотеза
Ние се опитахме да установим връзката между концентрациите на глюкоза на гладно и фракционната бета клетъчна зона на панкреаса при възрастни маймуни cynomolgus (Macaca fascicularis).
Методи
Плазмената глюкоза на гладно и фракционната бета клетъчна област на панкреаса са измерени при 18 контролни и 17 лекувани със стрептозотоцин възрастни примати (17,0 ± 1,2 срещу 15,4 ± 1,2 години).
Резултати
Плазмената глюкоза на гладно се повишава (12,0 ± 2,0 срещу 3,4 ± 0,1 mmol/l, стр
Въведение
В здравето концентрацията на глюкоза в кръвта се регулира от инсулин, секретиран от бета-клетките на панкреаса. Диабетът възниква, когато се отделя недостатъчно инсулин за поддържане на гликемичния контрол. При диабет тип 1 и тип 2 това се дължи поне отчасти на дефицит в бета клетъчната маса [1–3]. В публикуваната литература има несъответствие по отношение на това какво представлява достатъчна маса на бета клетки, за да се поддържа гликемичен контрол. Хирургичната литература предполага, че 80% резекция на панкреаса може да се понася без диабет [4, 5]. По-всеобхватни метаболитни проучвания при хора и кучета след частична панкреатектомия показват, че ∼50% панкреатектомия води до нарушена глюкоза на гладно и непоносимост към глюкоза в краткосрочен план [6] и диабет при някои индивиди през следващите няколко години [7, 8 ].
Последните данни са в съответствие с изследванията на напречното сечение на връзката между концентрацията на глюкоза в кръвта на гладно и фракционната площ на панкреаса при хората [3]. При затлъстели индивиди тази връзка е криволинейна, с инфлексия на кръвната глюкоза с дефицит ∼50% или повече бета клетки в сравнение с контролите. От друга страна, в друго проучване на кучета се предполага, че секрецията на инсулин е била минимално постигната с ~ 50% резекция на панкреаса [9].
Тук докладваме връзката между плазмената глюкоза на гладно (FPG) и частичната зона на бета-клетките на панкреаса при възрастни маймуни cynomolgus (Macaca fascicularis).
Методи
Животни
Общо 35 мъжки маймуни cynomolgus (Macaca fascicularis, възраст: 16,2 ± 0,9 години, варират от 5 до 27 години; телесно тегло: 5,8 ± 0,3 kg, диапазон от 3,4 до 9,8 kg). Първоначално маймуните са били внесени от Института Пертаниан (Богар, Индонезия) и са били настанени по двойки в Клиничния изследователски център за сравнителна медицина в Медицинското училище в Уейк Форест, Уинстън-Салем, Северна Каролина, САЩ. Сред тях 18 маймуни (девет контролирани и девет третирани със стрептозотоцин [STZ] маймуни) са били включени в предишно проучване, докладвано другаде [10]. Маймуните бяха разпределени на случаен принцип или към контролата (н = 18) или STZ (н = 17) група. Контролната и STZ групата бяха съпоставени за възрастта (17,0 ± 1,2 срещу 15,4 ± 1,2 години, стр = 0,3) и телесно тегло (6,1 ± 0,4 срещу 5,6 ± 0,3 кг, стр = 0,3). Всички процедури, включващи животни, са проведени в съответствие с държавните и федералните закони, стандартите на Министерството на здравеопазването и хуманитарните услуги на САЩ и насоките, установени от Институционалния комитет за грижа и употреба на животните в университета Уейк Форест.
Индукция на диабет
За да се предизвика диабет, прясно приготвеният STZ (Zanosar; SICOR Pharmaceuticals, Irvine, CA, USA) се прилага интравенозно в единичен болус (30 mg/kg) на маймуни от групата на STZ. За да се проследи ефектът от STZ, концентрацията на глюкоза на гладно се измерва през други дни в продължение на една седмица (Accu-Check Glucose Monitor; Boehringer Mannheim, Indianapolis, IN, USA). От 17 маймуни в групата на STZ, шест се нуждаят от втора STZ инжекция 1 седмица след първата и три маймуни се нуждаят от трета STZ инжекция 1 седмица след втората, за да предизвикат диабет. Критерият за диабет е кръвната захар на гладно> 8 mmol/l 48 часа след STZ инжекция. За да се избегне кетоза при хипергликемични маймуни, инсулиновата терапия (Novolin 70/30; Novo Nordisk USA, Princeton, NJ, USA) започва в доза от 0,4 U/kg два пъти дневно и след това дозата постепенно се увеличава до целева кръвна захар на гладно концентрация от 8 до 14 mmol/l.
Кръвни проби на гладно се събират под кетаминова седация 4 седмици (девет контролни и девет STZ маймуни) или 14 седмици (девет контролни и осем STZ маймуни) след инжектирането на STZ (или физиологичен разтвор). За да се избегне ефектът от екзогенен инсулин, маймуните са били лекувани със същата доза редовен инсулин (Novolin R; Novo Nordisk USA) вместо Novolin 70/30 вечер преди вземане на кръв. Концентрацията на глюкоза в плазмата се определя по метода на глюкозната оксидаза с помощта на анализатор на глюкоза 2 (Beckman Instruments, Brea, CA, USA).
Събиране на тъкани
След събиране на кръвните проби (т.е. 4 или 14 седмици след лечението със STZ [или физиологичен разтвор]) животните бяха умъртвени чрез предозиране с интравенозен пентобарбитал и панкреасите бяха събрани непокътнати, незабавно претеглени, нарязани на 3–4 mm участъци фиксиран в ледено студен неутрално буфериран 10% (об./об.) формалин за 24 часа. След това панкреасите се прехвърлят в 70% (об./Об.) Алкохол за още 24 часа при 4 ° C преди обработка и вграждане в парафин за последващата процедура.
Морфометричен анализ
За имунохистохимия, 4 µm участъци от панкреаса, съдържащи минимум 100 островчета, бяха оцветени с антиинсулиново антитяло на морски свинчета, 1: 100 (Zymed Laboratories, Сан Франциско, Калифорния, САЩ) и хематоксилин. След това целият участък на панкреаса, оцветен за инсулин, се изобразява при увеличение от 40 × (обектив × 4). Съотношението между площта на бета-клетките и общата площ на паренхима на панкреаса е изчислено цифрово с помощта на софтуера Image Pro Plus (Media Cybernetics, Silver Springs, MD, USA), както е описано по-рано [2].
Статистически анализ
Данните са представени като средно ± SEM. Студентите т за сравнения е използван тест. Връзката между плазмената глюкоза на гладно (у в mmol/l) и площта на бета клетките (х в%) е описан с модела, предложен от Ritzel et al. [3], описващ моноекспоненциално разпадане плюс плато:
където платото (mmol/l) е стойността на FPG, свързана с повишените зони на бета клетки, интервалът (mmol/l) е увеличението над платото, съответстващо на площта на бета клетки, равна на нула, и k (% -1) е постоянната скорост на моноекспоненциалната функция.
Променливите на модела (т.е. плато, обхват и k) бяха изчислени, заедно с мярка за тяхната прецизност (коефициент на вариация), чрез нелинейни най-малки квадрати [11], използвайки софтуера SAAM II [12].
Резултати
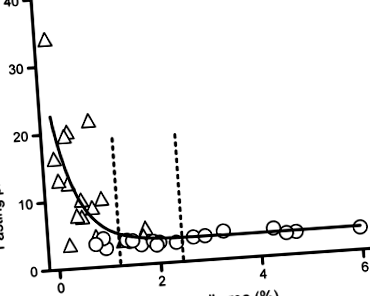
Както се очакваше, плазмените концентрации на глюкоза на гладно, измерени малко преди смъртта и некропсията, бяха по-високи при лекувани със STZ маймуни с диабет в сравнение с контролните маймуни (12,0 ± 2,0 срещу 3,4 ± 0,1 mmol/l, стр -1 (CV 33%). Имаше широк спектър от частични бета клетъчни области при контролните маймуни. Концентрациите на кръвната глюкоза се увеличават рязко, след като площта на фракционната бета-клетка на панкреаса намалее до 50% или по-малко от средната стойност на тази при контролните маймуни.
Дискусия
Съобщаваме, че връзката между фракционната бета-клетъчна зона на панкреаса и концентрацията на глюкоза на гладно при маймуни cynomolgus напомня на тази при хора със и без диабет тип 2 [3]. Връзката е също сравнима с тази, наблюдавана по-рано при свински [13] и плъхов модел на диабет [14] в сравнение със съответните им недиабетни контроли.
Във всеки от тези модели има широк спектър от частични бета клетъчни области в недиабетните контроли [3, 13, 14]. Възможно е това да се дължи на вариация в обема на панкреаса [15]. Съобщава се обаче и за широк спектър от бета клетъчни маси при хора без диабет [16].
Алтернативно, широкият обхват на частични зони на бета повиквания при лица без диабет представлява адаптация към инсулиновата чувствителност. Това обаче изглежда малко вероятно, поне при хората, тъй като при болестно затлъстели хора адаптивното нарастване на бета-клетъчната маса е само ∼50% в сравнение с това при слаби индивиди [2, 16–18]. Друго възможно обяснение е, че храненето на майката [19], функцията на плацентата и както храненето, така и генетичната регулация по време на постнаталното разширяване на бета-клетъчната маса могат да определят масата на бета-клетките при възрастни [20].
Връзката между частичната бета-клетъчна площ и концентрацията на глюкоза на гладно при възрастни майки, лекувани със STZ, също е сравнима с тази при модели на диабет тип 2 при възрастни плъхове [14] и свине [13]. При тези модели, след като частичната бета-клетъчна площ се намали с приблизително 50% или повече от тази при индивиди без диабет, гликемичният контрол се губи. След загуба на 50% от бета-клетките във всеки от тези модели, има рязко покачване на концентрацията на глюкоза на гладно с всяко следващо намаляване в областта на бета-клетките. Тази криволинейна връзка, съобщена при възрастни гризачи, прасета и сега нечовекоподобни примати, се възпроизвежда, както преди това при хора [3]. Освен това напоследък се съобщава за подобна връзка при хора с панкреатит [21].
Механизмите, отговорни за загубата на регулиране на гликемичния контрол след намаляване на площта на бета-клетките на панкреаса с 50% или повече, са неизвестни. Едно правдоподобно обяснение е, че с намаляваща маса на бета-клетките, веднага секретиращият се инсулинов пул [22] се изчерпва, което води до нарушена маса на инсулиновия пулс, както е документирано преди това след 50% панкреатектомия [6]. Тъй като моделът на доставяне на инсулин до черния дроб влияе върху инсулиновата чувствителност [23, 24], ние постулираме, че след като веднага се секретира инсулиновият пул, нарушеният пулсиращ инсулин води до инсулинова резистентност, която допълнително обърква дефекта в секрецията на инсулин. След като се развие хипергликемия, допълнителните объркващи неблагоприятни ефекти на хипергликемията върху функцията на бета-клетките и чувствителността към инсулин вероятно допринасят за по-нататъшния спад на гликемичния контрол.
В заключение, при възрастни нечовекоподобни примати спадът на приблизително 50% или повече в бета-клетките на панкреаса води до загуба на гликемичен контрол със връзка, сравнима с тази при възрастни хора. Следователно маймуната cynomolgus, лекувана с достатъчно STZ, за да предизвика този дефицит в бета клетките, е полезен модел за диабет тип 2.
Съкращения
Плазмена глюкоза на гладно
Препратки
Butler AE, Galasso R, Meier JJ, Basu R, Rizza RA, Butler PC (2007) Умерено увеличена бета клетъчна апоптоза, но без повишена репликация на бета клетки при пациенти с диабет тип 1, починали от диабетна кетоацидоза. Diabetologia 50: 2323–2331
Butler AE, Janson J, Bonner-Weir S, Ritzel R, Rizza RA, Butler PC (2003) Дефицит на бета-клетки и повишена бета-клетъчна апоптоза при хора с диабет тип 2. Диабет 52: 102–110
Ritzel RA, Butler AE, Rizza RA, Veldhuis JD, Butler PC (2006) Връзка между масата на бета-клетки и концентрацията на глюкоза на гладно при хора. Диабетна грижа 29: 717–718
King J, Kazanjian K, Matsumoto J et al (2008) Дистална панкреатектомия: честота на следоперативния диабет. J Gastrointest Surg 12: 1548–1553
Lillemoe KD, Kaushal S, Cameron JL, Sohn TA, Pitt HA, Yeo CJ (1999) Дистална панкреатектомия: индикации и резултати при 235 пациенти. Ann Surg 229: 693–698 дискусия 698–700
Matveyenko AV, Veldhuis JD, Butler PC (2006) Механизми на нарушена глюкоза на гладно и непоносимост към глюкоза, индуцирани от приблизително 50% панкреатектомия. Диабет 55: 2347–2356
Robertson RP, Lanz KJ, Sutherland DE, Seaquist ER (2002) Връзка между диабет и затлъстяване 9 до 18 години след хемипанкреатектомия и трансплантация при донори и реципиенти. Трансплантация 73: 736–741
Kumar AF, Gruessner RW, Seaquist ER (2008) Риск от непоносимост към глюкоза и диабет при донори, генерирани от хемипан, създадени за нормален предоперативен метаболизъм на глюкозата. Диабетна грижа 31: 1639–1643
Ward WK, Wallum BJ, Beard JC, Taborsky GJ Jr, Porte D Jr (1988) Намаляване на гликемичното усилване. Чувствителен индикатор за загуба на бета-клетки при частично панкреатомирани кучета. Диабет 37: 723–729
Wagner JD, Zhang L, Greaves KA, Shadoan MK, Schwenke DC (2000) Соевият протеин намалява артериалната концентрация на липопротеини с ниска плътност (LDL) и доставя LDL холестерол до артериите на диабетни и недиабетни мъжки маймуни cynomolgus. Метаболизъм 49: 1188–1196
Carson ER, Cobelli C, Finkelstein L (1983) Математическото моделиране на метаболитните и ендокринните системи. Уайли, Ню Йорк
Barrett PH, Bell BM, Cobelli C et al (1998) SAAM II: софтуер за симулация, анализ и моделиране за проследяващи и фармакокинетични изследвания. Метаболизъм 47: 484–492
Kjems LL, Kirby BM, Welsh EM et al (2001) Намаляването на масата на бета-клетки води до нарушена пулсираща секреция на инсулин, намален клирънс на чернодробен инсулин след хранене и относителна хиперглюкагонемия в мини свинята. Диабет 50: 2001–2012
Matveyenko AV, Butler PC (2006) Бета-клетъчен дефицит поради повишена апоптоза в човешкия остров амилоиден полипептиден трансгенен (HIP) плъх рекапитулира метаболитните дефекти, налични при диабет тип 2. Диабет 55: 2106–2114
Saisho Y, Butler AE, Meier JJ et al (2007) Обемите на панкреаса при хората от раждането до стогодишна възраст, като се вземат предвид полът, затлъстяването и наличието на диабет тип 2. Clin Anat 20: 933–942
Rahier J, Guiot Y, Goebbels RM, Sempoux C, Henquin JC (2008) Бета-клетъчна маса на панкреаса при европейски субекти с диабет тип 2. Диабет Obes Metab 10 (Suppl 4): 32–42
Meier JJ, Butler AE, Galasso R, Butler PC (2006) Хиперинсулинемичната хипогликемия след операция на стомашен байпас не е придружена от островна хиперплазия или увеличен бета-клетъчен оборот. Диабетна грижа 29: 1554–1559
Saisho Y, Butler AE, Monchamp T et al (2007) Увеличава ли се адаптивно масата на бета клетки в отговор на затлъстяването при хората? Диабет 56 (Suppl 1): A48
Schwitzgebel VM, Somm E, Klee P (2009) Моделиране на вътрематочно забавяне на растежа при гризачи: въздействие върху развитието на панкреаса и хомеостазата на глюкозата. Ендокринол на Mol Cell 304: 78–83
Freathy RM, Bennett AJ, Ring SM et al (2009) Алелите на риска от диабет тип 2 са свързани с намален размер при раждането. Диабет 58: 1428–1433
Meier JJ, Menge BA, Breuer TG et al (2009) Функционална оценка на бета-клетъчната област на панкреаса при хората. Диабет 58: 1595–1603
Daniel S, Noda M, Straub SG, Sharp GW (1999) Идентифициране на докирания гранулиран басейн, отговорен за първата фаза на глюкозно-стимулирана секреция на инсулин. Диабет 48: 1686–1690
Matveyenko AV, Butler PC (2008) Връзка между масата на бета-клетки и началото на диабета. Диабет Obes Metab 10 (Suppl 4): 23–31
Paolisso G, Scheen AJ, Giugliano D et al (1991) Пулсиращото доставяне на инсулин има по-големи метаболитни ефекти от непрекъснатото приложение на хормони при човека: значение на честотата на пулса. J Clin Endocrinol Metab 72: 607–615
Признание
Това проучване беше подкрепено от финансиране от NIH (DK059579, DK077967), Фондация за изследване на младежкия диабет (7-2005-1152), Фондация Лари Л. Хилблом и Фондация за диабет Манпей Сузуки. Благодарни сме на нашите колеги от изследователския център на островчето Лари Хилблом за техните отлични предложения.
Двойственост на интереса
Авторите заявяват, че не съществува двойственост на интересите, свързана с този ръкопис.
Информация за автора
Принадлежности
Изследователски център на Лари Хилблом, Медицински факултет на Дейвид Гефен, UCLA, 900 Weyburn Place #A, Лос Анджелис, Калифорния, 90024-2852, САЩ
Y. Saisho, A. E. Butler, E. Manesso, R. Galasso, T. Gurlo & P. C. Butler
Катедра по информационно инженерство, Университет в Падуа, Падуя, Италия
E. Manesso, G. M. Toffolo & C. Cobelli
Катедра по патология, Медицински факултет на Университета Уейк Форест, Уинстън-Салем, Северна Каролина, САЩ
L. Zhang, K. Kavanagh & J. D. Wagner
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
- Спрете подуването на корема и менопаузата наддаване на тегло с периодично гладуване
- Връзка между разграждането на целулозата в почвата и характеристиките на дървесните насаждения в
- Връзка между невропатичната болка и затлъстяването
- Връзка между литий и наддаване на тегло
- Постнаталният скелетен растеж се обуславя от потенциалните последици за нишата на епифизарните стволови клетки